| |
| Med Sci (Paris). 2013 January; 29(1): 107–109. Published online 2013 January 25. doi: 10.1051/medsci/2013291023.Antagonistes de PAR1 Vers une nouvelle stratégie de lutte contre la grippe Bruno Lina1 and Béatrice Riteau1,2* 1Virologie et pathologie humaine, EA 4610, Université Lyon1, Faculté de médecine RTH Laennec, Rue Guillaume Paradin, 69008Lyon, France 2INRA Tours, Nouzilly, France MeSH keywords: Antiviraux, Humains, Inflammation, Virus de la grippe A, Grippe humaine, prévention et contrôle, Récepteur de type PAR-1, antagonistes et inhibiteurs , physiologie |
La grippe est une maladie contagieuse due à une infection par le virus influenza. Il existe trois types de virus influenza (A, B, C), parmi lesquels les virus influenza de type A (IAV) sont les plus virulents chez l’homme. Ces virus sont répartis en sous-types en fonction de leurs glycoprotéines de surface, l’hémagglutinine (HA, 16 sous-types différents) et la neuraminidase (NA, 9 sous-types différents). Très souvent banalisée, la grippe constitue pourtant un problème majeur de santé publique à l’échelle planétaire. Elle engendre en effet des épidémies saisonnières et des pandémies sporadiques chez l’homme et touche chaque année plusieurs dizaines de millions de personnes entraînant 200 000 à 500 000 décès à l’échelle planétaire [
1]. |
Stratégies actuelles de protection contre la grippe et leurs limitations La meilleure façon de se protéger contre la grippe reste la vaccination. Cependant, le vaccin doit être ajusté chaque année en fonction des souches circulantes et n’aurait aucune efficacité contre de nouvelles souches d’IAV qui pourraient émerger du réservoir animal ou contre des virus hautement pathogènes comme le H5N1. Ainsi le développement de vaccins universels contre la grippe constitue un réel défi pour la recherche actuelle [
2,
10] (→).
(→) Voir la Nouvelle de Cyrille Dreyfus, page 22 de ce numéro
Outre la vaccination (préventive), il est possible de traiter les patients infectés par des molécules antivirales spécifiques (curatives). Ces dernières, dirigées contre des protéines virales, visent à diminuer le pouvoir réplicatif du virus, réduisant ainsi l’intensité des symptômes, la durée de la maladie et le risque de contamination. Il existe deux classes d’antiviraux : les inhibiteurs de la neuraminidase - zanamivir (Relenza®) et oseltamivir (Tamiflu®) -, et les inhibiteurs de la protéine M2 - rimantadine et amantadine. Ces derniers, qui ne sont actifs que sur les virus de type A, ne sont plus commercialisés en France et tous les virus circulant chez l’homme sont devenus résistants aux inhibiteurs de M2 [
3]. La NA, quant à elle, présente un risque de mutation très élevé entraînant l’apparition de virus résistants [
4]. L’utilisation inadaptée de ces antiviraux, ou des processus complexes de sélection des mutants naturellement résistants, peuvent entraîner une sélection positive de virus résistants. Cette sélection positive peut mettre en péril l’efficacité de la dernière classe thérapeutique actuellement disponible. |
Une nouvelle stratégie antigrippale : cibler l’inflammation non contrôlée Le pouvoir pathogène du virus n’est pas uniquement lié à son pouvoir réplicatif [1]. Comme toute infection, la grippe entraîne le déclenchement d’une réponse immunitaire indispensable pour éliminer le virus. Dans certains cas, cette réaction est disproportionnée ce qui, in fine, est délétère pour l’organisme. Ainsi, au cours de la grippe, certains aspects du processus physiopathologique observé correspondraient à l’induction d’un « orage cytokinique » dans le poumon [
5]. Cette sécrétion inappropriée de cytokines serait responsable de la défaillance des fonctions pulmonaires limitant les capacités respiratoires du patient et entraînant son décès dans les cas les plus sévères. Une voie de recherche alternative pour enrayer efficacement ces formes graves consisterait à contrôler l’inflammation induite par le pathogène afin d’en limiter les effets délétères, tout en laissant à notre corps la capacité d’éliminer luimême le virus. Cette stratégie aurait le double avantage d’être indépendante de la souche virale et de ne pas induire de pression de sélection virale pouvant conduire à l’émergence de virus résistants au traitement. |
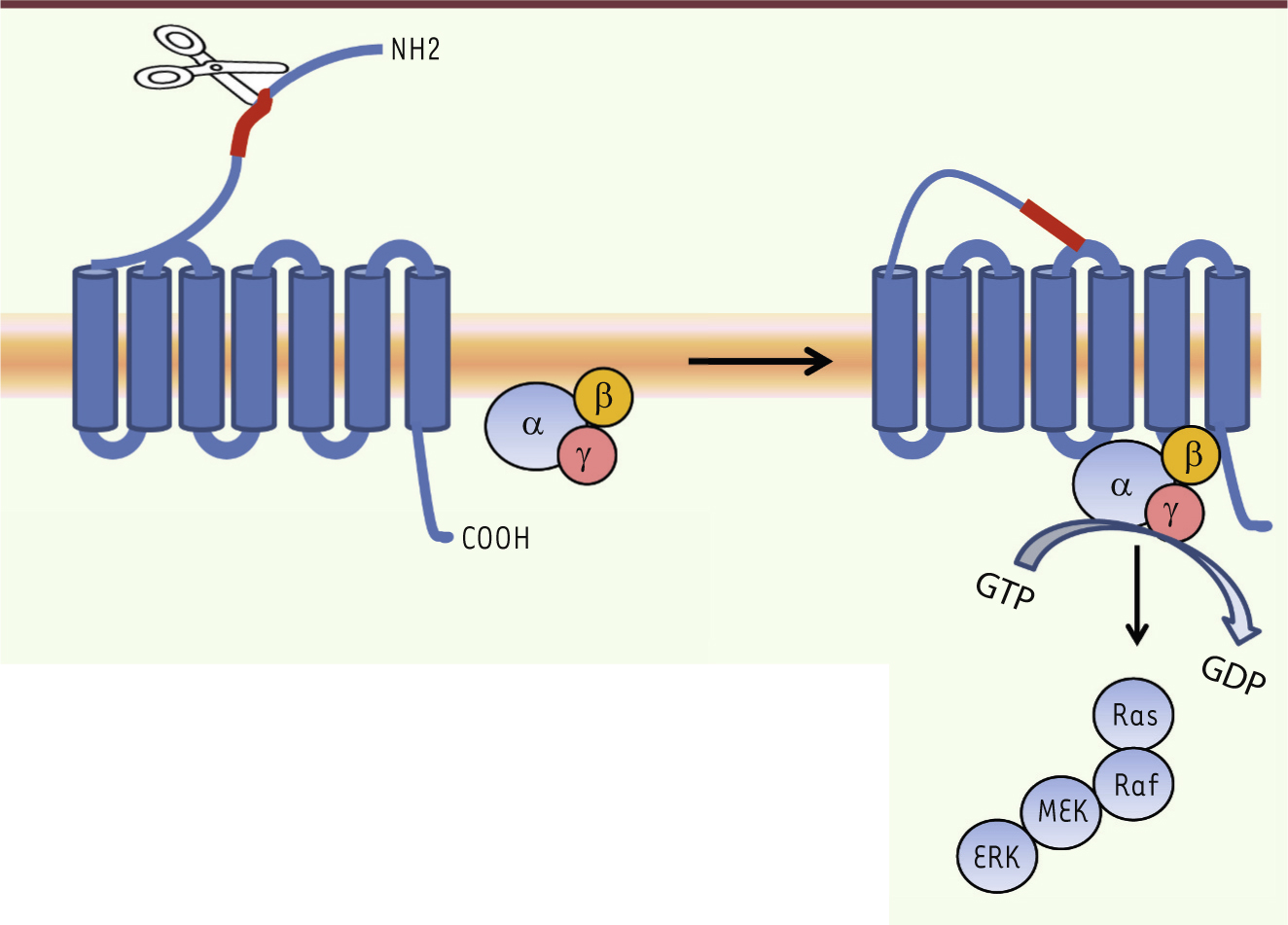
PAR1 joue un rôle central dans l’inflammation incontrôlée Les sites de réplication virale dans le tractus respiratoire sont localisés dans un microenvironnement complexe, très riche en protéases extracellulaires. Certaines de ces protéases jouent un rôle sur la réplication virale mais également sur la réponse immunitaire [
6,
7]. En effet, ces protéases sont des médiateurs connus des processus inflammatoires via l’activation d’une famille de récepteurs, les récepteurs activés par les protéases (ou PAR pour protease-activated receptor). À l’heure actuelle, quatre récepteurs PAR, activés par différentes protéases, ont été identifiés (PAR1 à 4). Après clivage du récepteur par la protéase, la nouvelle séquence amino-terminale libérée entraîne l’activation du récepteur [
8] (Figure 1). Parmi ces récepteurs, PAR2 joue un rôle protecteur vis-à-vis de l’infection IAV [7]. PAR1 quant à lui est un récepteur pro-inflammatoire notoire qui est activé par la thrombine. Or, cette protéase est présente au niveau des sites infectieux et PAR1 est surexprimé à la surface des cellules au cours d’une infection grippale. Nous avons donc étudié si PAR1 jouait un rôle dans la pathogenèse des infections IAV. Nous avons observé que l’administration intranasale d’agonistes stimulant spécifiquement PAR1 augmentait le taux de mortalité des souris infectées par IAV (souche A/PR/8/34, H1N1) en comparaison avec des souris non stimulées [
9]. Nous avons par ailleurs observé que cet effet délétère s’accompagnait d’une inflammation accrue des poumons. Nous avons donc conclu que PAR1 jouait un rôle important dans l’inflammation excessive induite par les virus de la grippe. Ces résultats ont été confirmés par l’utilisation de souris déficientes en PAR1 qui étaient protégées de l’infection grippale.
 | Figure 1.
Activation des PAR. Le PAR est un récepteur à sept domaines transmembranaires dont l’extrémité amino-terminale est clivée par une protéase. Une fois clivée, la nouvelle extrémité se lie au récepteur qui s’autoactive. La voie de signalisation en aval fait intervenir les protéines G (α, β et γ). |
|
Antagonistes de PAR1 : une nouvelle stratégie antigrippale Puisque la production excessive de cytokines pro-inflammatoires pourrait être responsable de certaines formes de grippe sévère, nous avons testé si une molécule antagoniste de PAR1 pouvait limiter cette inflammation et protéger contre la mortalité induite par IAV. Nos résultats chez la souris ont confirmé notre hypothèse : l’administration d’antagonistes de PAR1 (molécule SCH79797) permet la survie des souris infectées par les virus IAV (A/PR/8/34) et cette protection est corrélée à une inhibition (1) de l’inflammation pulmonaire (sans qu’elle ne disparaisse totalement) et (2) de la réplication virale précoce dans les poumons. En conséquence, le virus a été éliminé par le système immunitaire chez la souris, et aucune cascade cytokinique délétère n’a été déclenchée. Cet effet protecteur des antagonistes de PAR1 a été également observé contre des virus de sous-type H3N2 et H1N1 résistants à l’oseltamivir (Tamiflu®), sous-types retrouvés lors des épidémies saisonnières ; il s’exerce aussi contre des virus H5N1 hautement pathogènes (MB1). Ces résultats suggèrent que des antagonistes de PAR1 pourraient être efficaces pour traiter les patients infectés par des virus très pathogènes (H5N1) ou hautement épidémiques (H1N1, H3N2). |
Des antagonistes de PAR1 ont permis de maîtriser les effets délétères de l’inflammation dans le poumon causée par le virus de la grippe chez la souris, et d’inhiber précocement la réplication virale suite à cette infection. En ciblant une protéine de l’hôte impliquée dans l’emballement cytokinique excessif, et non le virus, ce traitement limiterait la sélection de virus résistants. Par ailleurs, cela pourrait permettre le développement d’un traitement symptomatique universel contre tous les virus de la grippe. Ce traitement pourrait également être associé aux traitements existants pour enrayer encore plus efficacement la maladie. |
Bruno Lina déclare participer à des interventions ponctuelles (essais cliniques et travaux scientifiques, rapports d’expertise et conférences de formation) pour l’entreprise Roche.
Béatrice Riteau déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article (un brevet a toutefois été déposé sur l’utilisation d’antagonistes de PAR1 contre la grippe).
|
1.
Kuiken
T
,
Riteau
B
,
Fouchier
RA
,
Rimmelzwaan
GF.
Pathogenesis of influenza virus infections: the good, the bad and the ugly . Curr Opin Virol.
2012; ; 2 : :276.–286. 2.
Doherty
PC
,
Kelso
A.
Toward a broadly protective influenza vaccine . J Clin Invest.
2008; ; 118 : :3273.–3275. 3.
Ison
MG.
Antivirals and resistance: influenza virus . Curr Opin Virol.
2011; ; 1 : :563.–573. 4.
Ferraris
O
,
Lina
B.
Mutations of neuraminidase implicated in neuraminidase inhibitors resistance . J Clin Virol.
2008; ; 41 : :13.–19. 5.
de Jong
MD
,
Simmons
CP
,
Thanh
TT
, et al.
Fatal outcome of human influenza A (H5N1) is associated with high viral load and hypercytokinemia . Nat Med.
2006; ; 12 : :1203.–1207. 6.
Riteau
B
,
de Vaureix
C
,
Lefevre
F.
Trypsin increases pseudorabies virus production through activation of the ERK signalling pathway . J Gen Virol.
2006; ; 87 : :1109.–1112. 7.
Khoufache
K
,
LeBouder
F
,
Morello
E
, et al.
Protective role for protease-activated receptor-2 against influenza virus pathogenesis via an IFN-gamma-dependent pathway . J Immunol.
2009; ; 182 : :7795.–7802. 8.
Coughlin
SR
,
Camerer
E.
PARticipation in inflammation . J Clin Invest.
2003; ; 111 : :25.–27. 9.
Khoufache
K
,
Berri
F
,
Nacken
W
, et al.
PAR1 contributes to influenza A virus pathogenicity in mice . J Clin Invest.
2012 ;
décembre 3;. doi: pii: 61667. 10.1172.. 10.
Dreyfus
C.
Vers un vaccin universel contre la grippe ?
Med Sci (Paris).
2013; ; 29 : :22.–25. |