| |
| Med Sci (Paris). 2012 December; 28(12): 1069–1071. Published online 2012 December 21. doi: 10.1051/medsci/20122812017.Le switch angiogénique ou comment réveiller les cellules tumorales dormantes Julie Bensimon1* 1Laboratoire de cancérologie expérimentale (DSV/IRCM/SREIT/LCE), 18, route du Panorama, BP n° 6, 92265Fontenay-aux-Roses Cedex, France MeSH keywords: Agents angiogéniques, métabolisme, Cycle cellulaire, génétique, physiologie, Éicosanoïdes, pharmacologie, Gènes switch, Protéines du choc thermique HSP27, Humains, Modèles biologiques, Métastase tumorale, Maladie résiduelle, vascularisation, anatomopathologie, Cellules souches tumorales, Néovascularisation pathologique |
Rôle du switch angiogénique dans la sortie de dormance tumorale Le terme de « dormance tumorale » désigne la persistance de cellules tumorales en petit nombre dans l’organisme, sans croissance tumorale. Le phénomène de dormance tumorale est décrit depuis près d’un demi-siècle, mais les mécanismes le sous-tendant sont encore mal connus. Par exemple, en 1987, des autopsies médico-légales réalisées sur 110 femmes jeunes et d’âge moyen, décédées de causes non naturelles, ont montré, chez 20 % d’entre elles, la présence de tumeurs microscopiques, alors qu’un cancer du sein n’avait été diagnostiqué que chez 1% d’entre elles [
1]. Ces foyers tumoraux dormants peuvent non seulement précéder le développement d’un cancer in situ, mais, lorsque la tumeur primaire est détectable et diagnostiquée, ils peuvent également être à l’origine de micrométastases. Dans ce cas, la sortie de dormance détermine la prolifération métastatique du cancer dans l’organisme [
2]. L’obtention de modèles expérimentaux de la dormance tumorale nécessite d’établir un équilibre entre l’hôte et la tumeur, comme le montre un modèle murin de tumeurs chimio-induites décrit par B. Quesnel dans médecine/sciences [
3]. Dans ce modèle, certaines tumeurs induites restent dormantes jusqu’à ce que l’immunité adaptative de l’animal soit altérée, ce qui déclenche le développement des tumeurs [3]. Ce type de modèle met en évidence le rôle important joué par le système immunitaire de l’hôte dans le maintien des tumeurs à l’état de dormance : les tumeurs qui se développent sont celles qui parviennent à échapper au contrôle immunitaire. Un second processus clé dans la sortie de dormance est la capacité de la tumeur à contrôler l’angiogenèse. Ainsi, J. Folkman et D. Hanahan ont attribué en 1989 un rôle critique au « switch angiogénique » dans la sortie de dormance tumorale, c’est-à-dire à la capacité de la tumeur à établir un réseau vasculaire connecté avec son environnement [
4,
5]. Bien que les cellules tumorales prolifèrent à la même vitesse, les tumeurs qui grossissent sont celles qui parviennent à former un réseau vasculaire, les autres restent microscopiques parce que le taux d’apoptose y est élevé. La progression tumorale dépend de la balance entre les facteurs angiogéniques sécrétés par la tumeur (fibroblast growth factor [FGF], vascular endothelial growth factor [VEGF], interleukine 8, platelet derived growth factor [PDGF], etc.), et les défenses antiangiogéniques de l’hôte (thrombine 1, endostatine, angiostatine, etc.) [
6,
7]. Des résultats publiés en 2006 par G.N. Naumov et al. suggèrent un rôle clé de la thrombine 1 et du FGF basique dans l’établissement du switch angiogénique pour différents types de tumeurs [
8], mais les acteurs moléculaires contrôlant la sécrétion de ces facteurs angiogéniques sont peu connus. Deux articles publiés récemment apportent de nouvelles perspectives pour la compréhension de ce phénomène.
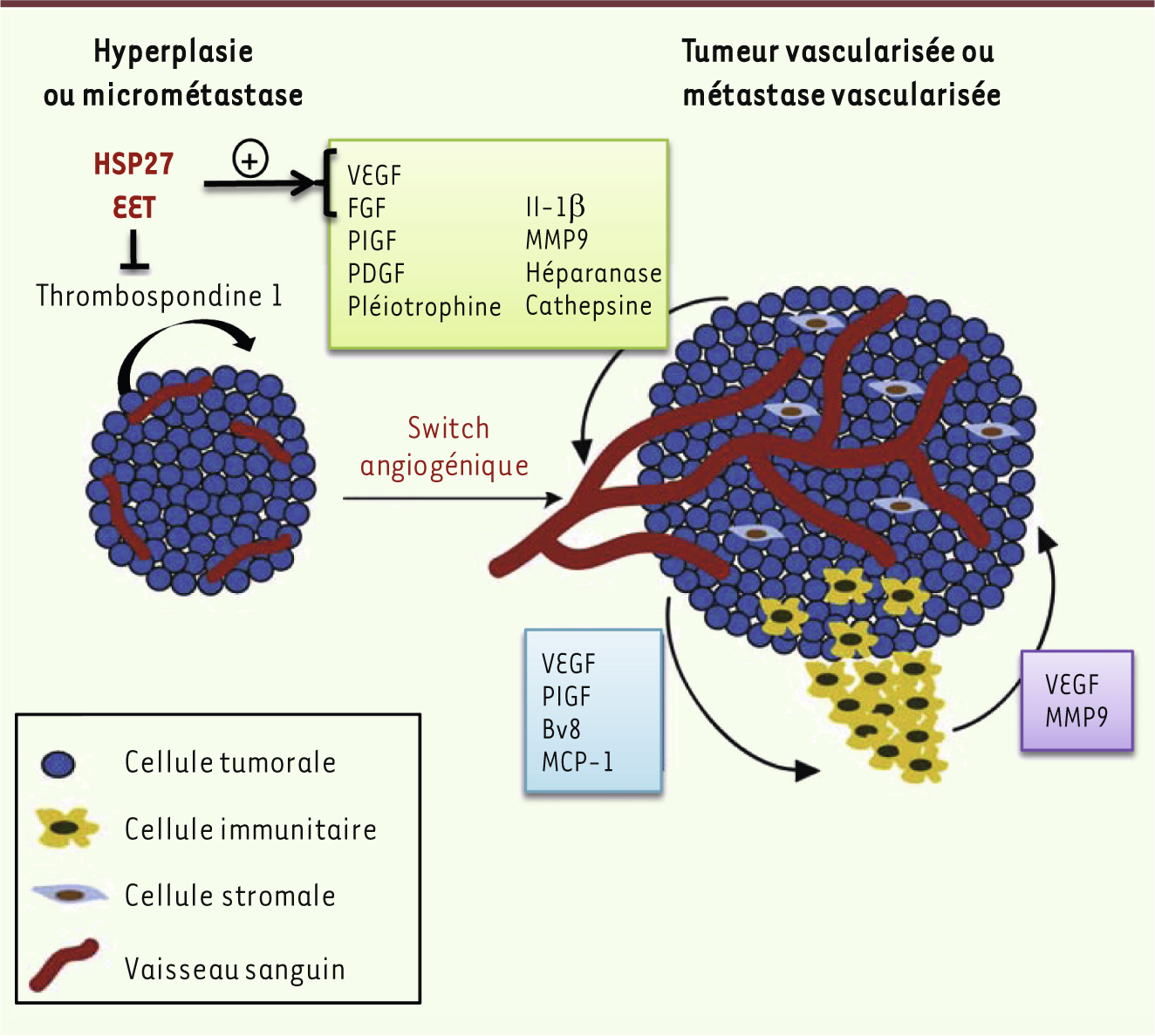
 | Figure 1.
Représentation schématique des médiateurs moléculaires et cellulaires du switch angiogénique. L’équilibre entre les facteurs pro- et anti-angiogéniques secrétés contrôle le switch angiogénique et la sortie de dormance tumorale. De nouveaux travaux ont démontré une implication de HSP27 ( heat shock protein) et des époxyeicosanoïdes (EET) dans ce phénomène (adapté de [ 6]). MMP9 : matrix metalloproteinase 9 ; MCP-1 : monocyte chemotactic protein-1 ; PIGF : placenta growth factor ; PDGF : platelet-derived growth factor ; VEGF : vascular endothelial growth factor ; FGF : fibroblast growth factor. |
|
Heat shock protein 27 et switch angiogénique Si les facteurs angiogéniques secrétés sont des acteurs clés du switch angiogénique, un article publié par O. Straume et al. montre que la protéine HSP27 (heat shock protein 27) y participerait activement [
9]. Les HSP sont des protéines induites par une large gamme de dommages cellulaires, parmi lesquels ceux qu’induisent les thérapies anticancéreuses. Les HSP agissent notamment par leur fonction antiapoptotique et sont exprimées de manière anormalement élevée dans certaines tumeurs, et de ce fait sont des cibles de choix pour le développement de thérapies anticancéreuses [
10–
12]. Pour explorer ce rôle des HSP, O. Straume et al. ont utilisé un modèle précédemment cité [8] de cellules angiogéniques (A) et non angiogéniques (NA) dérivées de la même lignée cellulaire tumorale mammaire humaine MDA-MB-436. Les cellules A forment des tumeurs proliférantes lorsqu’elles sont injectées à des souris immunodéficientes, tandis que les cellules NA forment des microtumeurs non palpables et non vascularisées. Les auteurs montrent une forte surexpression des transcrits et de la protéine HSP27 dans les cellules A par rapport aux cellules NA. De plus, l’inhibition de l’expression de HSP27 dans les cellules A par shARN (short hairpin ARN) réduit l’expression des facteurs angiogéniques VEGF-A, VEGF-C et bFGF et inhibe drastiquement la prolifération de ces cellules lorsqu’elles sont injectées à des souris SCID (severe combined immunodeficiency). Inversement, la surexpression de HSP27 dans les cellules NA induit une signature moléculaire composée de facteurs intervenant dans l’angiogenèse. Cette signature présente un intérêt pronostique et permet notamment de prédire statistiquement une réduction de la survie globale chez les patientes atteintes de cancer du sein. HSP27 intervient-elle via une prolifération tumorale accrue ou une augmentation de l’angiogenèse ? Lorsque HSP27 est inhibée, les cellules A forment des tumeurs dont la densité en microvaisseaux est réduite : ces vaisseaux ne semblent pas fonctionnels et les cellules endothéliales qui leur sont associées prolifèrent peu. Ces tumeurs prolifèrent normalement, mais le taux d’apoptose y est beaucoup plus élevé (50 %) que dans les tumeurs (formées par les cellules A contrôles). Ces observations tendent à montrer que HSP27 contrôlerait la vascularisation tumorale dans ce modèle cellulaire via la sécrétion de facteurs angiogéniques. O. Straume et al. [9] attribuent à HSP27 un rôle dans la sortie de dormance tumorale via le switch angiogénique. Cette étape, cruciale pour la formation de tumeurs macroscopiques, serait coordonnée par HSP27 et réalisée grâce à des facteurs angiogéniques tels que VEGF et bFGF, dont le rôle dans le switch angiogénique est connu depuis longtemps. Dans ce cas, le contrôle de l’expression de HSP27 se révèlerait être une stratégie thérapeutique efficace : si inhiber HSP27 n’empêche pas la formation de la tumeur, cela permet de maintenir celle-ci à l’état de dormance. En effet, il semble que l’inhibition de HSP27 fasse ses preuves, puisque la molécule OGX-427, un oligonucléotide ciblant HSP27 et bien toléré par l’organisme, est désormais testé dans des essais cliniques de phase II dans le traitement de différents types de tumeurs [
13,
14]. |
Action des époxyeicosanoïdesdans le processus métastatique Un autre type de molécule permettrait le contrôle du switch angiogénique. Les acides époxyeicosatriénoïques (EET) sont des messagers produits à partir de l’acide arachidonique, majoritairement dans le tissu endothélial, grâce aux cytochromes P450 époxygénases, et dégradés par une époxide hydrolase. Ces molécules EET ont un effet angiogénique connu, et sont actuellement en cours d’essai clinique dans le traitement de l’hypertension artérielle. En utilisant un modèle de dormance tumorale par injection de faibles doses de cellules humaines de liposarcome à des souris, D. Panigrahy et al. [
15] ont montré qu’un taux élevé d’EET (via l’administration d’EET exogènes ou la manipulation des taux endogènes d’EET dans les cellules endothéliales de souris transgéniques) induit la sortie de dormance tumorale et la croissance de tumeurs primaires macroscopiques, et augmente le pouvoir métastatique de ces tumeurs. L’action prométastatique des EET est-elle due à une dissémination accrue des cellules circulantes ou à une sortie de dormance des micrométastases déjà formées ? Afin de distinguer entre une action angiogénique locale des EET aux sites métastatiques ou une action systémique, les auteurs ont utilisé un modèle ingénieux de parabiose, consistant en un système de circulation sanguine partagé entre une souris donneuse portant une tumeur, et une souris receveuse sans tumeurs. Dans ce modèle, lorsque les souris donneuses et receveuses expriment des taux élevés d’EET, la souris receveuse développe des métastases à partir de la tumeur primaire de la souris donneuse. En revanche, lorsque seule la souris donneuse exprime des taux élevés d’EET, la souris receveuse ne développe pas de métastases palpables, même si des cellules métastatiques sont détectables dans la circulation. La sécrétion locale au site métastatique de taux élevés d’EET est donc indispensable au développement de macrométastases, provenant a priori de foyers métastatiques dormants qui subiraient donc un switch angiogénique. L’augmentation des EET accroît l’angiogenèse, via notamment l’induction de la sécrétion de VEGF et la surexpression du récepteur VEGFR2, ainsi que l’inhibition de la molécule anti-angiogénique thrombospondine 1. Autre point important, les auteurs montrent que ces résultats peuvent être dupliqués par la modulation pharmacologiques des taux d’EET, qu’il s’agisse d’activation ou d’inhibition. Il est donc particulièrement important d’être prudent dans la modulation thérapeutique de ces médiateurs lipidiques, même si des antagonistes des EET pourraient s’avérer des outils thérapeutiques intéressants pour inhiber la croissance de la tumeur primaire et le processus métastatique. Les molécules décrites ici, HSP27 et acides époxyeicosatriénoïques, présentent une activité protumorale liée à l’induction de facteurs angiogéniques et à l’inhibition de facteurs antiangiogéniques. Ces deux types de molécules joueraient un rôle dans l’établissement du switch angiogénique et dans la sortie de dormance tumorale, la première en agissant sur la croissance de la tumeur primaire et les secondes en favorisant en particulier le développement de foyers secondaires métastatiques. L’enjeu essentiel de ce type de recherches est ainsi de parvenir un jour à maintenir à l’état dormant des tumeurs parfois difficiles à éliminer complètement. |
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Nielsen
M
,
Thomsen
JL
,
Primdahl
S
, et al.
Breast cancer and atypia among young and middle-aged women: a study of 110 medicolegal autopsies . Br J Cancer.
1987; ; 56 : :814.–819. 2.
Akslen
LA
,
Naumov
GN.
Tumor dormancy: from basic mechanisms to clinical practice . Apmis.
2008; ; 116 : :545.–547. 3.
Quesnel
B.
«Je te tiens, tu me tiens». Dormance tumorale : un équilibre instable?
Med Sci (Paris).
2008; ; 24 : :575.–576. 4.
Folkman
J
,
Hanahan
D.
Switch to the angiogenic phenotype during tumorigenesis . Princess Takamatsu Symp.
1991; ; 22 : :339.–347. 5.
Folkman
J
,
Watson
K
,
Ingber
D
,
Hanahan
D.
Induction of angiogenesis during the transition from hyperplasia to neoplasia . Nature.
1989; ; 339 : :58.–61. 6.
Baeriswyl
V
,
Christofori
G.
The angiogenic switch in carcinogenesis . Semin Cancer Biol.
2009; ; 19 : :329.–337. 7.
Folkman
J
,
Kalluri
R.
Cancer without disease . Nature.
2004; ; 427 : :787.. 8.
Naumov
GN
,
Bender
E
,
Zurakowski
D
, et al.
A model of human tumor dormancy: an angiogenic switch from the nonangiogenic phenotype . J Natl Cancer Inst.
2006; ; 98 : :316.–325. 9.
Straume
O
,
Shimamura
T
,
Lampa
MJ
, et al.
Suppression of heat shock protein 27 induces long-term dormancy in human breast cancer . Proc Natl Acad Sci USA.
2012; ; 109 : :8699.–8704. 10.
Jego
G
,
Hazoumé
A
,
Seigneuric
R
,
Garrido
C.
Targeting heat shock proteins in cancer . Cancer Lett.
2010 ,
novembre 13; (online). 11.
Didelot
C
,
Garrido
C.
HSP90 mitochondriale : la cible à inactiver dans la thérapie anti-cancéreuse ?
Med Sci (Paris).
2008; ; 24 : :363.–364. 12.
Garrido
C
,
Collura
A
,
Berthenet
K
, et al.
Mutation d’HSP110 dans les cancers colorectaux : le paradoxe du chaperon qui ne protège plus . Med Sci (Paris).
2012; ; 28 : :9.–10. 13.
Baylot
V
,
Andrieu
C
,
Katsogiannou
M
, et al.
OGX-427 inhibits tumor progression, enhances gemcitabine chemotherapy in pancreatic cancer . Cell Death Dis.
2011; ; 2 : :e221.. 14.
Rexer
H.
First line therapy for local advanced or metastasized urothelial carcinoma: randomized double-blind phase II study to compare gemcitabin and cisplatin in combination with OGX-427 or placebo for advanced transitional cell carcinoma of the bladder (OGX-427 - AB 39/11 of the working group urological oncology . Urologe A.
2011; ; 50 : :1617.–1618. 15.
Panigrahy
D
,
Edin
ML
,
Lee
CR
, et al.
Epoxyeicosanoids stimulate multiorgan metastasis and tumor dormancy escape in mice . J Clin Invest.
2012; ; 122 : :178.–191. |