| |
| Med Sci (Paris). 2012 December; 28(12): 1060–1063. Published online 2012 December 21. doi: 10.1051/medsci/20122812014.Blocage des fonctions cognitives dans la maladie d’Alzheimer Un mécanisme épigénétique dévoilé ? Damien Rei1* 1Tsai lab, Picower Institute for learning and memory, Brain and cognitive science department, Massachussetts Institute of Technology (MIT), Cambridge, MA02139-4 Cambridge, États-Unis MeSH keywords: Maladie d'Alzheimer, complications, génétique, physiopathologie, Animaux, Cognition, physiologie, Troubles de la cognition, étiologie, Épigenèse génétique, Histone Deacetylase 2, métabolisme, Humains, Souris, Modèles biologiques, Transduction du signal, Stress psychologique |
La maladie d’Alzheimer (MA) est caractérisée par une déficience progressive des capacités mnésiques et cognitives chez les patients atteints. Les coûts humains et sociétaux associés sont énormes (en 2010 environ 640 milliards de dollars à l’échelle mondiale) et le nombre de personnes atteintes devrait tripler d’ici à 2050. Même si l’effort de recherche est très important, l’étiologie de cette maladie est mal comprise et aucun traitement efficace n’existe encore. Une des hypothèses privilégiées est celle de la voie amyloïde où le clivage de la protéine précurseur de l’amyloïde (APP) provoque la génération du peptide β-amyloïde (Aβ), responsable de la mort neuronale associée à la maladie, et ce notamment dans les zones du cerveau impliquées dans la mémoire. Une des structures particulièrement affectées par la maladie est l’hippocampe qui est située dans le lobe temporal médian et est impliquée dans la formation de la mémoire épisodique (autobiographique). |
Épigénétique et maladie d’Alzheimer : premières suspicions Nous avons récemment montré, dans une étude publiée dans Nature en mars 2012 [
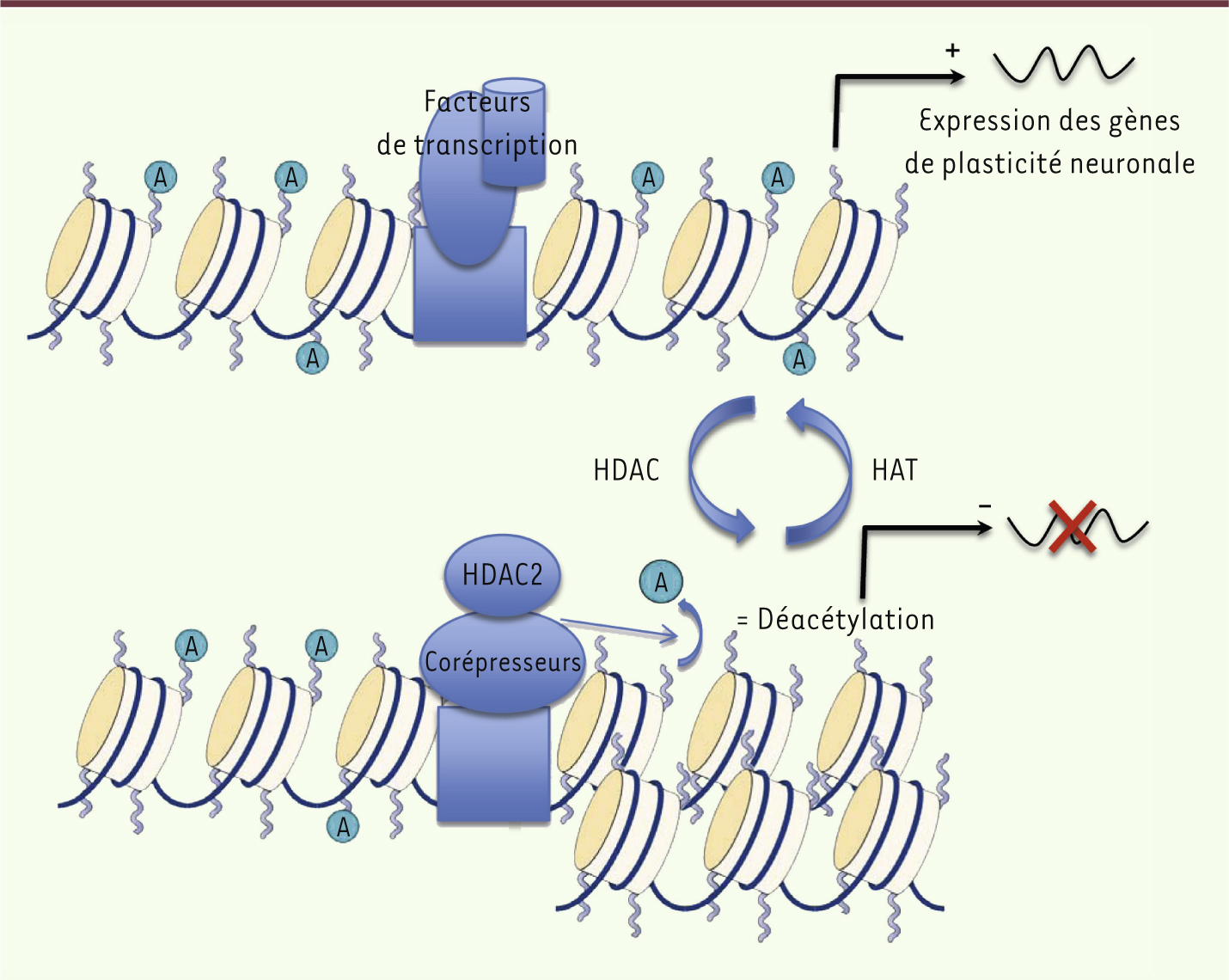
1], qu’un des mécanismes également en cause dans cette maladie est d’origine épigénétique, et que les modifications ainsi engendrées semblent réversibles. Une modification épigénétique de l’ADN agit sur l’expression des transcrits et donc des protéines sans changer la séquence d’ADN codante.Autrement dit, il n’y a pas de mutation génétique et seule l’accessibilité du gène est modifiée, avec comme corollaire une augmentation ou une diminution de son expression. Plusieurs familles d’enzymes sont responsables de ces modifications et notamment les histones déacétylases (HDAC). Ces dernières comprennent plusieurs membres et régulent de façon négative le processus d’acétylation de la chromatine (d’où leur nom). À l’inverse, les histones acétyltransférases (HAT) sont responsables de l’acétylation de la chromatine. Les groupements acétyl étant chargés négativement, l’acétylation par les HAT induit une structure plus ouverte de la chromatine ce qui, par conséquent, accroît l’accessibilité des gènes à la machinerie de transcription. Au contraire, les HDAC éliminant ces groupements, condensent la chromatine et diminuent l’expression des gènes concernés (Figure 1).
 | Figure 1.
Rôle de HDAC2 dans le mécanisme d’expression des gènes contrôlant la plasticité neuronale.
|
Cette découverte de l’intervention d’un mécanisme épigénétique dans la maladie d’Alzheimer fait suite à une série d’avancées au cours de ces dernières années dans la compréhension du rôle des HDAC dans cette affection. Nous avons ainsi montré antérieurement que des inhibiteurs des HDAC (inhibiteurs généraux qui bloquent les HDAC sans distinction de classe) étaient capables de restaurer la mémoire à long terme et l’apprentissage dans un modèle de maladie d’Alzheimer chez la souris [
2]. Une autre étude a ensuite établi l’importance physiologique d’une HDAC, HDAC2, dans la mise en place des mécanismes de mémoire et d’apprentissage [
3]. Le fait d’augmenter le niveau d’expression de HDAC2 de manière artificielle chez la souris suffit à diminuer les capacités mnésiques des animaux ainsi que l’expression de gènes associés aux mécanismes moléculaires de la mémoire et de l’apprentissage. La réciproque semble vraie puisque la diminution de l’expression de HDAC2 produit l’effet inverse, avec notamment une augmentation des capacités mnésiques. Néanmoins, le mécanisme moléculaire par lequel HDAC2 induit ces effets, ainsi que son implication possible dans la mise en place de la pathologie de type Alzheimer, restaient inconnus. |
Rôle du niveau d’expression de HDAC2 au niveau de l’hippocampe dans la perte mnésique au cours de la pathologie d’Alzheimer Pour répondre à ces questions sur le rôle de HDAC2 dans la maladie d’Alzheimer, nous avons examiné sa fonction chez les souris CK-p25, un modèle murin de cette maladie développé dans notre laboratoire [
4]. Ces souris sont modifiées génétiquement de façon à surexprimer p25, une protéine toxique produite dans le cadre de nombreuses pathologies neurodégénératives, dont la maladie d’Alzheimer. La surexpression de p25 induit un phénotype très proche de celui de la pathologie humaine associant une accumulation intracérébrale de peptides β-amyloïdes, une pathologie de type Tau ainsi qu’une perte neuronale et synaptique importante associée à une diminution des capacités mnésiques (Figure 2).
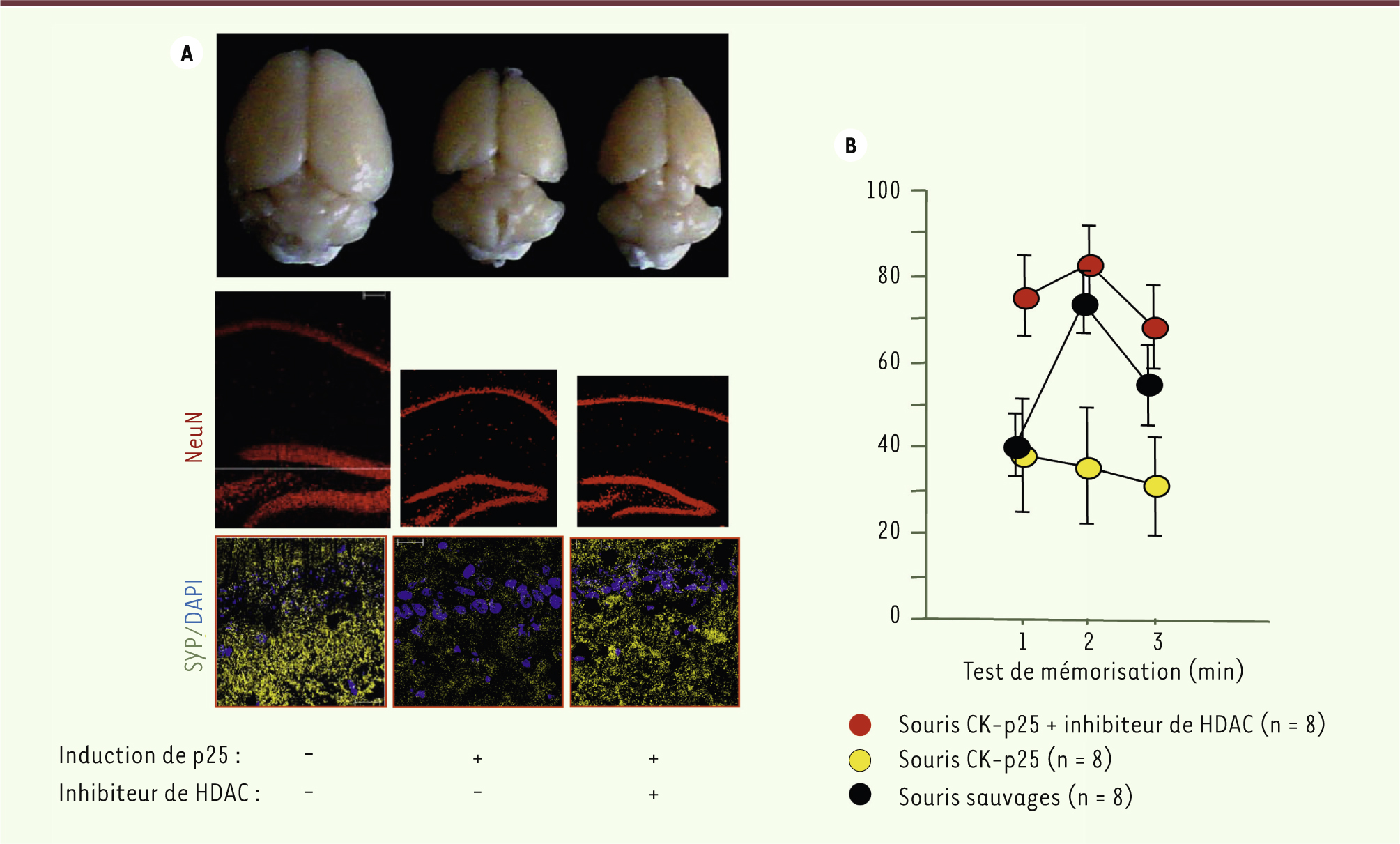
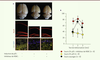 | Figure 2.
Un inhibiteur de HDAC restaure le déficit de mémorisation chez les souris CK-p25. A. La comparaison entre un cerveau de souris CK-p25 après six semaines de surexpression de p25 (centre) et celui d’une souris sauvage (gauche) permet d’apprécier l’atrophie du cerveau antérieur due à la neurodégénérescence induite par p25 et à une perte synaptique importante. Cette perte neuronale et synaptique est visible après marquage de la protéine NeuN (en rouge) ou de la synaptophysine (SYP) (en jaune) au niveau de l’hippocampe, et permet d’apprécier les différences entre les souris CK-p25 et sauvages. Le traitement avec l’inhibiteur de HDAC n’a pas d’effet sur la perte neuronale (atrophie toujours présente dans les cerveaux traités [cerveau de droite] et perte neuronale toujours visible après marquage de la protéine NeuN), mais il améliore la perte synaptique (photographie en bas à droite). B. L’inhibiteur de HDAC restaure complètement les capacités de mémorisation des souris CK-p25 analysées dans le test d’induction de LTP (long-term potentiation). Dans ce dernier, des coupes d’hippocampes provenant de souris contrôles (en noir) montrent une induction de LTP normale. Les souris CK-p25 présentent un défaut d’induction (en jaune) que corrige le traitement par l’inhibiteur d’HDAC chez les souris CK-p25 traitées (en rouge). |
Or, l’expression de HDAC2 est élevée dans l’hippocampe de ces souris CK-p25. Il en est de même in vitro, après traitement de cellules d’hippocampe avec le peptide β-amyloïde ou avec de l’eau oxygénée H2O2 (qui mime le phénomène de stress oxydant associé à la maladie d’Alzheimer). Ces résultats, et en particulier l’augmentation in vivo de HDAC2 dans l’hippocampe des souris CK-p25, ont immédiatement attiré notre attention. En effet, d’une part, cette augmentation était restreinte aux zones du cerveau impliquées dans la mémoire et l’apprentissage, et épargnait d’autres zones associées à d’autres fonctions cérébrales. D’autre part, nous avions précédemment démontré que l’augmentation artificielle des niveaux d’expression de HDAC2 entravait considérablement les capacités mnésiques et d’apprentissage des animaux. Nous avons donc fait l’hypothèse qu’un processus similaire avait lieu dans la maladie d’Alzheimer et que l’augmentation d’HDAC2 dans l’hippocampe pouvait être un des fondements moléculaires responsable des pertes de mémoire associées à cette maladie. Pour tester cette hypothèse et comprendre quelles étaient les répercussions moléculaires de la surexpression d’HDAC2, nous avons caractérisé, après immunoprécipitation de la chromatine, les promoteurs des gènes auxquels HDAC2 était associée. Or, il s’avère que nombre de ces gènes sont impliqués dans la mémoire et l’apprentissage ; leur déacétylation avait comme conséquence une forte diminution de leur niveau d’expression. Cette diminution d’expression de ces gènes de plasticité neuronale dans le cadre de la maladie d’Alzheimer était déjà connue, mais nous en éclaircissons ici le mécanisme. Enfin, pour établir un lien de cause à effet entre l’augmentation des niveaux d’expression de HDAC2 et la diminution des capacités mnésiques dans ce modèle murin, nous avons réduit l’expression de HDCA2 in vivo. Pour ce faire, nous avons injecté dans l’hippocampe des souris CK-p25 un virus de type AAV (adeno-associated virus) ayant un fort tropisme pour les cellules nerveuses. Ce virus exprime une molécule fluorescente qui permet de visualiser les cellules infectées, et un shARN (small hairpin ARN) dirigé contre HDAC2. Chez les souris ainsi traitées, le niveau d’expression des gènes associés à l’apprentissage et à la mémoire a été restauré, le nombre de synapses a augmenté, et les souris ont récupéré quasiment complètement leurs capacités mnésiques. Au contraire, aucune amélioration n’a été observée chez les animaux traités par un shARN contrôle. Ces observations confirment donc l’implication de HDAC2 dans la mise en place des défauts de mémoire et d’apprentissage associés à la pathologie de type Alzheimer. Il faut souligner un point intéressant : cette régulation épigénétique est apparemment spécifique des dysfonctionnements de la mémoire dans cette maladie, puisque la perte neuronale associée n’a pas été modifiée par le traitement par le shARN. |
Alzheimer et HDCA2 : le rôle des médiateurs du stress Pour mieux comprendre le mécanisme moléculaire par lequel la maladie d’Alzheimer entraîne une augmentation de l’expression de HDAC2, nous avons analysé la séquence du promoteur du gène codant pour l’enzyme et trouvé un élément de reconnaissance pour le récepteur des glucocorticoïdes (GR), un facteur de transcription qui est phosphorylé et activé lors du stress en réponse à la sécrétion de cortisol (hormone de stress) [
5]. Or, il existe un lien potentiel entre maladie d’Alzheimer et stress, ce dernier pouvant représenter un facteur de risque pour cette affection. En effet, une personne anxieuse ou stressée a statistiquement près de deux fois et demi plus de chances d’être touchée par la maladie d’Alzheimer qu’une personne ne l’étant pas [
6]. Nous avons confirmé ce lien d’un point de vue moléculaire puisque dans des cellules d’hippocampe traitées avec des peptides β-amyloïdes ou avec de l’H2O2, une augmentation de HDAC2 était observée, concomitante de celle de la forme phosphorylée active de GR (P-GR). De plus, les niveaux d’expression de ces deux protéines étaient proportionnels, l’expression de P-GR était élevée dans les cellules dont l’expression d’HDAC2 était élevée. De plus, une fois activé, ce récepteur s’associait au promoteur de HDAC2 et ce dans les cellules traitées in vitro, mais également in vivo chez les souris CK-p25. Enfin, le blocage de l’expression de GR par un shARN entraînait également le blocage de l’augmentation de HDAC2, prouvant que l’activation de GR était bien responsable de l’augmentation du niveau d’expression de HDAC2. |
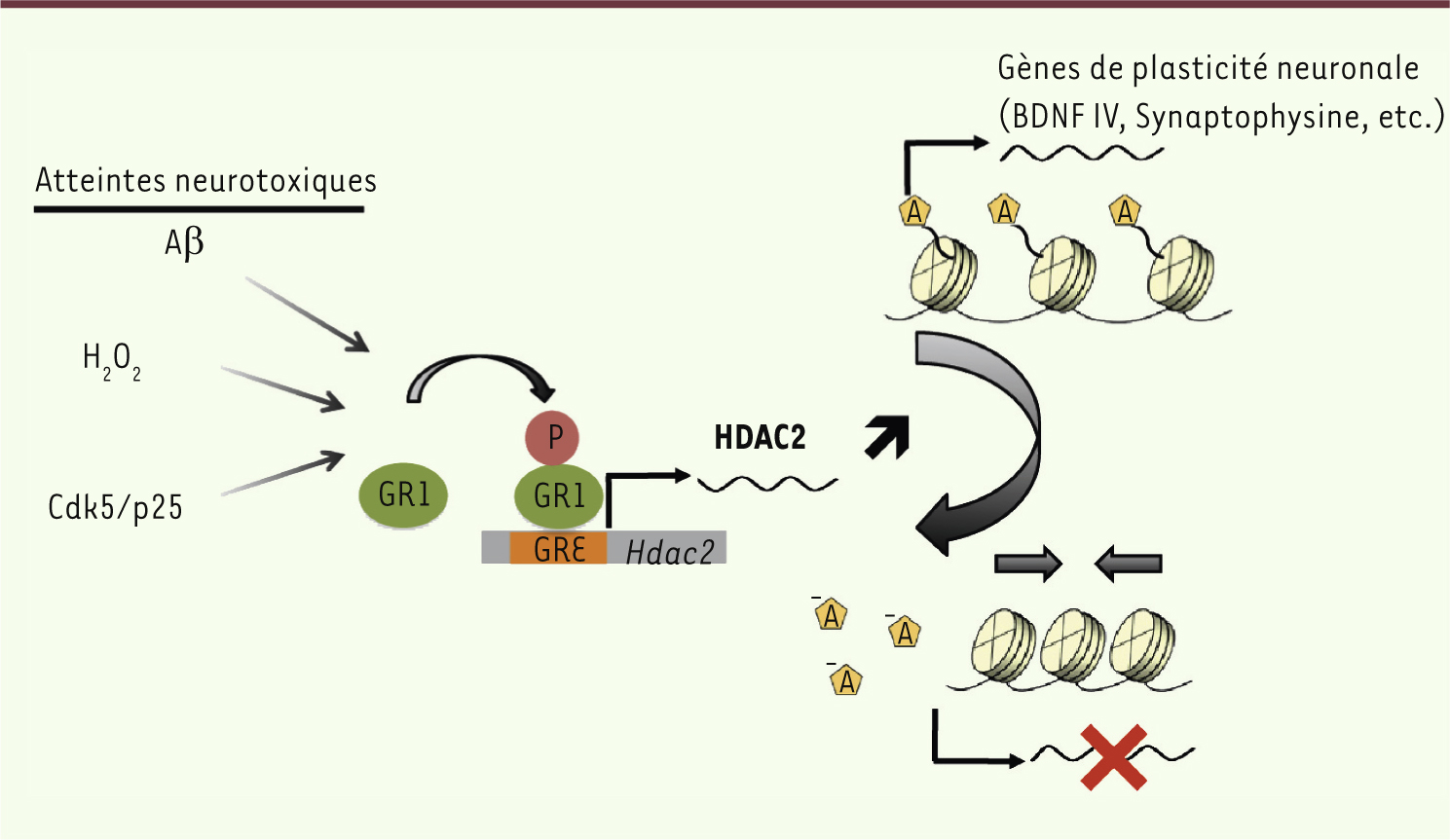
Ces résultats nous permettent de conclure que lors d’une atteinte de type Alzheimer, le stress oxydant et/ou les peptides β amyloïdes provoquent l’activation de GR, son association avec le promoteur de HDAC2 et l’augmentation d’expression de cette déacétylase à la fois dans les modèles murins de la maladie et chez les patients atteints (Figure 3). Ces résultats confirment le lien suggéré entre stress et risque de développement d’une maladie d’Alzheimer. Au-delà, l’observation d’une possible réversibilité du blocage épigénétique que HDAC2 semble exercer sur les capacités mnésiques des animaux, même lorsque la perte neuronale est importante, offre un espoir pour de potentielles approches thérapeutiques chez les patients atteints. Dans ce cadre, l’identification de HDAC2 dans ce mécanisme souligne l’intérêt de développer des inhibiteurs spécifiques pour la mise au point d’une thérapeutique ciblée pour cette affection.
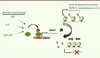 | Figure 3.
Rôle potentiel du récepteur aux glucocorticoïdes dans la pathologie de la maladie d’Alzheimer induite par le stress. GR1 : glucocorticoid receptor 1 ; GRE : glucocorticoid response element ; BDNF IV : brain-derived neurotrophic factor IV. |
|
L’auteur déclare n’avoir aucun lien d’intérêt avec les données publiées dans cet article.
|
1.
Graff
J
,
Rei
D
,
Guan
JS
, et al.
An epigenetic blockade of cognitive functions in the neurodegenerating brain . Nature.
2012; ; 483 : :222.–226. 2.
Fischer
A
,
Sananbenesi
F
,
Wang
X
, et al.
Recovery of learning and memory is associated with chromatin remodelling . Nature.
2007; ; 447 : :178.–182. 3.
Guan
JS
,
Haggarty
SJ
,
Giacometti
E
, et al.
HDAC2 negatively regulates memory formation and synaptic plasticity . Nature.
2009; ; 459 : :55.–60. 4.
Cruz
JC
,
Tseng
HC
,
Goldman
JA
, et al.
Aberrant Cdk5 activation by p25 triggers pathological events leading to neurodegeneration and neurofibrillary tangles . Neuron.
2003; ; 40 : :471.–483. 5.
Moisan
MP
,
Le Moal
M.
Le stress dans tous ses états . Med Sci (Paris).
2012; ; 28 : :612.–617. 6.
Wilson
RS
,
Barnes
LL
,
Bennett
DA
, et al.
Proneness to psychological distress and risk of Alzheimer disease in a biracial community . Neurology.
2005; ; 64 : :380.–382. |