| |
| Med Sci (Paris). 2012 December; 28(12): 1053–1055. Published online 2012 December 21. doi: 10.1051/medsci/20122812011.STIM1, CD36 lingual et perception gustative lipidique Souleymane Abdoul-Azize,1 Gado Dramane,1 Selvakumar Subramanium,1 Anne-Marie Simonin,1 Philippe Besnard,1 and Naim Akhtar Khan1* 1Physiologie de la nutrition et toxicologie (NUTox), UMR U866 Inserm, université de Bourgogne/AgroSup Dijon, 6, boulevard Gabriel, 21000Dijon, France MeSH keywords: Animaux, Antigènes CD36, métabolisme, physiologie, Signalisation du calcium, génétique, Matières grasses alimentaires, Réticulum endoplasmique, Préférences alimentaires, Humains, Protéines membranaires, Souris, Modèles biologiques, Protéines tumorales, Rats, Molécule-1 d'interaction stromale, Perception du goût, Langue |
Selon l’Organisation mondiale de la santé (OMS) [
1], l’obésité atteint des proportions épidémiques dans le monde, avec plus de 1,6 milliards d’adultes en surpoids et au moins 500 millions de personnes cliniquement obèses. Globalement, un adulte sur dix est obèse dans le monde. Cette situation a des conséquences importantes en termes de santé publique. En effet, l’obésité, particulièrement l’obésité viscérale, est un facteur de risque de pathologies telles que le diabète de type II, les atteintes cardiovasculaires, l’hypertension et certaines formes de cancers [
2]. Bien qu’il existe un déterminisme génétique, les facteurs environnementaux dont l’alimentation jouent un rôle important dans l’apparition de l’obésité [
3]. Dans le régime occidental, les lipides alimentaires représentent environ 40 % des apports caloriques journaliers alors que selon les recommandations nutritionnelles, cette proportion devrait être de 35 %. Des études comportementales récentes indiquent une préférence spontanée pour les lipides alimentaires chez le rongeur de laboratoire (rat, souris), ainsi que chez l’homme [
4]. On a longtemps cru que la perception orosensorielle des lipides alimentaires dépendait uniquement des propriétés texturales et olfactives de ces derniers, mais des découvertes récentes remettent en question ce point de vue restrictif et suggèrent que la gustation joue également un rôle important dans la perception orosensorielle des lipides alimentaires et pourrait donc être impliquée dans la préférence spontanée pour les aliments gras [4,
5]. |
CD36, un récepteur de lipides impliqué dans la détection orosensorielle des lipides alimentaires La glycoprotéine CD36 est détectée dans différents tissus dont l’épithélium lingual. Elle présente les caractéristiques structurales et fonctionnelles d’un récepteur de lipides gustatifs [5]. En effet, elle lie les acides gras à longue chaîne (AGLC) (nombre de carbones > 16) avec une très haute affinité, possède une structure de type récepteur avec une large poche hydrophobe extracellulaire flanquée de deux courts segments transmembranaires orientés dans le cytoplasme. Dans l’épithélium lingual chez la souris [5] et l’homme [
6], l’expression du gène codant pour CD36 est strictement restreinte au bourgeon du goût. Quant à la protéine CD36, nous avons récemment montré qu’elle est abondamment exprimée sur la partie apicale de certaines cellules des bourgeons du goût (TRC, taste receptor cells) bordant le pore gustatif de la papille caliciforme chez la souris [5]. Or, il s’avère que cette glycoprotéine transmembranaire est impliquée dans la perception des lipides alimentaires. En effet, l’invalidation du gène codant pour le CD36 diminue de façon drastique la préférence spontanée pour les AGLC chez la souris, sans pour autant affecter la perception du sucré ou de l’amer [5]. De plus, nous avons démontré chez la souris que, en réponse à l’interaction entre les AGLC et le CD36 au niveau des TRC, le CD36 est couplé à la phosphorylation de tyrosines kinases de la famille Src (Fyn-p59 et Yes-p62) [
7]. Nous avons constaté que les AGLC induisent également une augmentation de la concentration de Ca2+ intracellulaire ([Ca2+]i) dans les TRC [
8]. Ce phénomène est strictement dépendant de CD36 car la signalisation calcique est fortement réduite en présence d’un inhibiteur pharmacologique de la liaison des AGLC à CD36 [8]. Cette augmentation du [Ca2+]i semble résulter d’une mobilisation du calcium du réticulum endoplasmique (RE) via la production d’inositol triphosphate (IP3) et de l’ouverture des canaux SOC (store-operated calcium) [7]. Cependant, les mécanismes impliqués dans l’ouverture des canaux SOC des cellules gustatives restaient encore non définis. |
STIM1, un senseur calcique du réticulum endoplasmique STIM1 (stromal interaction molecule 1) est une protéine transmembranaire qui joue le rôle de senseur calcique au niveau des citernes du RE (→) [
14]. La libération calcique à partir du RE entraîne la perte d’ions calcium au niveau des motifs EF-hands
1 de STIM1, ce qui provoque sa translocation vers la membrane plasmique où il contrôle l’ouverture de canaux SOC [
9].
(→) Voir m/s n° 8-9, août-septembre 2011, page 737
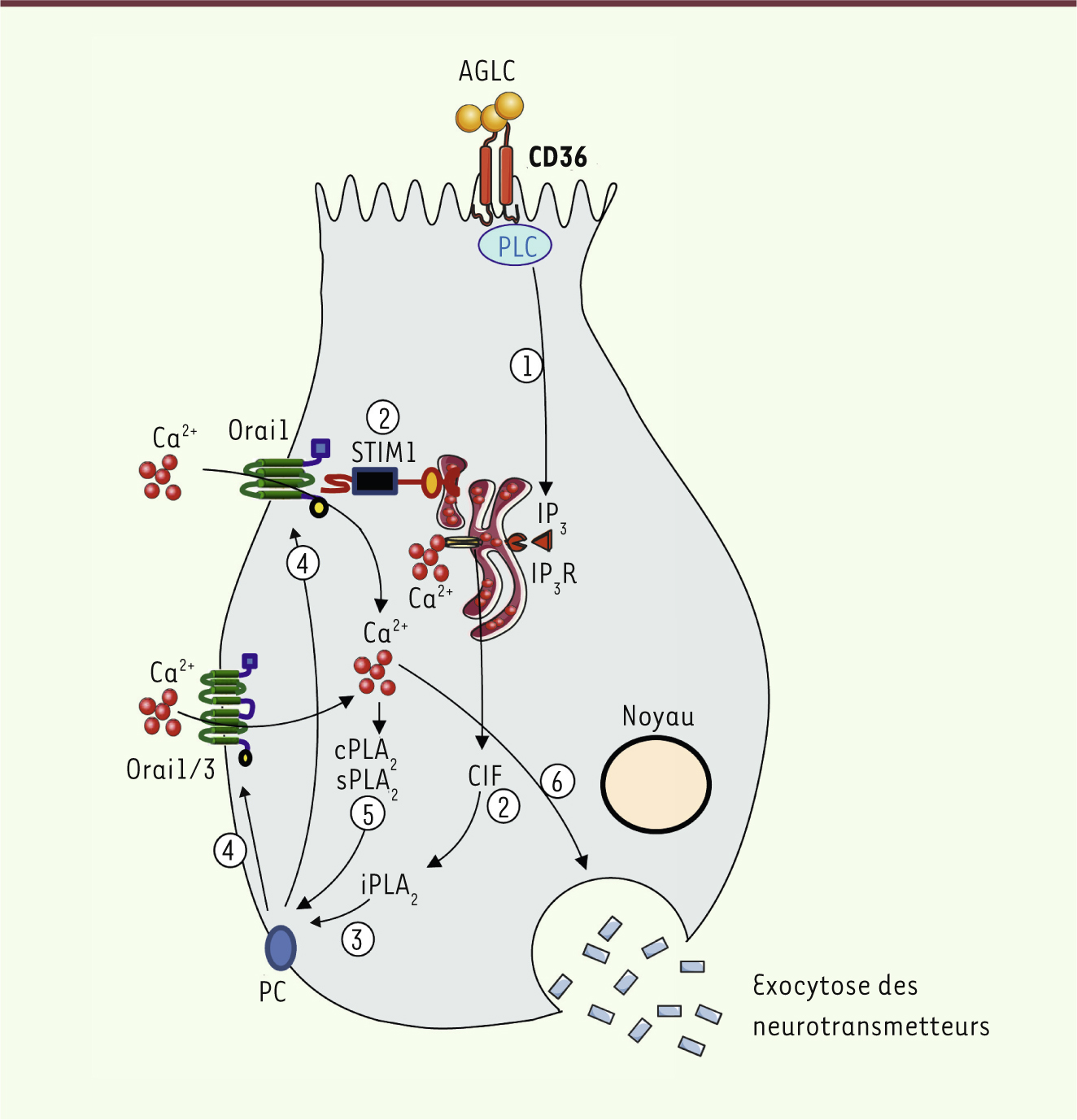
 | Figure 1.
Représentation schématique de l’implication de STIM1 dans la signalisation calcique dans les cellules linguales CD36-positives de souris. Un AGLC se fixe sur CD36 puis induit la production d’IP3
via un mécanisme dépendant de la phopholipase C (PLC) (1). L’IP3 induit la libération de calcium à partir du RE. Cette déplétion de réserve calcique induit un changement conformationnel de STIM1 permettant la libération de CIF dans le cytoplasme (2). Le CIF, à son tour, active iPLA2 qui donne naissance à la lyso-PC et l’AA (3). Le premier ouvre les canaux calciques ORAI1 et le second les ORAI1/3, permettant l’influx calcique (4). Cet influx calcique va activer cPLA2 et sPLA2 qui, en agissant sur la phosphatidylcholine (PC) puis en produisant la lyso-PC et l’AA, induisent à nouveau l’augmentation de calcium intracellulaire (5). L’élévation de Ca2+ cytoplasmique est responsable de la libération des neurotransmetteurs (6) qui transmettent le message gustatif vers les nerfs afférents. IP3R : récepteur à l’IP3. |
Si STIM1 ouvre les canaux SOC, un facteur contrôlant l’entrée sélective de Ca2+ est nécessaire pour reconstituer la réserve du RE. En 1993, l’équipe de R.Y. Tsein [
10], puis en 2008 celle de V.M. Bolotina [9], ont démontré qu’un facteur nommé CIF (calcium influx factor) était impliqué dans la détection du calcium au niveau du RE et dans la reconstitution de son stock calcique. Ainsi, STIM1 déclenche la libération du CIF à partir du RE lors de la mobilisation du calcium intracellulaire. Ce rôle physiologique de STIM1 est confirmé par l’utilisation des cellules déficientes en STIM1 [
11]. |
STIM1 orchestre les voies de signalisation en aval de CD36 dans les cellules gustatives Nous avons récemment étudié le rôle de STIM1 et du CIF dans l’ouverture des canaux calciques au niveau des papilles gustatives caliciformes chez la souris [
12]. Nous avons montré qu’un AGLC comme l’acide linoléique induit la production d’IP3, ce qui permet la mobilisation du calcium à partir du RE et donc la libération de CIF [12]. CIF induit l’activation d’une phospholipase A2 (PLA2) indépendante du calcium (iPLA2). Il est intéressant de noter que les TRC de souris expriment abondamment iPLA2 VIb, connue pour jouer un rôle clé dans la régulation de l’influx SOC dans différents types cellulaires [9, 11]. Quand la cellule n’est pas stimulée par la présence exogène d’AGLC, iPLA2 VIb est inactive car associée à la calmoduline (CaM). Nos travaux suggèrent que CIF produit en présence d’AGLC entraîne la dissociation de la CaM et de la iPLA2 VIb, ce qui l’active. Cette étape permet la libération d’acide arachidonique (AA) et de lysophosphatidylcholine (lyso-PC) à partir de phospholipides (PL) de la membrane plasmique. L’activité du CIF est sous le contrôle strict de STIM1, car CIF purifié à partir des TRC STIM1-/-
n’active pas iPLA2. Nous avons également démontré que CIF pourrait représenter un facteur universel qui permettrait l’ouverture des canaux calciques en exerçant son action sur la face interne de la membrane plasmique. Ainsi, nous avons injecté CIF, purifié à partir des TRC de souris, dans les lymphocytes T humains et, en utilisant les techniques de patch-clamp, nous avons constaté que ce facteur était capable d’induire une augmentation massive de [Ca2+]i via les canaux calciques. Le lyso-PC provoque l’ouverture des canaux calciques ORAI1 (calcium release-activated calcium channel protein 1). En effet, la réponse de lyso-PC à l’augmentation du [Ca2+]i est complètement supprimée dans des TRC des souris Orai1-/-
. En ce qui concerne l’AA, il ouvre les canaux calciques hétérodimériques ORAI1/3 dans les cellules gustatives lipidiques. En utilisant la technologie de siARN (small interfering RNA), nous avons démontré que le STIM1 agit en amont de l’ouverture des deux types de canaux calciques ORAI1 et 1/3. En effet, les ARN interférents de STIM1 abolissent l’ouverture des canaux calciques ORAI1 et ORAI1/3 dans ces cellules. Les TRC de souris expriment aussi les PLA2 dépendantes du calcium (cPLA2 et sPLA2), et principalement les sPLA2 V, sPLA2 IIa et cPLA2 Vc. L’influx calcique active ces deux familles de PLA2 dépendantes du calcium qui, à leur tour, agissent en synergie sur la phosphatidylcholine membranaire et produisent un influx calcique massif via l’AA et Lyso-PC. CIF est spécifique de iPLA2 et n’a donc aucune action sur cPLA2 et sPLA2. |
STIM1 est indispensable à la détection orosensorielle des lipides alimentaires Nous avons également montré que l’augmentation massive du [Ca2+]i, via CD36, est impliquée dans l’exocytose de la sérotonine (5-hydroxytryptamine ou 5-HT) par les TCR, ce qui permet le transfert du message lipidique au cerveau via les fibres nerveuses afférentes déclenchant ainsi un comportement stéréotypé (attraction pour les aliments gras). Il est important de noter que la signalisation calcique dépendante de STIM1 est indispensable à la perception oro-sensorielle des AGLC. En effet, l’invalidation du gène codant pour STIM1 s’accompagne d’une chute drastique de la préférence spontanée pour les lipides alimentaires chez des souris soumises à un test de double choix. Ce résultat n’est pas dû à des caractéristiques phénotypiques particulières. En effet, les souris Stim1-/-
sont globalement normales exception faite d’une splénomégalie, cette dernière étant sans influence sur la perception gustative lipidique. |
Nos résultats démontrent pour la première fois que le senseur calcique STIM1 du RE joue un rôle de chef d’orchestre dans la signalisation calcique dépendant du CD36 au niveau des cellules gustatives de souris. Une des conséquences physiologiques de cette régulation est l’impact de STIM1 dans la perception orosensorielle des lipides alimentaires. Il est possible que des mécanismes similaires soient aussi impliqués dans la perception des autres saveurs. Notre étude contribue à renforcer l’hypothèse de l’existence d’une sixième modalité gustative dédiée à la détection des lipides alimentaires chez la souris. Des études récentes ont démontré qu’un polymorphisme du gène codant pour CD36, aboutissant à une baisse de l’expression de celui-ci, est responsable d’une augmentation du seuil de détection oral des lipides alimentaires chez l’homme [
13]. Ce résultat inédit souligne l’importance du CD36 lingual dans la détection des lipides chez le mammifère. Une meilleure compréhension des mécanismes moléculaires à l’origine de cette régulation pourrait, à terme, déboucher sur de nouvelles stratégies nutritionnelles et/ou pharmacologiques visant à limiter la consommation des aliments riches en graisses et contribuant ainsi à la lutte contre l’obésité. À l’avenir, il serait possible de synthétiser des molécules dites faux lipides qui vont déclencher la même sensation que des lipides alimentaires, mais qui n’auront pas d’apports énergétiques. Ces agents pourront êtres utilisés dans le traitement de l’obésité et des pathologies liées à ce fléau mondial. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les travaux des auteurs sont financés par le Ministère de l’enseignement supérieur et de la recherche, la région Bourgogne (N.A. Khan), le contrat Agence nationale pour la recherche (ANR-07-PNRA-015), le Centre national interprofessionnel de l’économie laitière (CNIEL) et le Human FATaste program (P. Besnard).
|
Footnotes |
1.
World health organization . Obesity: preventing and managing the global epidemic. Report of a WHO consultation . World Health Organ Tech Rep Ser.
2000; ; 894 : :1.–253. 2.
Xiao
J
,
Yang
W.
Weight loss is still an essential intervention in obesity, its complications: a review . J Obes.
2012; ; 2012 : :369097.. 3.
Bray
GA
,
Paeratakul
S
,
Popkin
BM.
Dietary fat and obesity: a review of animal, clinical and epidemiological studies . Physiol Behav.
2004; ; 83 : :549.–555. 4.
Mattes
RD.
Is there a fatty acid taste?
Annu Rev Nutr.
2009; ; 29 : :305.–327. 5.
Laugerette
F
,
Passilly-Degrace
P
,
Patris
B
, et al.
CD36 involvement in orosensory detection of dietary lipids, spontaneous fat preference, and digestive secretions . J Clin Invest.
2005; ; 115 : :3177.–3184. 6.
Simons
PJ
,
Kummer
JA
,
Luiken
JJ
,
Boon
L.
Apical CD36 immunolocalization in human and taste buds from circumvallate and foliate papillae . Acta Histochem.
2010; ; 113 : :839.–843. 7.
El-Yassimi
A
,
Hichami
A
,
Besnard
P
,
Khan
NA.
Linoleic acid induces calcium signaling, Src-kinase phosphorylation and neurotransmitters release in mouse CD36-positive gustatory cells . J Biol Chem.
2008; ; 283 : :12949.–12959. 8.
Gaillard
D
,
Laugerette
F
,
Darcel
N
, et al.
The gustatory pathway is involved in CD36-mediated orosensory perception of long-chain fatty acids in the mouse . FASEB J.
2008; ; 22 : :1458.–1468. 9.
Bolotina
VM.
Orai, STIM1 and iPLA2 : a view from a different perspective . J Physiol.
2008; ; 586 : :3035.–3042. 10.
Ramdriamampita
C
,
Tsien
RY.
Emptying of intracellular Ca2+ stores releases a novel small messenger that stimulates Ca2+ influx . Nature.
1993; ; 364 : :809.–814. 11.
Csutora
P
,
Peter
K
,
Kilic
H
, et al.
Novel role for STIM1 as a trigger for calcium influx factor production . J Biol Chem.
2008; ; 283 : :14524.–14531. 12.
Dramane
G
,
Abdoul-Azize
S
,
Hichami
A
, et al.
STIM1 regulates calcium signaling in taste bud cells and preference for fat in mice . J Clin Invest.
2012; ; 122 : :2267.–2282. 13.
Pepino
MY
,
Love-Gregory
L
,
Klein
S
,
Abumrad
NA.
The fatty acid translocase gene, CD36, and lingual lipase influence oral sensitivity to fat in obese subjects . J Lipid Res.
2012; ; 53 : :561.–566. 14.
Le Deist
F
,
Capiod
T.
Immunodéficiences et pathologies associées aux mutations dans STIM/ORAI. Un complexe membranaire au cœur de la signalisation calcique . Med Sci (Paris).
2011; ; 27 : :737.–745. |