| |
| Med Sci (Paris). 2012 October; 28(10): 813–816. Published online 2012 October 12. doi: 10.1051/medsci/20122810005.Les tumeurs gliales diffuses de l’adulte Hétérogénéité génétique et implications thérapeutiques Maïté Verreault,1,2,3* Jean-Yves Delattre,1,2,3,4 and Ahmed Idbaih1,2,3,4 1Université Pierre et Marie Curie Paris-6, Centre de Recherche de l’Institut du cerveau et de la moelle épinière (CRICM), UMRS 975, 47-83, boulevard de l’Hôpital, 75013Paris, France 2Inserm U975, 47-83, boulevard de l’Hôpital, 75013Paris, France 3CNRS, UMR 7225, 47, boulevard de l’Hôpital, 75013Paris, France 4AP-HP, Groupe hospitalier Pitié-Salpêtrière, Service de neurologie Mazarin, 47-83, boulevard de l’Hôpital, 75013Paris, France MeSH keywords: Adulte, Âge de début, Tumeurs du cerveau, épidémiologie, génétique, anatomopathologie, thérapie, Hétérogénéité génétique, Gliome, Humains, Modèles biologiques, Invasion tumorale |
Les gliomes ou tumeurs gliales sont la forme la plus fréquente de tumeur cérébrale primitive (c’est-à-dire non métastatique) chez l’adulte. Aux États-Unis et en Europe, l’incidence de ce type de cancer est de l’ordre de 2,5 nouveaux cas pour 100 000 personnes par année [
1]. Certaines prédispositions génétiques héréditaires aux gliomes ont été identifiées. Néanmoins, la majorité des gliomes (> 90 %) apparaissent de manière sporadique, en dehors de ces contextes génétiques, suggérant une combinaison de facteurs de risque intrinsèques (prédisposition ou susceptibilité génétique) et extrinsèques (facteurs environnementaux) dans le développement de ces tumeurs. Au cours des dernières décennies, la recherche a permis des avancées majeures dans la connaissance de la biologie des gliomes, laissant présager le développement de nouveaux outils diagnostiques et de nouveaux traitements plus efficaces et moins toxiques pour les patients. Parallèlement, ces découvertes ont également révélé la complexité et l’hétérogénéité des tumeurs gliales sur le plan moléculaire et cellulaire. |
Classification des tumeurs gliales diffuses et hétérogénéité intertumorale La classification de l’Organisation mondiale de la santé (OMS) distingue sept principaux types de tumeurs gliales diffuses en fonction du type de cellules tumorales et du grade de malignité. Trois types de gliomes sont individualisés en fonction des similitudes morphologiques entre les cellules gliales normales et les cellules gliales tumorales : (1) les astrocytomes, (2) les oligodendrogliomes et (3) les oligoastrocytomes (ou gliomes mixtes). Dans les gliomes diffus, l’OMS distingue trois grades de malignité : (1) le grade II (gliomes diffus de bas grade), (2) le grade III (gliomes anaplasiques) et (3) le grade IV (glioblastomes) (Tableau I). Le grade de malignité est déterminé par le degré de différenciation de la tumeur et sa cellularité, ainsi que la présence d’atypies cytonucléaires, d’activité mitotique, de prolifération microvasculaire et de nécrose.
Tableau I.
| Phénotype |
Grade |
Sous-types de gliomes diffus |
Biomarqueurs pronostiques et/ou prédictifs favorables |
| Astrocytome |
II |
Astrocytome de bas grade |
IDH1/IDH2 muté |
|
|
|
Promoteur de MGMT méthylé |
|
III |
Astrocytome anaplasique |
|
|
IV |
Glioblastome |
Primaire : |
|
|
|
Promoteur de MGMT méthylé |
|
|
|
Secondaire : |
|
|
|
IDH1/IDH2 muté |
|
|
|
Promoteur de MGMT méthylé |
| Oligodendrogliome |
II |
Oligodendrogliome de bas grade |
IDH1/IDH2 muté
|
|
|
|
1p/19q codélété |
|
III |
Oligodendrogliome anaplasique |
Promoteur de MGMT méthylé |
| Oligoastrocytome |
II |
Oligoastrocytome de bas grade |
IDH1/IDH2 muté |
|
|
|
1p/19q codélété
|
|
III |
Oligoastrocytome anaplasique |
Promoteur de MGMT méthylé |
Les sept grands sous-types de gliomes diffus et classification histomoléculaire associée à ces sous-types. Les informations présentées sont extraites de [
14–
18]. |
Bien que constituant l’étalon or pour le diagnostic des tumeurs gliales, la classification de l’OMS est basée sur des critères subjectifs et peu reproductibles dans certains sous-types tumoraux [
2]. Elle demeure également imparfaite pour prédire le pronostic et la réponse individuelle aux traitements. En effet, au sein d’un même sous-type histologique, les tumeurs ont des évolutions très différentes. D’importants efforts de recherche ont donc été menés au cours des dernières années afin d’identifier des biomarqueurs moléculaires (anomalie génétique, anomalie de l’ARN et/ou anomalie protéique) informatifs au niveau diagnostique, pronostique, prédictif ou de susceptibilité/prédisposition permettant d’identifier des sous-groupes histomoléculaires plus homogènes. La classification histomoléculaire des tumeurs (Tableau I) s’est avérée une approche intéressante pour affiner le diagnostic, et pour prédire le pronostic et la réponse aux traitements antitumoraux en cancérologie générale et en neuro-oncologie. La codélétion des bras chromosomiques 1p et 19q est présente dans la majorité des oligodendrogliomes et associée à un meilleur pronostic et à une meilleure réponse à la chimiothérapie cytotoxique [
3]. En effet, des données récentes indiquent que les tumeurs oligodendrogliales anaplasiques présentant la codélétion 1p/19q bénéficient clairement d’une chimiothérapie par PCV (combinaison de procarbazine, vincristine et CCNU), néoadjuvante ou adjuvante à la radiothérapie encéphalique. En revanche, ce bénéfice n’est pas démontré dans les tumeurs morphologiquement identiques ne présentant pas la codélétion 1p/19q [
4]. De même, les mutations des gènes IDH1 ou IDH2 induisant entre autres la production de l’oncométabolite 2-hydroxyglutarate [
5], ou la méthylation du promoteur du gène MGMT empêchant l’expression de l’enzyme de réparation de l’ADN MGMT [
6,
7], sont prédictifs d’une survie plus longue et/ou d’une meilleure réponse à la chimiothérapie alkylante comme le témozolomide dans différents sous-types de gliomes. En raison de son utilité, la classification histomoléculaire des gliomes est appelée à se développer de plus en plus. |
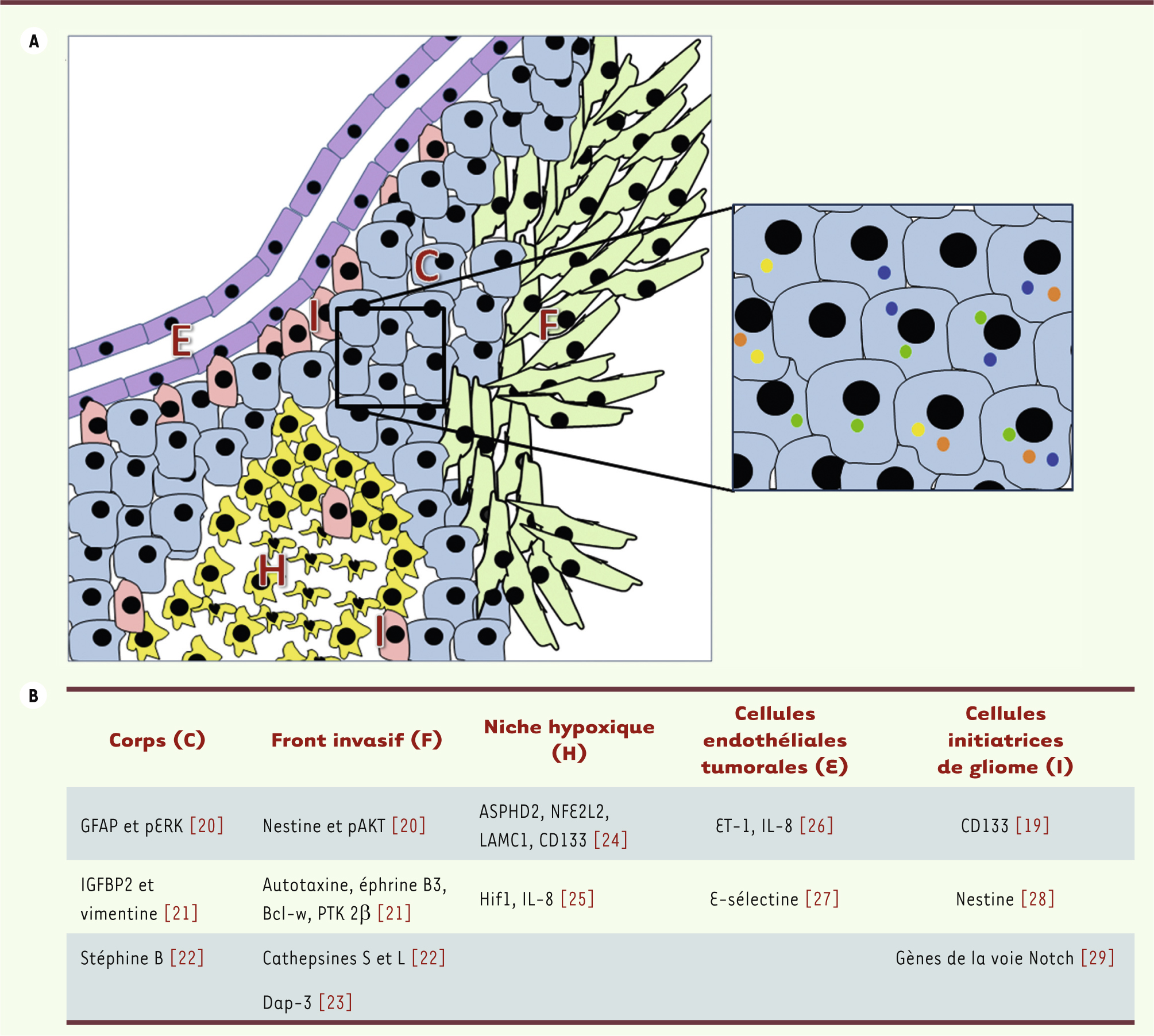
Hétérogénéité intratumorale En plus de l’hétérogénéité intertumorale, les gliomes présentent également une hétérogénéité intratumorale qui a suscité beaucoup de travaux de recherche ces dernières années. En effet, au sein d’une même tumeur gliale, il existe plusieurs populations ou sous-clones de cellules tumorales aux caractéristiques cellulaires et moléculaires hétérogènes. Cette hétérogénéité moléculaire et cellulaire permettrait à la tumeur de se développer dans différents environnements ou dans un environnement dynamique (face à l’hypoxie, au stress métabolique, à la chimiothérapie, à la radiothérapie ou à une thérapie ciblée contre un gène). Plusieurs populations cellulaires distinctes coexistent selon la région de la tumeur : le corps proliférant, le front invasif, la niche hypoxique, les cellules initiatrices de gliomes (CIG) ou la population de cellules endothéliales formant la microvasculature tumorale (Figure 1A). À cette hétérogénéité cellulaire s’ajoute une hétérogénéité moléculaire au sein d’une même région tumorale, entre différentes cellules voisines. Ainsi, l’amplification de multiples oncogènes (EGFR, MET ou PDGFRα [voir Glossaire]) a été observée simultanément et de façon mutuellement exclusive dans des cellules gliomateuses voisines [
8] (Figure 1A). La méthylation du promoteur de MGMT est également variable d’une cellule tumorale à l’autre [
9]. Ces observations suggèrent des mécanismes moléculaires et cellulaires d’initiation et de progression tumorales complexes, ainsi qu’une coopération des différents sous-clones tumoraux entre eux et avec leur environnement afin de pérenniser la tumeur [
10].
 | Figure 1.
L’hétérogénéité des tumeurs gliales. A. Dans cet exemple, un glioblastome est représenté avec le corps de la tumeur (C), le front invasif (F), une niche hypoxique (H), les cellules endothéliales (E) formant la microvasculature tumorale, ainsi que des cellules initiatrices de gliomes (I) se trouvant typiquement dans les niches périvasculaires ou hypoxiques. Les sous-populations tumorales présentent un aspect morphologique différent. Encadré. À l’intérieur même d’une sous-population tumorale, les cellules présentent de façon hétérogène des altérations moléculaires, telles que l’amplification de l’EGFR (points oranges), de la MET (points jaunes), du PDGFRα (points verts) ou la méthylation du promoteur de MGMT (points bleus). B. Les différentes sous-populations tumorales expriment des gènes différents en faveur d’un comportement biologique différent [
19–
29] (voir Glossaire pour définition des abréviations). |
|
Implications de l’hétérogénéité des tumeurs gliales Implications cliniques de l’hétérogénéité intertumorale au sein d’un sous-groupe histologique Le diagnostic clinique, radiologique et histologique des tumeurs gliales est insuffisant pour une prise en charge optimale des patients, notamment pour prédire le pronostic et guider les traitements. Les données histomoléculaires permettant d’identifier des sous-groupes tumoraux plus homogènes deviennent de plus en plus cruciales pour compléter le diagnostic clinico-radio-histologique. Ainsi, les patients présentant une tumeur oligodendrogliale anaplasique avec la codélétion 1p/19q sont dorénavant traités par une chirurgie, une radiothérapie encéphalique et une chimiothérapie dont le bénéfice dans ce sous-groupe histomoléculaire a récemment été démontré de manière formelle. Cependant, certains biomarqueurs prédictifs ne permettent pas encore de moduler le traitement. Ainsi, en l’absence d’alternative thérapeutique, les patients atteints de gliomes présentant un promoteur non méthylé du gène MGMT sont actuellement pris en charge de la même façon que ceux atteints d’une tumeur présentant un promoteur méthylé, ceci à l’exception des patients inclus dans des essais cliniques. En théorie, les thérapies moléculaires ciblées apparaissent extrêmement prometteuses si elles sont délivrées aux tumeurs candidates porteuses de l’altération moléculaire cible. Pourtant, les thérapies moléculaires ciblées telles que l’erlotinib (Tarceva®, Roche) dirigé contre l’EGFR et l’imatinib mesylate (Gleevec®, Novartis) dirigé contre le PDGFRα et c-Kit, des protéines fréquemment activées dans les glioblastomes, ont démontré une efficacité thérapeutique modeste chez un nombre limité de patients présentant un gliome. De plus, les facteurs moléculaires prédictifs d’une réponse à ces thérapies innovantes n’ont pas pu être identifiés de manière solide, et ne semblaient pas seulement être associés à la présence de l’altération cible théorique [
11,
12]. L’absence d’effet thérapeutique clair dans ces études pourrait donc s’expliquer en partie par l’hétérogénéité moléculaire des tumeurs incluses dans les essais cliniques. Ces exemples démontrent l’importance de l’identification de facteurs moléculaires prédictifs afin de mieux définir les patients susceptibles de bénéficier de ces traitements. Implications cliniques de l’hétérogénéité intratumorale des tumeurs gliales L’analyse histomoléculaire d’une tumeur basée sur une biopsie provenant d’une seule région tumorale comporte nécessairement un biais spatial et ne reflète que partiellement la tumeur. Cette considération est d’autant plus importante à prendre en compte que le choix du traitement est basé sur cette analyse anatomopathologique. Bien que difficiles à réaliser en pratique, de multiples biopsies pourraient être nécessaires pour avoir un portrait représentatif de la tumeur dans sa complexité. L’étude des biomarqueurs dans des cellules individuelles par des techniques comme le FISH ( fluorescent in situ hybridization) ou l’immunohistochimie pourraient apporter des informations plus précises sur les différentes composantes cellulaires de la tumeur. Enfin, l’imagerie moléculaire permettrait également la détection de manière non invasive des différentes altérations moléculaires au sein d’une tumeur gliale. Cette hétérogénéité tumorale constitue un défi thérapeutique. En effet, un important effort de recherche est réalisé pour identifier les cibles thérapeutiques moléculaires et cellulaires clés dans la masse tumorale hétérogène (Figure 1B), c’est-à-dire les anomalies dites pilotes (driver) en opposition à celles dites annexes (passenger). Ces anomalies moléculaires pilotes seraient à viser en priorité. Une combinaison de plusieurs agents thérapeutiques, des agents multicibles, et/ou des agents inhibant des acteurs très distaux des cascades de signalisation intracellulaires (mTOR, NFκB) pourraient également s’avérer plus efficace que l’utilisation d’un seul agent. En effet, ces approches semblent être une piste intéressante pour répondre à et anticiper les multiples stratégies de résistance aux traitements qui seront développées par la tumeur. Plusieurs auteurs ont suggéré qu’une thérapie ciblant les cellules initiatrices de gliomes (CIG) pourrait être plus efficace qu’une thérapie affectant le corps de la tumeur qui comporte des cellules tumorales plus différenciées. En effet, les CIG seraient responsables de l’initiation tumorale, de la résistance aux traitements et de la récidive tumorale, quoique cette idée soit encore discutée [
13]. Bien que ces cellules soient bien définies sur le plan fonctionnel (capacité d’autorenouvellement, de différenciation et de tumorigénicité), la question des marqueurs spécifiques permettant de les identifier reste débattue et de nombreuses équipes de recherche dans le monde travaillent à mieux caractériser cette sous-population. Finalement, les interactions entre les différentes sous-populations de cellules formant les gliomes ne sont pas complètement élucidées et demeurent un sujet de recherche prioritaire. En conclusion, les tumeurs gliales présentent une hétérogénéité intertumorale au sein d’un même sous-groupe histologique, et intratumorale au sein d’une même tumeur gliale. Les données biologiques permettent de disséquer cette hétérogénéité intertumorale afin d’établir des groupes de tumeurs homogènes sur le plan clinique, radiologique, histologique, cellulaire et moléculaire pour une meilleure prise en charge diagnostique et thérapeutique des patients souffrant de gliome. L’hétérogénéité intratumorale, laquelle commence tout juste à être explorée en profondeur, soulève de nouvelles et de nombreuses problématiques cliniques et ajoute un degré de complexité supplémentaire qu’il va falloir élucider pour optimiser la prise en charge médicale des patients. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
|
1p/19q
|
codélétion des bras chromosomiques 1p et 19q |
|
ASPHD2
|
aspartate beta-hydroxylase domain containing 2 |
|
Bcl-w
|
B cell lymphoma w
|
|
CIG
|
cellules initiatrices de gliomes |
|
Dap-3
|
death-associated protein 3
|
|
EGFR
|
epidermal growth factor receptor
|
|
ET-1
|
endothelin 1
|
|
GFAP
|
glial fibrillary acidic protein
|
|
HIF1
|
hypoxia-inducible factor 1
|
|
IDH1/2
|
isocitrate dehydrogenase 1/2
|
|
IGFBP2
|
insulin-like growth factor binding protein 2
|
|
IL-8
|
interleukin 8
|
|
LAMC1
|
laminin gamma 1
|
|
MGMT
|
O(6)-methylguanine-DNA-methyltransferase
|
|
mTOR
|
mammalian target of rapamycin
|
|
NFE2L2
|
nuclear factor (erythroid-derived 2)-like 2
|
|
NFκB
|
nuclear factor κB
|
|
OMS
|
Organisation mondiale de la santé |
|
pAKT
|
forme phosphorylée de AKT |
|
pERK
|
forme phosphorylée de extracellular signal-regulated kinase
|
|
PDGFRα
|
platelet-derived growth factor receptorα
|
|
PTK2β
|
protein tyrosine kinase 2β
|
|
1.
Central brain tumor registry of the United States . www.cbtrus.org (consulté le 26 avril 2012). 2.
Van den Bent
MJ.
Interobserver variation of the histopathological diagnosis in clinical trials on glioma : a clinician’s perspective . Acta Neuropathol.
2010; ; 120 : :297.–304. 3.
Smith
JS
,
Perry
A
,
Borell
TJ
, et al.
Alterations of chromosome arms 1p and 19q as predictors of survival in oligodendrogliomas, astrocytomas, and mixed oligoastrocytomas . J Clin Oncol.
2000; ; 18 : :636.–645. 4.
Quon
H
,
Abdulkarim
B.
Adjuvant treatment of anaplastic oligodendrogliomas and oligoastrocytomas . Cochrane Database Syst Rev.
2008 : :CD007104.. 5.
Houillier
C
,
Wang
X
,
Kaloshi
G
, et al.
IDH1 or IDH2 mutations predict longer survival and response to temozolomide in low-grade gliomas . Neurology.
2010; ; 75 : :1560.–1566. 6.
Hegi
ME
,
Diserens
AC
,
Godard
S
, et al.
Clinical trial substantiates the predictive value of 0-6-methylguanine-DNA methyltransferase promoter methylation in glioblastoma patients treated with temozolomide . Clin Cancer Res.
2004; ; 10 : :1871.–1874. 7.
Everhard
S
,
Kaloshi
G
,
Criniere
E
, et al.
MGMT methylation : a marker of response to temozolomide in low-grade gliomas . Ann Neurol.
2006; ; 60 : :740.–743. 8.
Snuderl
M
,
Fazlollahi
L
,
Le
LP
, et al.
Mosaic amplification of multiple receptor tyrosine kinase genes in glioblastoma . Cancer Cell.
2011; ; 20 : :810.–817. 9.
Juillerat-Jeanneret
L
,
Bernasconi
CC
,
Bricod
C
, et al.
Heterogeneity of human glioblastoma : glutathione-S-transferase and methylguanine-methyltransferase . Cancer Invest.
2008; ; 26 : :597.–609. 10.
Bonavia
R
,
Inda
MM
,
Cavenee
WK
, et al.
Heterogeneity maintenance in glioblastoma: a social network . Cancer Res.
2011; ; 71 : :4055.–4060. 11.
Yung
WK
,
Vredenburgh
JJ
,
Cloughesy
TF
, et al.
Safety and efficacy of erlotinib in first-relapse glioblastoma: a phase II open-label study . Neuro Oncol.
2010; ; 12 : :1061.–1070. 12.
Paulsson
J
,
Lindh
MB
,
Jarvius
M
, et al.
Prognostic but not predictive role of platelet-derived growth factor receptors in patients with recurrent glioblastoma . Int J Cancer.
2010; ; 128 : :1981.–1988. 13.
Natsume
A
,
Kinjo
S
,
Yuki
K
, et al.
Glioma-initiating cells and molecular pathology: implications for therapy . Brain Tumor Pathol.
2011; ; 28 : :1.–12. 14.
Ducray
F
,
Mokhtari
K
,
Criniere
E
, et al.
Diagnostic and prognostic value of alpha internexin expression in a series of 409 gliomas . Eur J Cancer.
2011; ; 47 : :802.–808. 15.
SongTao
Q
,
Lei
Y
,
Si
G
, et al.
IDH mutations predict longer survival and response to temozolomide in secondary glioblastoma . Cancer Sci.
2011; ; 103 : :269.–273. 16.
Van den Bent
MJ
,
Dubbink
HJ
,
Sanson
M
, et al.
MGMT promoter methylation is prognostic but not predictive for outcome to adjuvant PCV chemotherapy in anaplastic oligodendroglial tumors: a report from EORTC Brain Tumor Group Study 26951 . J Clin Oncol.
2009; ; 27 : :5881.–5886. 17.
Jha
P
,
Suri
V
,
Jain
A
, et al.
06-methylguanine DNA methyltransferase gene promoter methylation status in gliomas and its correlation with other molecular alterations: first Indian report with review of challenges for use in customized treatment . Neurosurgery.
2010; ; 67 : :1681.–1691. 18.
Zawlik
I
,
Vaccarella
S
,
Kita
D
, et al.
Promoter methylation and polymorphisms of the MGMT gene in glioblastomas: a population-based study . Neuroepidemiology.
2009; ; 32 : :21.–29. 19.
Singh
SK
,
Clarke
ID
,
Terasaki
M
, et al.
Identification of a cancer stem cell in human brain tumors . Cancer Res.
2003; ; 63 : :5821.–5828. 20.
Molina
JR
,
Hayashi
Y
,
Stephens
C
, et al.
Invasive glioblastoma cells acquire stemness and increased Akt activation . Neoplasia.
2010; ; 12 : :453.–463. 21.
Hoelzinger
DB
,
Mariani
L
,
Weis
J
, et al.
Gene expression profile of glioblastoma multiforme invasive phenotype points to new therapeutic targets . Neoplasia.
2005; ; 7 : :7.–16. 22.
Gole
B
,
Huszthy
PC
,
Popovic
M
, et al.
The regulation of cysteine cathepsins and cystatins in human gliomas . Int J Cancer.
2012 ( online). doi : 10.1002/ijc.27453. 23.
Mariani
L
,
Beaudry
C
,
McDonough
WS
, et al.
Death-associated protein 3 (Dap-3) is overexpressed in invasive glioblastoma cells in vivo and in glioma cell lines with induced motility phenotype in vitro
. Clin Cancer Res.
2001; ; 7 : :2480.–2489. 24.
Seidel
S
,
Garvalov
BK
,
Wirta
V
, et al.
A hypoxic niche regulates glioblastoma stem cells through hypoxia inducible factor 2 alpha . Brain.
2010; ; 133 : :983.–995. 25.
Rong
Y
,
Durden
DL
,
Van Meir
EG
, et al.
Pseudopalisading necrosis in glioblastoma: a familiar morphologic feature that links vascular pathology, hypoxia, and angiogenesis . J Neuropathol Exp Neurol.
2006; ; 65 : :529.–539. 26.
Charalambous
C
,
Chen
TC
,
Hofman
FM.
Characteristicsof tumor-associated endothelial cells derived from glioblastoma multiforme . Neurosurg Focus.
2006; ; 20 : :E22.. 27.
Miebach
S
,
Grau
S
,
Hummel
V
, et al.
Isolation and culture of microvascular endothelial cells from gliomas of different WHO grades . J NeuroOncol.
2006; ; 76 : :39.–48. 28.
Dahlstrand
J
,
Collins
VP
,
Lendahl
U.
Expression of the class VI intermediate filament nestin in human central nervous system tumors . Cancer Res.
1992; ; 52 : :5334.–5341. 29.
Shih
AH
,
Holland
EC.
Notch signaling enhances nestin expression in gliomas . Neoplasia.
2006; ; 8 : :1072.–1082. |