| |
| Med Sci (Paris). 2012 August; 28(8-9): 727–739. Published online 2012 August 22. doi: 10.1051/medsci/2012288015.Infections associées aux biofilms Quelles perspectives thérapeutiques issues de la recherche fondamentale ? David Lebeaux1 and Jean-Marc Ghigo1* 1Institut Pasteur, Unité de Génétique des Biofilms, Département de Microbiologie, 25, rue du Docteur Roux, 75015Paris, France |
Le terme de biofilm a été proposé en 1978 pour désigner une communauté de microorganismes enrobés d’une matrice hydratée, riche en polymères extracellulaires, et en contact avec une surface [
1]. Il est à présent associé à de nombreuses formations microbiennes caractérisées par l’expression de propriétés biologiques originales en comparaison avec des organismes isolés en suspension [
2,
3]. À l’échelle de la planète, les biofilms jouent un rôle écologique majeur [
4]. En revanche, leur développement a de nombreux effets négatifs sur les procédures industrielles ainsi qu’en médecine humaine, la formation de biofilms bactériens et fongiques sur les prothèses et cathéters contribuant au développement des infections liées aux soins [
5,
6]. Après avoir présenté les aspects les plus originaux de la formation des biofilms bactériens (pour les biofilms fongiques, voir
Encadré 1
) (→) [
71], nous détaillerons leurs conséquences médicales et les moyens de lutte actuels avant de présenter les perspectives thérapeutiques susceptibles d’émerger des récents progrès de la recherche fondamentale dans ce domaine.
(→) Voir la Synthèse de E. Cateau et al., page 740 de ce numéro
|
Les biofilms fongiques Les espèces du genre Candida (C. albicans, C. glabrata, etc.) sont les principaux pathogènes fongiques nosocomiaux. Ces levures, bien que généralement commensales, peuvent être responsables d’infections invasives chez certains patients porteurs de matériel implanté (cathéters, sondes urinaires) et ayant reçu des antibiotiques ou présentant un état d’immunodépression [
65]. En cas de candidémie (présence de levure dans le sang), les cathéters veineux centraux constituent un facteur de risque majeur suggérant l’implication du biofilm dans cette pathologie. Candida albicans, l’espèce la plus représentée, colonise efficacement les surfaces abiotiques et forme des biofilms in vitro et in vivo qui, à l’instar des biofilms bactériens, présentent une tolérance élevée à la plupart des antifongiques (Figure 5A) [
66]. Cette tolérance est plus particulièrement la conséquence d’une diffusion réduite des antifongiques au sein de la matrice du biofilm principalement constituée de bétaglucanes solubles. Presque toutes les infections associées aux biofilms décrites dans la 3e partie peuvent impliquer Candida spp., mais les principales pathologies sont celles survenant sur le matériel implanté. Il existe par exemple une association forte entre C. parapsilosis et les candidémies liées à un cathéter. En effet, cette espèce colonise fréquemment la peau des patients et présente une haute affinité pour les matériaux synthétiques [65].
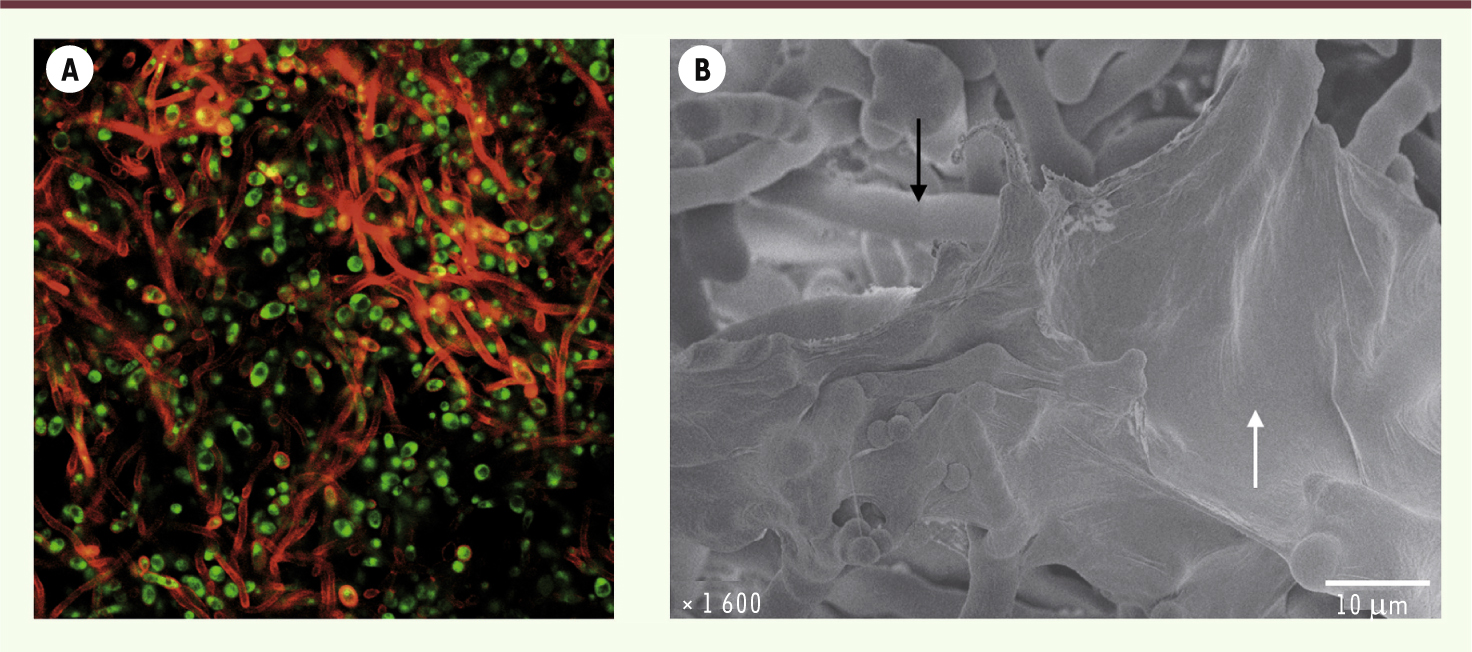
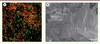 | Figure 5.
Biofilms fongiques. A. Image en microscopie confocale d’un biofilm formé par Candida albicans. Les cellules expriment une protéine fluorescente cytoplasmique (vert) et les sucres de la paroi et de la matrice ont été marqués à la concanavaline A (rouge). Image reproduite avec la permission de Julie Bonhomme et Christophe d’Enfert (unité biologie et pathogénicité fongiques, Institut Pasteur [http://www.pasteur.fr/bpf] et plate-forme de microscopie de l’université de Basse-Normandie). B. Images d’Aspergillus fumigatus cultivé en conditions statiques et d’aérobiose et observé en microscopie électronique (Cryo-SEM), mettant en évidence la matrice extracellulaire (flèche blanche) enrobant les cellules fongiques (hyphes, flèche noire) à la surface d’une colonie. Image reproduite avec la permission d’Anne Beauvais (Aspergillus Unit, http://www.pasteur.fr/recherche/unites/aspergillus/) et Stéphanie Guadagnini (Electron microscopy platform, Institut Pasteur, Paris, France). |
Aspergillus fumigatus est le principal champignon filamenteux pathogène chez l’homme. Bien que des centaines de conidies soient inhalées chaque jour, les cas de pathologies sont rares car le système immunitaire de l’hôte est capable d’éliminer le champignon. Néanmoins, en cas d’altération du système immunitaire ou d’existence de pathologie pulmonaire sous-jacente (séquelle de tuberculose par exemple), il peut être responsable de pathologies graves, certaines pouvant potentiellement être mortelles [
67]. Des données récentes montrent qu’A. fumigatus est capable de former des biofilms in vitro et confirment la plus grande tolérance du champignon aux antifongiques par rapport à sa forme planctonique. In vivo, aussi bien dans les aspergillomes (amas de champignons développés au niveau pulmonaire ou des sinus) que dans les formes invasives pulmonaires, on observe une agglutination dense de cellules fongiques (hyphes) qui sont enrobées de matrice extracellulaire essentiellement composée de polysaccharides jouant un rôle important dans la virulence de cette espèce (Figure 5B) [
68,
69].
|
|
Le biofilm : un mode de vie original En dépit de la diversité des situations écologiques, industrielles ou médicales concernées par la formation des biofilms, toutes ces entités biologiques partagent des caractéristiques communes. Un développement dynamique L’adhérence initiale d’une bactérie sur une surface est d’abord conditionnée par ses propriétés physicochimiques (hydrophobie et charge électrostatique). Elle fait ensuite intervenir des macromolécules de l’enveloppe bactérienne - souvent appelées adhésines - qui interagissent de manière spécifique ou non avec les surfaces (Figure 1) [ 3,
7]. Des polysaccharides entrant dans la composition de la matrice extracellulaire assurent également une cohésion mécanique entre les bactéries et contribuent au passage de la « vie libre » à la « vie fixée » [
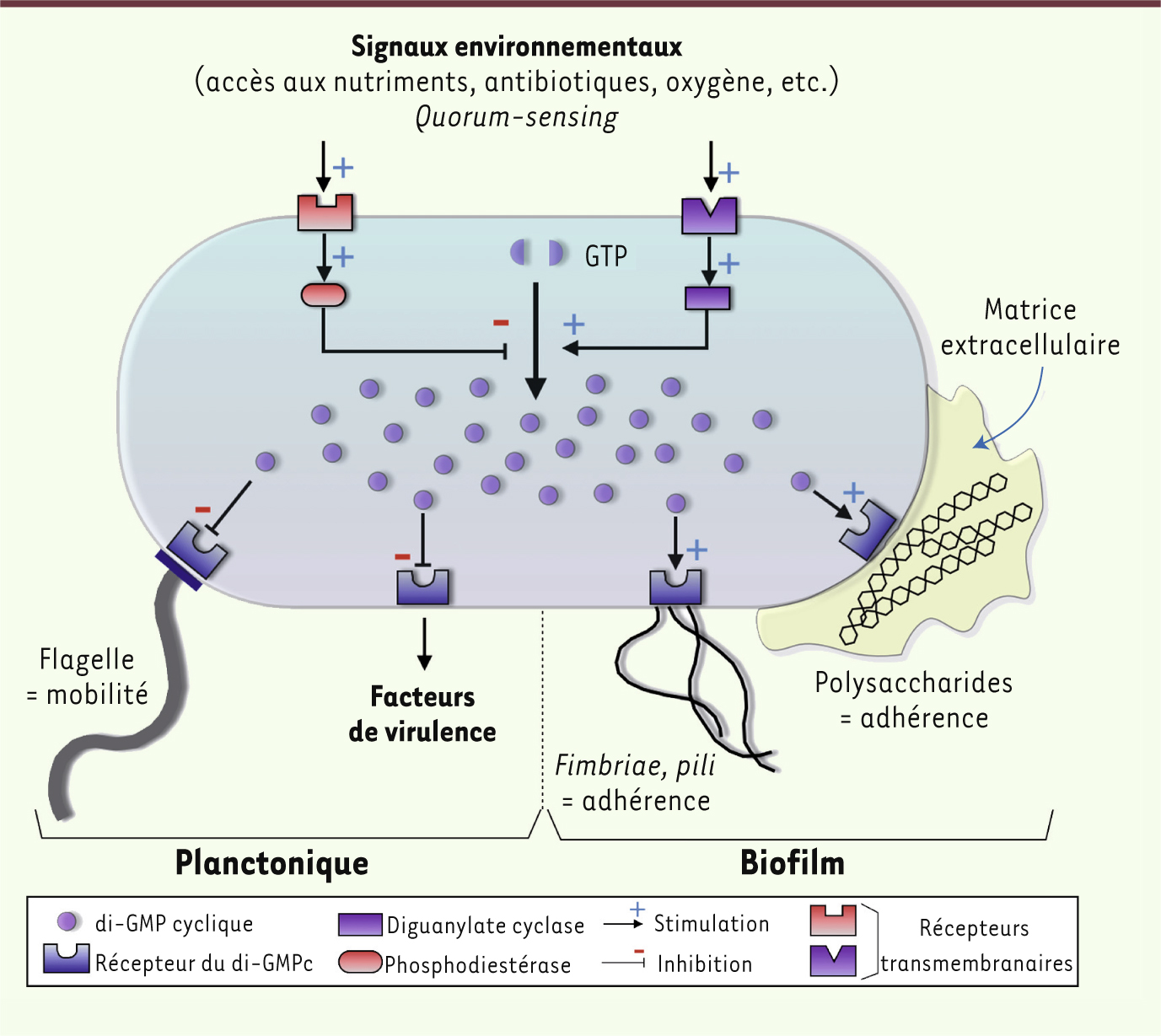
8]. Une petite molécule diffusible, le di-guanosine monophosphate cyclique (di-GMPc), constitue un second messager central régulant la transition entre la vie planctonique et l’établissement d’un biofilm (Figure 2). Sa concentration intracellulaire est influencée par de nombreux stimulus environnementaux et régule l’expression de gènes impliqués dans la formation de biofilm (production de polysaccharides de la matrice) ou bien impliqués dans le phénotype mobile (production de flagelle) [ 3].
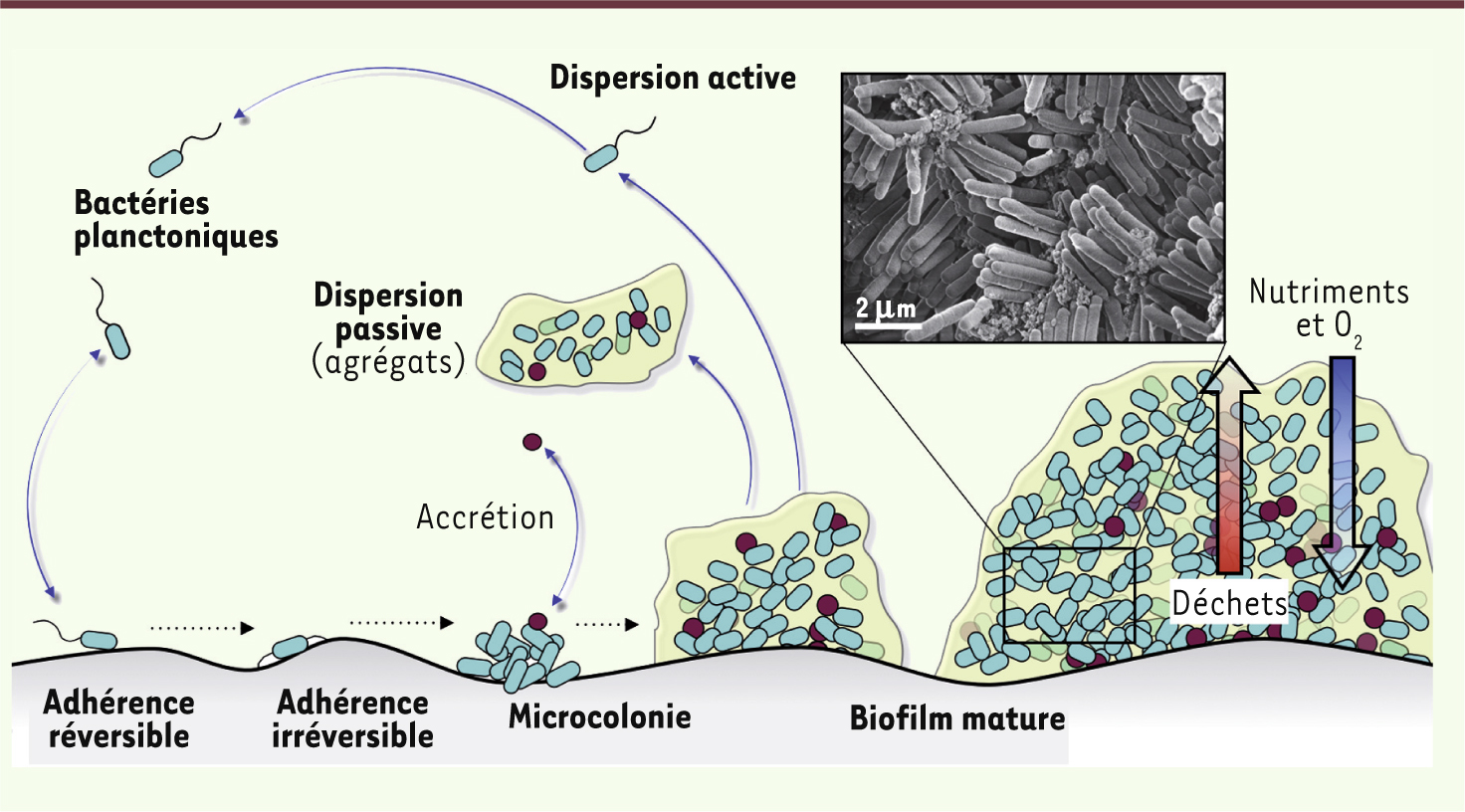
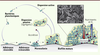 | Figure 1.
Développement et structure d’un biofilm bactérien. Après les phases d’adhérence réversible puis irréversible, la bactérie fonde une microcolonie qui produit une matrice extracellulaire (en jaune) et qui peut accueillir d’autres espèces microbiennes par accrétion. Le biofilm mature est le site de gradients inverses en nutriments (flèche bleue) et en déchets (flèche rouge) définissant des niches physiques et chimiques. Il peut se disperser et libérer des bactéries mobiles (dispersion active) ou des agrégats bactériens entourés de matrice (dispersion passive). Une photographie de microscopie électronique d’un biofilm d’E. coli développé in vivo sur cathéter est présentée en insert (© Benjamin Le Quéré, unité de génétique des biofilms, institut Pasteur et Brigitte Arbeille et Claude Lebos, LBCME, faculté de médecine de Tours). |
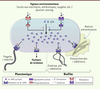 | Figure 2.
Passage entre les modes de vie planctonique et biofilm régulé par le niveau intracellulaire de di-GMP cyclique. Deux enzymes jouent un rôle clé : les diguanylate cyclases (synthèse de di-GMPc à partir de deux molécules de GTP) et les phosphodiestérases (dégradation de di-GMPc). L’augmentation de la concentration de di-GMPc mène à la formation de biofilm avec production de matrice extracellulaire (en jaune) alors que sa diminution conduit à la dispersion du biofilm. Cette dispersion s’accompagne de l’expression de facteurs de virulence dont l’expression est inhibée au sein du biofilm [
58,
64] (adapté de [ 3]). |
Après leur adhérence au substrat, qui peut survenir dans les secondes qui suivent le contact avec une surface, les bactéries s’agrègent, se multiplient et forment des microcolonies [3]. Si les conditions du milieu le permettent, le biofilm connaît une phase de maturation qui se traduit par une croissance en épaisseur. À ce stade, l’incorporation de bactéries d’espèces différentes ou d’autres microorganismes mène à la formation de biofilms polymicrobiens ou mixtes [2,
9]. Le biofilm mature peut connaître une phase de dispersion, libérant des bactéries isolées ou des fragments de biofilms qui pourront, à leur tour, enclencher la formation d’un biofilm sur une autre surface (Figure 1) [2,
10,
11]. Un environnement hétérogène La croissance tridimensionnelle du biofilm et la présence d’une matrice extracellulaire qui réduit la diffusion au sein du biofilm conduisent à l’apparition de gradients d’oxygène dont la concentration décroît depuis la surface vers la base du biofilm, où les nutriments sont plus rares et où les déchets du métabolisme bactérien s’accumulent (Figure 1) [
12]. L’hétérogénéité physicochimique du biofilm génère une hétérogénéité physiologique et la formation de microniches environnementales qui conduisent à l’émergence de sous-populations génétiquement semblables mais physiologiquement distinctes, en particulier du point de vue de leur tolérance vis-à-vis des antibiotiques (Figures 1 et 3)
[ 12,
13]. L’hétérogénéité physiologique protège le biofilm en tant que communauté, garantissant la pérennité du groupe lors de stress importants par comparaison avec des populations génétiquement ou physiologiquement homogènes [
14]. Enfin, la présence fréquente de microorganismes d’espèces différentes au sein d’un même biofilm constitue un niveau supplémentaire d’hétérogénéité biologique [ 2, 9]. Ces biofilms polymicrobiens bactériens et/ou fongiques jouent également un rôle important en médecine humaine [ 2, 9] Un haut lieu de sociomicrobiologie et d’échanges La proximité et les contacts entre bactéries du biofilm facilitent la communication et les échanges mais peuvent également conduire à des phénomènes de compétition. Les bactéries communiquent et adaptent leurs comportements en fonction de la concentration extracellulaire de petites molécules diffusibles telles que les homosérines lactones, quinolones et furanosyles chez les bactéries à Gram négatif, ou de courts peptides chez les bactéries à Gram positif [
15]. Ces molécules se fixent généralement à des récepteurs spécifiques et permettent l’activation d’un régulateur, induisant ainsi une réponse phénotypique collective lorsqu’un seuil de molécules est dépassé (perception d’un quorum ou quorum-sensing) [ 2, 15]. De nombreuses interactions ont également été décrites au cours desquelles une bactérie peut utiliser des nutriments produits par des bactéries voisines, conduisant à une complémentarité métabolique très étudiée dans le cadre des processus de bioremédiation [
16]. À l’opposé de ces phénomènes coopératifs, les bactéries composant un biofilm peuvent entrer en compétition via la production de molécules inhibant l’implantation d’un organisme exogène dans le biofilm [
17]. Enfin, la proximité physique des bactéries favorise le transfert horizontal de matériel génétique par conjugaison ou transformation permettant l’acquisition de gènes de résistance aux biocides ou d’autres caractères bénéfiques augmentant les chances de survie de la communauté [
18]. |
Le biofilm : des bactéries sous abri La tolérance du biofilm aux agressions extérieures est une de ses caractéristiques les plus remarquables [2]. Par rapport à des bactéries cultivées en milieu liquide, on observe une survie des biofilms bactériens à des doses d’antibiotiques allant jusqu’à 1000 fois la concentration minimale inhibitrice (CMI) ainsi qu’une résistance élevée aux ultraviolets, métaux lourds, acides, et aux changement d’hydratation et de salinité [12, 13,
19]. Cependant, après remise en suspension du biofilm, les bactéries isolées en milieu liquide (on parle alors de bactéries planctoniques) présentent une sensibilité in vitro normale aux antibiotiques [19,
20]. Cette caractéristique est donc réversible, phénotypique et non héritée. On parle alors de tolérance du biofilm plutôt que de résistance (sur la différence entre ces deux phénomènes, voir
Encadré 2
) [13, 19].
|
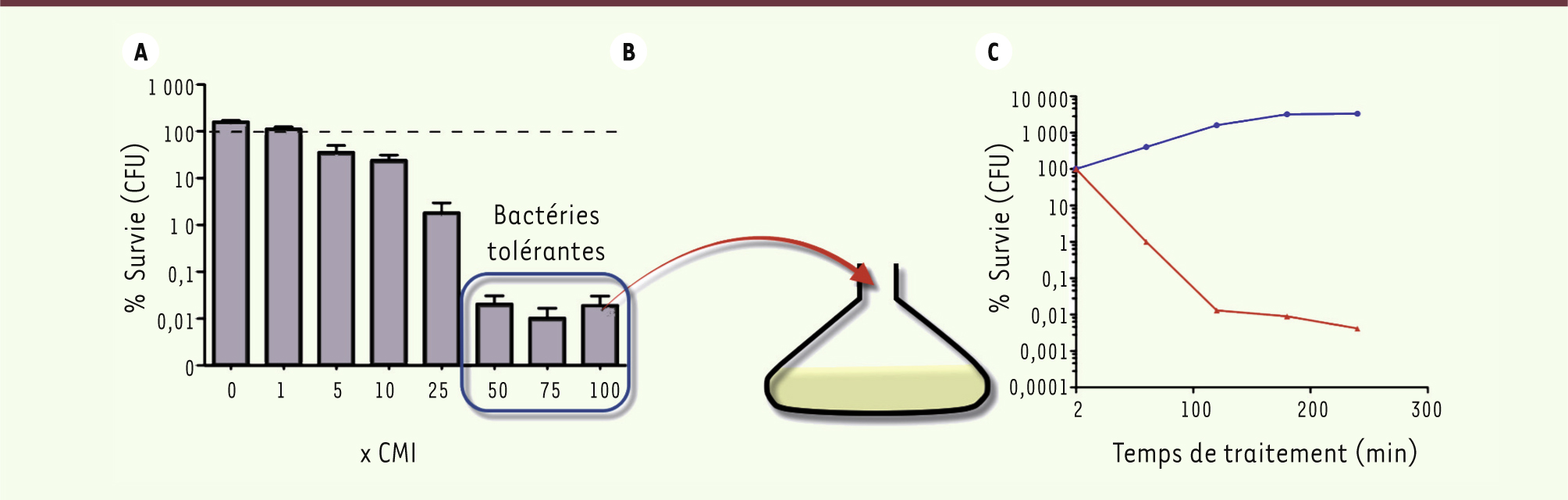
Tolérance versus résistance La résistance peut être considérée comme la capacité d’un microorganisme à se multiplier en présence d’un biocide (antibiotique ou antiseptique). De nombreux mécanismes expliquent ce phénomène et la majorité d’entre eux sont héritables, c’est-à-dire transmis de la bactérie mère aux bactéries filles. Les mécanismes les plus fréquents sont : modification de la cible des antibiotiques par mutation ou par action enzymatique, substitution de la cible via l’expression d’une cible alternative, destruction ou modification de l’antibiotique, efflux ou altération de la perméabilité de la bactérie à l’antibiotique [13]. D’une manière générale, ces mécanismes de résistance empêchent l’antibiotique d’interagir avec sa cible. La bactérie peut donc se multiplier, même en présence de l’antibiotique, comme représenté sur la courbe de survie bleue de la
Figure 6C
.
 | Figure 6.
Différences entre résistance et tolérance. A. Un biofilm in vitro formé avec une bactérie sensible est traité durant 24 h avec des concentrations croissantes d’un antibiotique bactéricide X. À partir de 50 fois la concentration minimale inhibitrice (CMI) d’antibiotique, le nombre de bactéries survivantes ne diminue pas. Il s’agit des bactéries tolérantes du biofilm. B. Ces bactéries tolérantes peuvent être extraites, remises en culture et traitées à nouveau par l’antibiotique X, en phase planctonique. C. Courbes de survie de bactéries planctoniques en présence d’un antibiotique bactéricide X. La courbe bleue correspond à une bactérie résistante à l’antibiotique : elle se multiplie en sa présence. La courbe rouge correspond aux bactéries tolérantes du biofilm remises en suspension, puis traitées par l’antibiotique X. Elles ne se multiplient pas en sa présence : il ne s’agit donc pas d’une résistance acquise mais d’une tolérance phénotypique. Données non publiées de Christophe Beloin et Steve Bernier, unité de génétique des biofilms, Institut Pasteur. |
La tolérance correspond au fait que la croissance des bactéries est inhibée mais qu’un antibiotique bactéricide est incapable de tuer ces bactéries au-delà d’un certain point [
70]. Cette situation correspond aux biofilms qui sont capables de survivre à des concentrations très élevées de biocides, mais avec une multiplication bactérienne interrompue (Figure 6A). Dans le cas de la tolérance du biofilm, cette caractéristique est phénotypique, c’est à dire qu’elle disparaît lorsque les bactéries composant le biofilm sont remises en suspension, en phase planctonique.
|
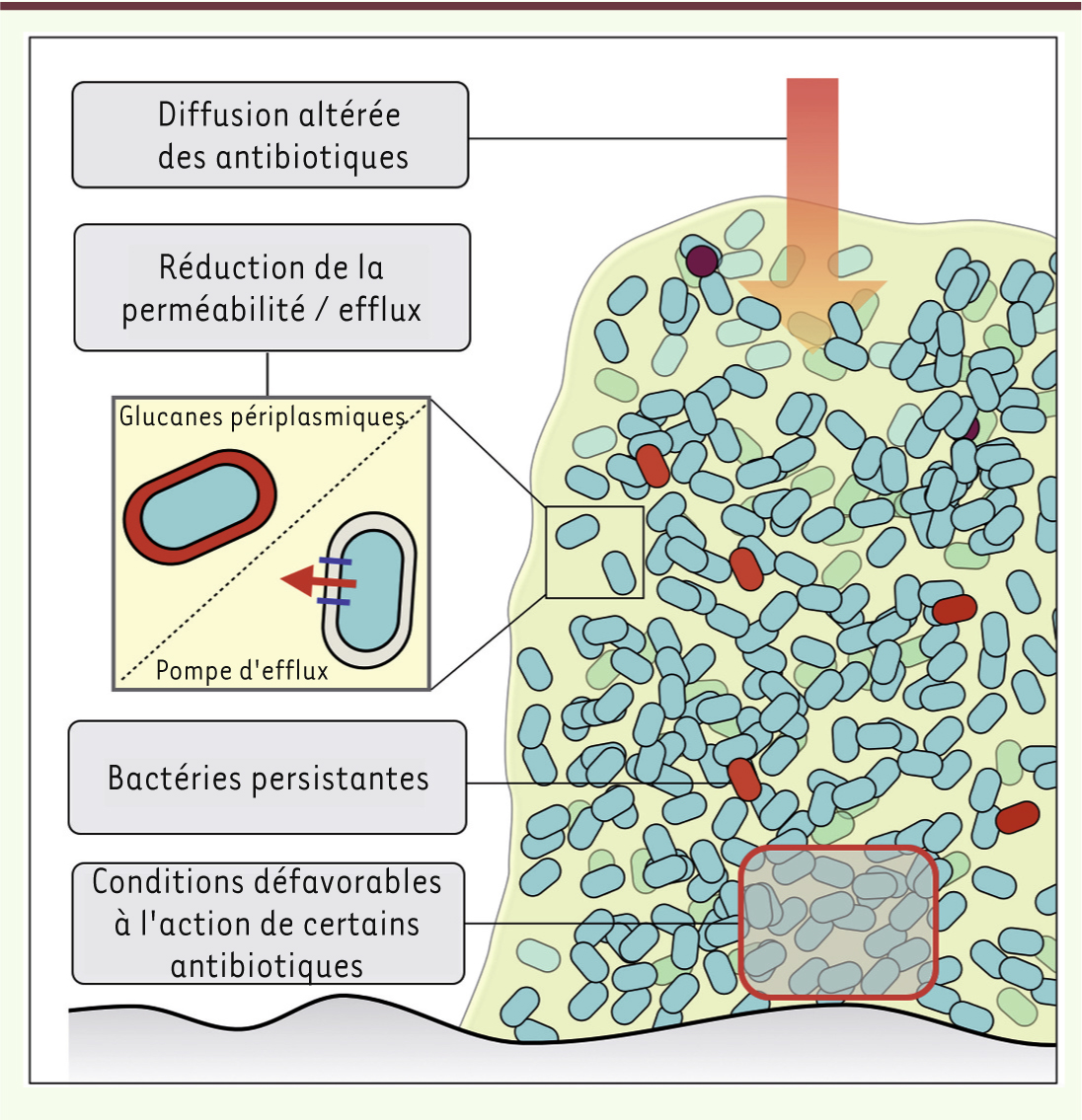
Il est désormais admis que les mécanismes qui rendent compte de la résistance transmissible aux antibiotiques tels que l’efflux, les enzymes modifiant les antibiotiques ou les modifications de la cible ne sont pas responsables de l’extrême tolérance du biofilm aux biocides [13, 19]. Plusieurs hypothèses, décrites dans la
Figure 3
, sont proposées pour rendre compte de ce phénomène [2, 13, 19].
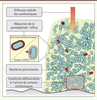 | Figure 3.
Hypothèses pour expliquer le phénomène de tolérance du biofilm vis-à-vis des biocides (antibiotiques et antiseptiques).
|
Diffusion réduite des antibiotiques La matrice extracellulaire pourrait constituer une barrière de diffusion [ 2, 3, 13, 19]. Ce phénomène permettrait une adaptation progressive de la physiologie des bactéries exposées au stress antibiotique. Cependant, cette hypothèse est contredite par la bonne pénétration de certains antibiotiques (fluoroquinolones, rifampicine, ampicilline) au sein de biofilms néanmoins tolérants à ces molécules. Conditions défavorables à l’action de certains antibiotiques De nombreux antibiotiques, comme les β-lactamines, sont plus efficaces sur les bactéries se multipliant activement. L’accès limité aux nutriments, la faible concentration en oxygène et le pH élevé des couches profondes du biofilm induisent un ralentissement de la croissance bactérienne qui pourrait diminuer l’activité des agents antibactériens [ 2, 13, 19]. Cependant, cette hypothèse explique mal la tolérance à certains antibiotiques - comme les quinolones - actifs sur des bactéries qui ne se divisent pas. Mécanismes génétiques spécifiques L’adoption du mode de vie biofilm s’accompagne de profondes modifications de l’expression des gènes qui induisent de très nombreuses modifications physiologiques [ 11]. Plusieurs mécanismes génétiques spécifiques ont été mis en évidence tels que l’accumulation de glucanes inhibant la diffusion des antibiotiques à travers le périplasme de P. aeruginosa [
21] ou l’expression de pompes d’efflux d’antibiotiques spécifiquement exprimées en biofilm chez E. coli ou P. aeruginosa [ 19]. Présence d’énigmatiques bactéries persistantes Un autre mécanisme joue un rôle majeur dans la tolérance du biofilm aux antibiotiques : la présence de bactéries en dormance appelées persistantes ( persister cells) [ 13]. L’existence de bactéries persistantes est connue depuis les années 1940 et peut être mise en évidence dans les biofilms ou dans des cultures liquides [ 13]. Ces bactéries persistantes représentent moins de 1 % de la population originale et leur génome est identique à celui des autres bactéries. Elles ne se multiplient pas, mais reprennent un mode de division normal d’une manière apparemment aléatoire et encore mal comprise [ 13]. Dans le cas d’une infection qui n’est pas liée à un biofilm, la réaction immunitaire de l’hôte induite par les bactéries planctoniques permet d’éradiquer cette population minoritaire persistante grâce à la réponse humorale et cellulaire. En revanche, dans le biofilm, les bactéries persistantes sont protégées du système immunitaire (leucocytes et anticorps) et survivent à un traitement antibiotique [ 13]. À l’arrêt du traitement, la sortie de dormance de ces bactéries persistantes conduit à la reconstitution du biofilm et à la récidive de l’infection [ 13]. L’apparition de bactéries persistantes ne dépend pas de la présence d’antibiotiques. Dans une culture en phase exponentielle dans laquelle le milieu est renouvelé en permanence, elles disparaissent totalement, suggérant l’importance de la carence nutritionnelle dans leur genèse. Par ailleurs, l’exposition aux stress, par exemple ceux qu’induisent des dommages causés à l’ADN ou l’arrêt d’activité métabolique par des toxines endogènes, peut jouer un rôle dans leur apparition [ 13]. La tolérance du biofilm aux antibiotiques constitue donc un phénomène multifactoriel et encore mal compris (Figure 3). Néanmoins, cette caractéristique joue un rôle majeur dans le défi thérapeutique que constituent les infections liées aux biofilms. |
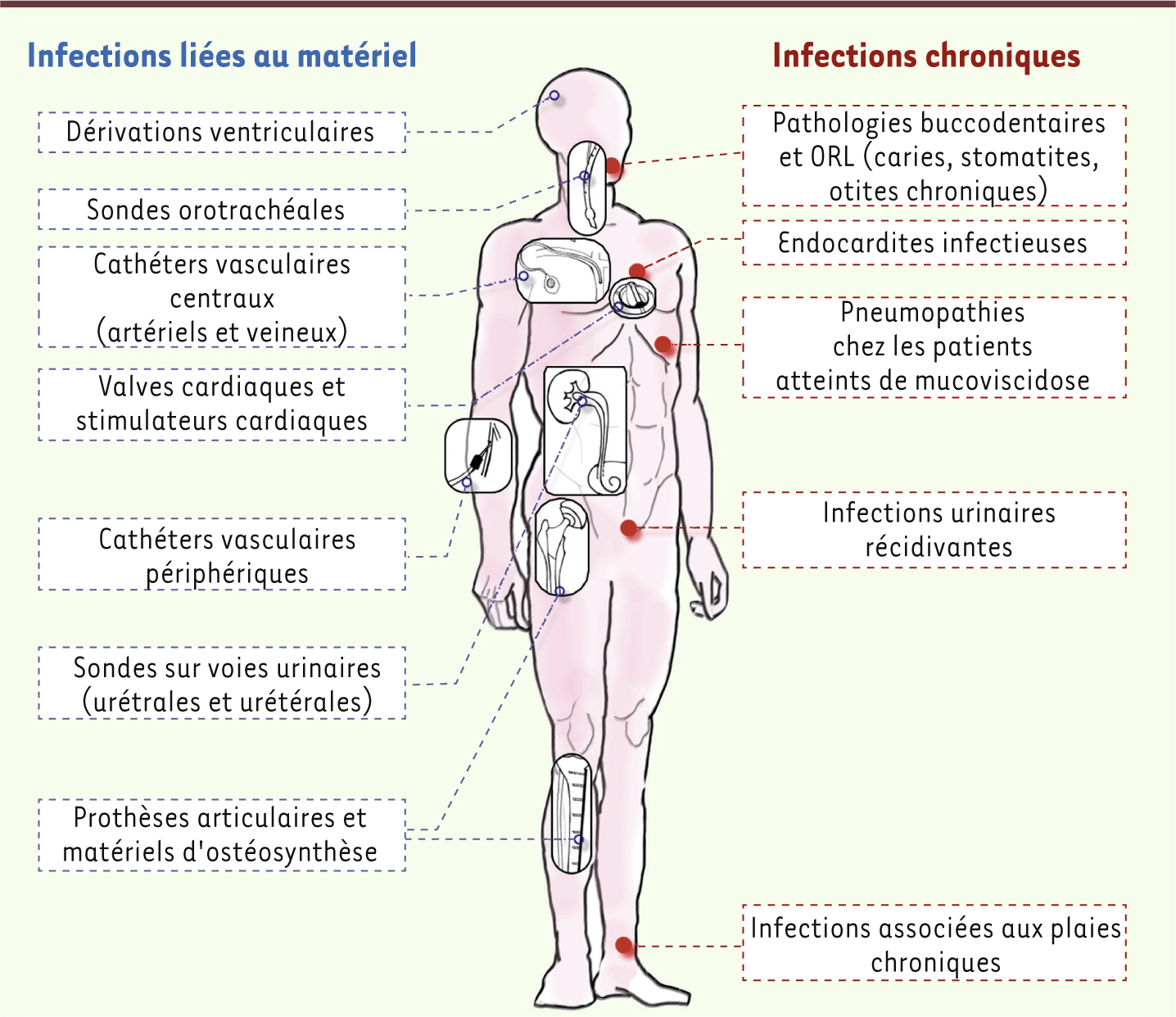
Conséquences médicales du développement des biofilms La contamination des surfaces médicales telles que les cathéters ou les prothèses articulaires aboutit à la formation de biofilms bactériens qui, outre leur tolérance aux biocides, libèrent des bactéries planctoniques à l’origine d’infections systémiques (Figure 4). Même chez un individu immunocompétent, la réaction immunitaire ne permet pas de détruire la communauté bactérienne au sein du biofilm [5, 13]. Par ailleurs, si l’administration d’antibiotiques permet la disparition transitoire des symptômes en éradiquant les bactéries planctoniques, elle n’élimine pas le biofilm, qui pourra de nouveau constituer une source d’infection. Les biofilms constituent donc des réservoirs bactériens à l’origine d’infections chroniques ou récidivantes.
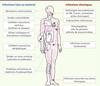 | Figure 4.
Principales infections associées aux biofilms. ORL : oto-rhino-laryngologie. |
Plusieurs critères ont été proposés afin de définir si une infection est associée, ou non, à un biofilm [
22] : – les bactéries doivent être associées à une surface ou dépendantes d’un substrat ; – les bactéries doivent être organisées en agrégats cellulaires ou communautés enchâssés dans une matrice composée d’éléments bactériens ou de l’hôte ; – l’infection initiale doit être confinée à un site de l’organisme ; – l’infection doit résister à l’antibiothérapie, bien que les bactéries testées en phase planctonique y soient sensibles Parmi les complications médicales liées aux biofilms, peuvent être distinguées les infections liées à un matériel implanté et les infections chroniques. Nous ne présenterons ici que les infections bactériennes, les infections fongiques faisant l’objet de l’
Encadré 1
. Infections liées à un matériel implanté Les premières descriptions d’infections liées aux biofilms sont associées à la contamination de matériel implanté. En 1982, un article rapportait le cas d’un patient porteur d’un stimulateur cardiaque ayant présenté trois épisodes de bactériémie à S. aureus. L’analyse en microscopie électronique du stimulateur cardiaque après son ablation a mis en évidence, pour la première fois, l’implication d’un biofilm dans la pathogénie d’une infection sur matériel [
23]. Environ cinq millions d’implants et prothèses sont utilisés tous les ans aux États-Unis et, du fait du vieillissement de la population, le nombre de patients concernés par le recours à ce type de dispositif augmente [
24,
25]. Tous les matériaux implantés sont exposés à ce risque (Figure 4). Outre le développement de biofilms sur les cathéters vasculaires et urinaires, sondes orotrachéales, stimulateurs cardiaques et valves cardiaques prothétiques, les infections liées au biofilms touchent également les implants orthopédiques (prothèses articulaires ou matériels d’ostéosynthèse) et, sur les 2,6 millions d’implants orthopédiques posés annuellement aux États-Unis, environ 112 000 (4,3 %) seront contaminés [
26–
29]. Le genre bactérien le plus représenté est celui des Staphylococcus spp. du fait de leur présence sur la peau des patients. Le développement des infections à S. epidermidis peut à ce titre être considéré comme une conséquence du progrès médical. Cette espèce bactérienne possède moins de facteurs de virulence que S. aureus, mais sa capacité à former du biofilm explique en partie son émergence comme pathogène nosocomial majeur. Lors de l’implantation d’un matériel étranger, on considère que le risque d’adhérence bactérienne lié au geste chirurgical est majeur lors des six premières heures. Il s’engage alors une course de vitesse entre la prise en charge par le système immunitaire et la colonisation de la surface de l’implant par des bactéries à la suite d’une contamination préopératoire ou postopératoire précoce [25]. Par la suite, le risque de colonisation n’est jamais nul du fait de possibles contaminations par voie hématogène ou par contact avec l’environnement extérieur pour les dispositifs à émergence cutanée (sondes urinaires ou cathéters). Ces biofilms, une fois formés, constituent des réservoirs bactériens à l’origine d’infections liées aux soins. Infections chroniques Plusieurs infections chroniques caractérisées par leur difficulté thérapeutique, l’impossibilité de stériliser certains foyers d’infection et le risque élevé de récidive sont également considérées comme des infections liées aux biofilms (Figure 4). Certains exemples illustrent ces caractéristiques. L’endocardite infectieuse Elle correspond au développement d’un biofilm localisé aux valves cardiaques [
28]. L’utilisation du modèle d’endocardite du lapin montre qu’après l’adhérence de Streptococcus sanguis sur un thrombus valvulaire, des microcolonies entourées d’une matrice composée d’éléments bactériens et de l’hôte (fibrine, plaquettes) produisent des végétations qui protègent les bactéries des leucocytes [
30]. Le traitement de cette infection nécessite une antibiothérapie prolongée et un recours fréquent à la chirurgie [ 28]. La mucoviscidose C’est une maladie génétique autosomique récessive touchant environ 35 000 enfants et jeunes adultes en Europe. La dégradation de la fonction respiratoire est liée à la production d’un mucus épais et abondant qui ralentit la clairance mucociliaire et favorise la colonisation bactérienne. La colonisation et les épisodes infectieux sont fréquemment polymicrobiens et les principales bactéries impliquées sont S. aureus et H. influenzae dans l’enfance puis, dans un second temps, P. aeruginosa [
31]. La présence d’agrégats de bactéries au sein d’une matrice extracellulaire dense, leur physiologie et les difficultés thérapeutiques rencontrées dans le traitement de ces infections indiquent la présence d’un développement bactérien de type biofilm, bien documenté dans le cas de P. aeruginosa [
32]. Infections urinaires récidivantes Classiquement attribuées à de multiples épisodes de néocolonisation depuis le tractus digestif, des travaux récents réalisés dans un modèle murin mettent en évidence que des souches d’ E. coli uropathogènes sont capables de coloniser les cellules de l’épithélium vésical et de former de larges agrégats intracellulaires entourés d’une matrice correspondant à un biofilm qui constituerait le réservoir de bactéries pathogènes entre chaque épisodes infectieux (cystites, pyélonéphrites) [
33]. Infections associées aux plaies chroniques On estime que 1 à 2 % de la population des pays développés souffrent de plaies chroniques comme les ulcères des membres inférieurs ou les complications cutanées liées au diabète. Soixante pour cent d’entre elles (contre 6 % des plaies aiguës) sont colonisées par des bactéries ou des champignons sous forme de biofilms polymicrobiens tolérants aux antibiotiques qui ralentissent ou empêchent la cicatrisation en favorisant un état d’inflammation chronique [
34,
35]. Pathologies buccodentaires et oto-rhino-laryngologie (ORL) Il a été démontré, grâce à des prélèvements cliniques et des modèles in vivo, que les bactéries responsables d’otites moyennes chroniques ( Haemophilus influenzae, Streptococcus pneumonaie, Moraxella catarrhalis) formaient des structures typiques des biofilms. Cette observation a permis de comprendre en partie les difficultés thérapeutiques rencontrées dans ces situations cliniques et la nécessité fréquente d’une prise en charge chirurgicale [
36,
37]. Les infections buccodentaires (carie ou stomatite) impliquent également le développement d’un biofilm qui est, dans ce cas, fréquemment polymicrobien. La colonisation par une première espèce permet alors le développement d’un échafaudage de macromolécules favorisant l’adhérence d’autres espèces [ 5, 9]. Ces complications concernent donc de nombreux patients dans des contextes de soins très variés. Plusieurs approches thérapeutiques sont actuellement utilisées afin de prévenir le développement des biofilms ou d’essayer de les éradiquer. |
Prévention et traitement des biofilms : les limites des approches actuelles Actuellement, les thérapeutiques anti-infectieuses (antibiotiques, vaccins) et les outils diagnostiques ont, pour l’essentiel, été développées pour leur efficacité sur des bactéries en phase planctonique. Les approches actuellement utilisées en médecine humaine pour lutter contre les biofilms peuvent se décliner en mesures préventives et curatives et s’appuient, pour la plupart, sur les antibiotiques. Les mesures préventives Hygiène L’application de mesures d’hygiène maximale en contexte opératoire n’est pas spécifiquement une mesure antibiofilm. Néanmoins, la limitation des risques de contamination du site opératoire et l’application stricte des recommandations concernant la manipulation des dispositifs limitent le risque d’adhérence bactérienne initiale. Lors de la pose de cathéters centraux, l’application de mesures d’asepsie chirurgicale ( maximum sterile barrier precautions) a montré son efficacité pour réduire le risque infectieux associé à ces dispositifs [
38]. Matériel imprégné d’antibactériens L’utilisation de matériel imprégné d’antibactériens permet de libérer localement, au niveau du site à risque de colonisation, une concentration élevée d’agents antibactériens [ 24]. Il est par exemple recommandé d’utiliser des cathéters centraux imprégnés (rifampicine/minocycline ou chlorhexidine/sulfadiazine argentique) en cas de persistance d’une incidence élevée d’infection malgré la mise en place de mesures préventives strictes [ 38]. Des implants orthopédiques imprégnés sont également en cours d’évaluation. Le défaut principal de cette approche est sa durée d’action limitée qui restreint son intérêt aux dispositifs de courte durée ou à la prévention des colonisations peropératoires ou postopératoires précoces [ 24]. Verrous d’antibiotiques ou d’éthanol préventifs Cette stratégie ( lock therapy, voir [ 71]) repose sur l’injection et le maintien, entre 12 et 24 h, d’un volume restreint d’antibiotiques très concentrés dans la lumière du cathéter. Actuellement, cette mesure est réservée aux patients porteurs d’un cathéter de longue durée ayant présenté de multiples complications infectieuses, malgré la mise en place de mesures de prévention [ 38]. Le risque de recourir à cette stratégie de manière plus large et durable est de favoriser l’émergence de résistances bactériennes à l’antibiotique choisi [
39]. Parallèlement, certaines équipes ont développé l’utilisation de verrous d’éthanol à 70 % à visée préventive avec des résultats prometteurs en nutrition parentérale pédiatrique ou en hémodialyse [
40]. Les verrous d’agents chélateurs Les cations métalliques (magnésium, calcium, fer) sont essentiels à la croissance bactérienne. Il a donc été proposé d’utiliser des verrous composés de chélateurs de ces métaux (EDTA, citrate) qui permettraient d’inhiber la croissance bactérienne, de prévenir l’adhérence initiale, voire de favoriser la destruction des biofilms [
41]. Les données in vitro sont encourageantes et les évaluations cliniques - portant principalement sur le citrate ou l’association de minocycline et d’EDTA à visée préventive - décrivent une réduction significative de l’incidence des complications infectieuses liées aux cathéters [ 41]. Les traitements curatifs L’ablation du dispositif En cas d’infection liée à un matériel implanté, l’ablation de ce dernier est souvent recommandée, car son maintien expose à un risque élevé d’échec thérapeutique [ 26,
27, 29]. Cette décision peut être problématique pour certains dispositifs (stimulateur cardiaque, prothèse orthopédique) en raison des conséquences pour le patient et des coûts associés à l’immobilisation prolongée et à la pose d’un second matériel après antibiothérapie. Optimisation de l’antibiothérapie Des études in vitro, in vivo et cliniques ont tenté d’identifier des associations d’antibiotiques plus efficaces contre les biofilms. Par exemple, lorsque Staphylococcus spp. est en cause, l’adjonction de rifampicine augmente l’éradication bactérienne et/ou le taux de succès clinique, probablement du fait de la bonne diffusion et de l’efficacité de l’antibiotique sur les bactéries en phase stationnaire [
42]. L’usage d’une bithérapie pour cibler des bactéries dans des états métaboliques différents a également été suggéré chez P. aeruginosa [
43]. Une étude in vitro met en évidence la stérilisation d’un biofilm de P. aeruginosa par l’association de ciprofloxacine (une fluoroquinolone) et de colistine grâce à leur action différentielle en fonction de l’état métabolique de différentes niches bactériennes. En plus de l’intérêt prouvé ou potentiel des multithérapies, il est souvent nécessaire de prolonger la durée d’antibiothérapie à dose élevée comme illustré dans le cas de l’endocardite infectieuse [ 28]. Enfin, certains antibiotiques semblent avoir une action prometteuse contre les biofilms, même si les preuves cliniques de cet effet sont rares (détails dans [ 37]). Verrous antibiotiques curatifs Fondé sur le même principe que celui des verrous préventifs et associé à une antibiothérapie systémique, le contact prolongé de l’antibiotique à forte concentration a pour objectif d’essayer d’éradiquer l’origine de l’infection au niveau du cathéter, ce qui éviterait de le retirer [ 29]. Actuellement, cette approche est restreinte aux cas d’infections liées à un cathéter de longue durée dues à certaines bactéries (principalement staphylocoques à coagulase négative) et en l’absence de complications. Dans ces cas, le taux global de succès avec conservation du cathéter en place est d’environ 80 % [ 29]. L’éthanol, utilisé comme verrou à visée curative, constituerait également une option dans les infections de cathéter : elle est actuellement en cours d’évaluation clinique [ 29]. Malgré leurs intérêts respectifs, toutes ces approches présentent de multiples limites, et il est probable que le développement de traitements plus efficaces et plus ciblés passera par une meilleure compréhension des mécanismes à l’origine de ces limitations. |
Nouvelles approches antibiofilms : les apports de la recherche fondamentale L’impact clinique et économique des infections liées aux biofilms a contribué au développement de très nombreuses études. Près de vingt années de recherche fondamentale sur la formation et les fonctions des biofilms bactériens ont permis de dégager plusieurs axes originaux exploitables pour le développement, à plus ou moins long terme, de moyens de lutte contre les biofilms bactériens (Tableau I). Nous avons sélectionné quelques exemples qui illustrent les intérêts et les limites de ces approches.
Tableau I.
| Mécanisme d’action |
Évaluation in vitro |
Évaluation in vivo |
Utilisation chez l’homme |
Références |
|
Inhiber l’adhérence initiale
|
| Bloqueur de la biogenèse d’adhésines |
Inhibe la biogenèse de curli et de pili et prévient la formation de biofilm |
Diminue la virulence d’une souche d’E. coli (modèle murin d’infection urinaire) |
– |
[7] |
| Inhibiteur de liaison entre l’adhésine d’E. coli et son substrat |
Efficacité correlée à la multivalence de l’inhibiteur de galabiose (substrat de l’adhésine) |
– |
– |
[7] |
| Lactoferrine |
Inhibe l’adhérence irréversible de P. aeruginosa (via chélation du fer) |
– |
– |
[
44] |
| EDTA (chélateur du magnésium, du calcium et du fer) |
Prévient la formation de biofilm et dégrade un biofilm préexistant |
Avec minocycline : effet préventif dans un modèle d’infection liée à un cathéter chez le lapin |
Avec minocycline en verrou d’antibiotique pour cathéters : réduction du nombre d’infections |
[41] |
| Biomatériaux modifiés (polymères hydrophiles, etc.) |
Réduction de l’adhérence de S. epidermidis, S. aureus ou E. coli
|
– |
– |
[
45] |
| Biosurfactants |
Réduit la formation de biofilm (E. coli, P. mirabilis, Candida spp., S. aureus) |
– |
– |
[25] |
|
|
Brouiller les communications
|
| Modulateurs des signaux de quorum-sensing
|
| Furanones |
Inhibe la formation de biofilm et l’expression de facteurs de virulence de P. aeruginosa
|
Réduction de la virulence de P. aeruginosa
|
– |
[15,
47] |
| Azithromycine |
Inhibe la formation de biofilm et l’expression de facteurs de virulence de P. aeruginosa
|
Effet bénéfique dans un modèle murin d’infection respiratoire chronique par P. aeruginosa
|
Réduit le nombre d’exacerbations et améliore la fonction respiratoire en cas de mucoviscidose |
[
48,
49] |
|
RNAII inhibiting peptide (RIP) |
Réduit l’adhérence et la virulence de S. aureus
|
S. aureus et epidermidis : réduit la colonisation de cathéters (rat) et améliore la cicatrisation de plaies chroniques (souris) |
– |
[35,
51] |
|
Inhibiteurs de la biosynthèse de di-GMPc
|
| Sulfathiazole |
Prévient la formation de biofilm (E. coli) |
– |
– |
[
52] |
| Fluorouracile |
Prévient la formation de biofilm (E. coli) |
– |
Efficace pour la prévention de la colonisation de cathéters |
[15,
53] |
|
|
Favoriser la dispersion
|
|
Enzymes
|
| DNase I |
Favorise la dispersion chez S. aureus > S. epidermidis
|
– |
– |
[8, 42] |
| Dispersine B (active contre le PNAG) |
Favorise dispersion chez S. epidermidis > S. aureus
|
Avec triclosan (antiseptique) : réduit la colonisation par S. aureus dans un modèle de cathéter de lapin |
– |
[8, 42] |
|
Modulation du quorum-sensing
|
|
Autoinducing peptide
|
Induit la dispersion d’un biofilm de S. aureus
|
– |
– |
[
56] |
| Monoxyde d’azote |
Induit la dispersion |
Modèle de silicone imprégné de NO chez des rats : réduction de la colonisation par S. aureus
|
– |
[15, 24] |
| Acide cis-2-decenoid
|
Induit la dispersion d’un biofilm de S. aureus, E. coli, C. albicans et S. pyogenes |
– |
– |
[
55] |
| D-acides aminés |
Induit la dispersion d’un biofilm de S. aureus et de P. aeruginosa
|
– |
– |
[
57] |
| Administration passive d’anticorps (contre DNABII) |
Induit la dispersion de biofilms de S. epidermidis, Streptococcus spp. et d’E. coli
|
– |
– |
[
72] |
| Utilisation de phages |
Le phage PT-6 produit une alginase favorisant la dispersion de P. aeruginosa
|
– |
– |
[
73] |
|
|
Diminuer la tolérance du biofilm
|
| Sucres (mannitol, fructose) associés aux aminosides |
Augmentent la mortalité des bactéries persistantes (S. aureus, E. coli) |
Efficace sur un modèle d’infection des voies urinaires associée à un cathéter chez la souris (E. coli) |
– |
[
60] |
| Molécule anti-persisters
|
Bactéricidie restreinte aux bactéries persistantes |
– |
– |
[
59] |
|
|
Approches vaccinales
|
| Prévenir l’adhérence initiale |
– |
Prévention de la colonisation de cathéters par S. epidermidis et S. aureus chez le rat |
En cours d’évaluation chez l’homme avant une chirurgie cardiaque[62] |
|
| Favoriser la résolution de l’infection |
– |
Modèle d’infection osseuse à S. aureus : la vaccination augmente l’efficacité de l’antibiotique |
– |
[
63] |
Liste non exhaustive des moyens de lutte spécifiquement actifs contre les biofilms.
|
Inhiber l’adhérence initiale L’objectif de cette approche est d’empêcher la formation du biofilm en inhibant l’adhérence initiale et en maintenant les bactéries dans un état isolé et sensible au système immunitaire et aux antibiotiques [ 44]. Ce blocage des étapes précoces du développement du biofilm peut s’effectuer soit en ciblant l’interaction entre les adhésines bactériennes et leur substrat, soit en bloquant la biogenèse des structures d’adhérence elle-même [ 7]. La principale limite de cette approche correspond à la multiplicité des structures impliquées dans le phénomène d’adhérence. Bien que le recours à des inhibiteurs multivalents fixés sur un échafaudage de glycopolymères ou de glyconanoparticules permette de cibler plusieurs adhésines en même temps, il est encore difficile d’envisager l’émergence d’une solution antiadhérence universelle [ 7]. Il a également été proposé de modifier la structure des biomatériaux afin d’inhiber les phénomènes d’adhérence réversible en utilisant, par exemple, des polymères hydrophiles [ 45]. Enfin, d’autres équipes ont développé des modifications de surface ayant des propriétés antibactériennes, mais non antibiotiques, permettant de tuer les bactéries déposées à leur contact [
46]. Brouiller les communications et limiter la maturation du biofilm Dans cette approche, il s’agit d’empêcher la maturation du biofilm en interférant avec les signaux de communication intra ou interbactéries. Une approche proposée pour lutter contre les biofilms formés par P. aeruginosa repose sur l’inhibition du quorum-sensing en utilisant des analogues structuraux des homosérine lactones, comme les furanones, qui réduisent le biofilm de P. aeruginosa, in vitro et in vivo [ 15, 47]. L’utilisation de l’azithromycine, qui n’a qu’une activité faible contre P. aeruginosa, altère les signaux de communication de la bactérie in vitro et in vivo et permet une amélioration de la fonction respiratoire et une réduction du nombre d’exacerbations chez les patients atteints de mucoviscidose [ 48, 49]. Néanmoins, il a été démontré que l’azithromycine pouvait avoir un effet immunologique direct chez l’homme dont les conséquences sont, pour l’instant, mal connues [
50]. Chez S. aureus et S. epidermidis, une approche similaire à été proposée avec le RNAIII inhibiting peptide (RIP). Des données in vivo dans un modèle de cathéter central chez le rat ou de plaie chronique chez la souris ont mis en évidence une réduction significative de la colonisation par ces bactéries [ 35, 51]. Une autre piste serait d’interférer avec la voie du di-GMPc qui est impliquée dans la régulation du mode de vie biofilm (Figure 2). L’inhibition de la biosynthèse de di-GMPc par le sulfathiazole ou le fluorouracile a été décrite [ 52]. Bien qu’une étude clinique ait montré que l’utilisation de cathéters imprégnés de 5-fluorouracile permettait de réduire le risque de colonisation bactérienne, la toxicité chez l’homme du sulfathiazole ou du fluorouracile reste à évaluer [ 53]. En plus de leur toxicité réelle ou potentielle, la limite de ces approches est que leur spectre d’action est étroit car elles ne ciblent qu’un nombre restreint d’espèces bactériennes. Il a également été démontré que certaines bactéries (comme P. aeruginosa) étaient capables de déjouer cette approche en sélectionnant des clones plus virulents [
54]. Disperser le biofilm De nombreux facteurs environnementaux et bactériens ont été impliqués dans la dispersion du biofilm, qui libère des bactéries à nouveau sensibles au système immunitaire et aux antibiotiques [ 13, 19]. Différentes approches ont été proposées pour disperser les biofilms infectieux comme l’utilisation d’enzymes capables de dissocier les polymères composant la matrice extracellulaire du biofilm [ 8, 42] ou l’utilisation de petites molécules comme le monoxyde d’azote (NO), l’acide cis-2-decenoid ou les acides aminés dextrogyres [ 55]. Bien que cette approche soit particulièrement adaptée aux biofilms développés en contexte industriel [ 8], elle entraîne cependant la libération d’un grand nombre de bactéries à partir du site contaminé, induisant un risque de forte réponse inflammatoire et d’infection systémique aiguë (Figure 2) [ 15, 56– 58]. Diminuer la tolérance du biofilm Outre le crible de chimiothèques menant à l’identification de composés antibiotiques spécifiquement actifs contre les cellules persistantes (dont l’efficacité reste à évaluer in vivo) [ 59], une équipe américaine vient de montrer que des sucres (mannitol, fructose) exerçaient un effet adjuvant en association à des antibiotiques. Ces sucres augmentaient l’entrée d’aminosides dans des bactéries persistantes, entraînant une plus grande mortalité bactérienne in vitro et dans un modèle in vivo d’infection liée à un biofilm d’ E. coli sur matériel implanté [ 60]. Vers un vaccin antibiofilm ? La finalité de cette vaccination est d’immuniser un individu contre certains antigènes bactériens exprimés lors de l’adhérence initiale (adhésines) ou dans le biofilm mature (polysaccharides de la matrice) afin d’empêcher le développement du biofilm [
61]. Des travaux in vitro et in vivo ont montré que cette approche réduisait le risque de colonisation et d’infection des voies urinaires en ciblant des adhésines impliquées chez des souches uropathogènes d’ E. coli, et plusieurs vaccins ciblant S. aureus ou S. epidermidis sont en cours d’évaluation [
62, 63]. Cette vaccination pourrait concerner des patients pour lesquels l’implantation d’un matériel tel que stimulateur cardiaque, valve cardiaque mécanique ou prothèse articulaire est programmée, ou encore chez les patients à risque d’infection chronique (mucoviscidose, infection urinaire). |
Les propriétés originales des biofilms bactériens, au premier rang desquelles la tolérance aux antibiotiques, jouent un rôle majeur dans le développement d’infections liées aux soins. Bien que les biofilms soient à présent pris en charge comme une physiopathologie spécifique, les recours actuels contre leur développement sont encore limités. Cependant, les données récentes de la recherche fondamentale ont mis en évidence des mécanismes ou des voies de régulation qui constituent autant d’axes thérapeutiques potentiels. Certains d’entre eux sont réalistes et à un stade avancé d’évaluation, plusieurs données in vivo concordantes permettant d’envisager une validation clinique à court ou moyen terme. Il est cependant probable que la multiplicité des processus qu’utilisent les biofilms pour établir leur tolérerance vis-à-vis des agents anti-infectieux imposera le recours à des stratégies multiples, dont le développement et la mise en œuvre efficace nécessiteront une collaboration étroite entre chercheurs et cliniciens. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
David Lebeaux a bénéficié d’une bourse doctorale de la Fondation AXA pour la recherche. Les auteurs souhaitent remercier Anne Beauvais, Christophe Beloin, Christophe d’Enfert, Jean-Paul Latgé, Sylvie Létoffé et Jean-Ralph Zahar pour leurs commentaires constructifs.
|
1.
Costerton
JW
,
Geesey
GG
,
Cheng
KJ
. How bacteria stick . Sci Am.
1978; ; 238 : :86.–95. 2.
Hall-Stoodley
L
,
Stoodley
P
. Evolving concepts in biofilm infections . Cell Microbiol.
2009; ; 11 : :1034.–1043. 3.
McDougald
D
,
Rice
SA
,
Barraud
N
, et al.
Should we stay or should we go: mechanisms and ecological consequences for biofilm dispersal . Nat Rev Microbiol.
2011; ; 10 : :39.–50. 4.
Ramey
BE
,
Koutsoudis
M
,
von Bodman
SB
,
Fuqua
C
. Biofilm formation in plant-microbe associations . Curr Opin Microbiol.
2004; ; 7 : :602.–609. 5.
Costerton
JW
,
Stewart
PS
,
Greenberg
EP
. Bacterial biofilms: a common cause of persistent infections . Science.
1999; ; 284 : :1318.–1322. 6.
Kilb
B
,
Lange
B
,
Schaule
G
, et al.
Contamination of drinking water by coliforms from biofilms grown on rubber-coated valves . Int J Hyg Environ Health.
2003; ; 206 : :563.–573. 7.
Korea
CG
,
Ghigo
JM
,
Beloin
C.
The sweet connection: solving the riddle of multiple sugar-binding fimbrial adhesins in Escherichia coli. Multiple E. coli fimbriae form a versatile arsenal of sugar-binding lectins potentially involved in surface-colonisation and tissue tropism . Bioessays.
2011; ; 33 : :300.–311. 8.
Flemming
HC
,
Wingender
J
. The biofilm matrix . Nat Rev Microbiol.
2010; ; 8 : :623.–633. 9.
Peters
BM
,
Jabra-Rizk
MA
,
O’May
GA
, et al.
Polymicrobial interactions: impact on pathogenesis and human disease . Clin Microbiol Rev.
2012; ; 25 : :193.–213. 10.
Filloux
A
,
Vallet
I
. Biofilm : mise en place et organisation d’une communauté bactérienne . Med Sci (Paris).
2003; ; 19 : :77.–83. 11.
Whiteley
M
,
Bangera
MG
,
Bumgarner
RE
, et al.
Gene expression in Pseudomonas aeruginosa biofilms . Nature.
2001; ; 413 : :860.–864. 12.
Stewart
PS
,
Franklin
MJ
. Physiological heterogeneity in biofilms . Nat Rev Microbiol.
2008; ; 6 : :199.–210. 13.
Lewis
K
. Persister cells, dormancy and infectious disease . Nat Rev Microbiol.
2007; ; 5 : :48.–56. 14.
Boles
BR
,
Thoendel
M
,
Singh
PK
. Self-generated diversity produces “insurance effects” in biofilm communities . Proc Natl Acad Sci USA.
2004; ; 101 : :16630.–16635. 15.
Landini
P
,
Antoniani
D
,
Burgess
JG
,
Nijland
R
. Molecular mechanisms of compounds affecting bacterial biofilm formation and dispersal . Appl Microbiol Biotechnol.
2010; ; 86 : :813.–823. 16.
Tribelli
PM
,
Di Martino
C
,
Lopez
NI
,
Raiger Iustman
LJ.
Biofilm lifestyle enhances diesel bioremediation and biosurfactant production in the Antarctic polyhydroxyalkanoate producer Pseudomonas extremaustralis
. Biodegradation.
2012 ( sous presse.). 17.
Rendueles
O
,
Ghigo
JM.
Multi-species biofilms: How to avoid unfriendly neighbors . FEMS Microbiol Rev.
2012 ( sous presse.). 18.
Ghigo
JM
. Natural conjugative plasmids induce bacterial biofilm development . Nature.
2001; ; 412 : :442.–445. 19.
Davies
D
. Understanding biofilm resistance to antibacterial agents . Nat Rev Drug Discov.
2003; ; 2 : :114.–122. 20.
Williams
I
,
Venables
WA
,
Lloyd
D
, et al.
The effects of adherence to silicone surfaces on antibiotic susceptibility in Staphylococcus aureus
. Microbiology.
1997; ; 143 : :2407.–2413. 21.
Mah
TF
,
Pitts
B
,
Pellock
B
, et al.
A genetic basis for Pseudomonas aeruginosa biofilm antibiotic resistance . Nature.
2003; ; 426 : :306.–310. 22.
Parsek
MR
,
Singh
PK
. Bacterial biofilms: an emerging link to disease pathogenesis . Annu Rev Microbiol.
2003; ; 57 : :677.–701. 23.
Marrie
TJ
,
Nelligan
J
,
Costerton
JW
. A scanning and transmission electron microscopic study of an infected endocardial pacemaker lead . Circulation.
1982; ; 66 : :1339.–1341. 24.
Hetrick
EM
,
Schoenfisch
MH
. Reducing implant-related infections: active release strategies . Chem Soc Rev.
2006; ; 35 : :780.–789. 25.
Rodrigues
LR
. Inhibition of bacterial adhesion on medical devices . Adv Exp Med Biol.
2011; ; 715 : :351.–367. 26.
Baddour
LM
,
Epstein
AE
,
Erickson
CC
, et al.
Update on cardiovascular implantable electronic device infections and their management: a scientific statement from the American Heart Association . Circulation.
2010; ; 121 : :458.–477. 27.
Darouiche
RO
. Treatment of infections associated with surgical implants . N Engl J Med.
2004; ; 350 : :1422.–1429. 28.
Habib
G
,
Hoen
B
,
Tornos
P
, et al.
Guidelines on the prevention, diagnosis, and treatment of infective endocarditis (new version 2009): the task force on the prevention, diagnosis, and treatment of infective endocarditis of the european society of cardiology (ESC). Endorsed by the european society of clinical microbiology and infectious diseases (ESCMID) and the international society of chemotherapy (ISC) for infection and cancer . Eur Heart J.
2009; ; 30 : :2369.–2413. 29.
Mermel
LA
,
Allon
M
,
Bouza
E
, et al.
Clinical practice guidelines for the diagnosis and management of intravascular catheter-related infection: 2009 update by the infectious diseases society of America . Clin Infect Dis.
2009; ; 49 : :1.–45. 30.
Durack
DT.
Experimental bacterial endocarditis. IV. Structure and evolution of very early lesions . J Pathol.
1975; ; 115 : :81.–89. 31.
Lyczak
JB
,
Cannon
CL
,
Pier
GB
. Lung infections associated with cystic fibrosis . Clin Microbiol Rev.
2002; ; 15 : :194.–222. 32.
Singh
PK
,
Schaefer
AL
,
Parsek
MR
, et al.
Quorum-sensing signals indicate that cystic fibrosis lungs are infected with bacterial biofilms . Nature.
2000; ; 407 : :762.–764. 33.
Justice
SS
,
Hunstad
DA
,
Seed
PC
,
Hultgren
SJ
. Filamentation by Escherichia coli subverts innate defenses during urinary tract infection . Proc Natl Acad Sci USA.
2006; ; 103 : :19884.–19889. 34.
James
GA
,
Swogger
E
,
Wolcott
R
, et al.
Biofilms in chronic wounds . Wound Repair and Regeneration.
2008; ; 16 : :37.–44. 35.
Schierle
CF
,
De la Garza
M
,
Mustoe
TA
,
Galiano
RD
. Staphylococcal biofilms impair wound healing by delaying reepithelialization in a murine cutaneous wound model . Wound Repair Regen.
2009; ; 17 : :354.–359. 36.
Hall-Stoodley
L
,
Hu
FZ
,
Gieseke
A
, et al.
Direct detection of bacterial biofilms on the middle-ear mucosa of children with chronic otitis media . JAMA.
2006; ; 296 : :202.–211. 37.
Lynch
AS
,
Robertson
GT
. Bacterial and fungal biofilm infections . Annu Rev Med.
2008; ; 59 : :415.–428. 38.
O’Grady
NP
,
Alexander
M
,
Burns
LA
, et al.
Guidelines for the prevention of intravascular catheter-related infections . Clin Infect Dis.
2011; ; 52 : :e162.–e193. 39.
Landry
DL
,
Braden
GL
,
Gobeille
SL
, et al.
Emergence of gentamicin-resistant bacteremia in hemodialysis patients receiving gentamicin lock catheter prophylaxis . Clin J Am Soc Nephrol.
2010; ; 5 : :1799.–1804. 40.
Oliveira
C
,
Nasr
A
,
Brindle
M
,
Wales
PW
. Ethanol locks to prevent catheter-related bloodstream infections in parenteral nutrition: a meta-analysis . Pediatrics.
2012; ; 129 : :318.–329. 41.
Raad
II
,
Fang
X
,
Keutgen
XM
, et al.
The role of chelators in preventing biofilm formation and catheter-related bloodstream infections . Curr Opin Infect Dis.
2008; ; 21 : :385.–392. 42.
Fey
PD
. Modality of bacterial growth presents unique targets: how do we treat biofilm-mediated infections? . Curr Opin Microbiol.
2010; ; 13 : :610.–615. 43.
Pamp
SJ
,
Gjermansen
M
,
Johansen
HK
,
Tolker-Nielsen
T
. Tolerance to the antimicrobial peptide colistin in Pseudomonas aeruginosa biofilms is linked to metabolically active cells, and depends on the pmr and mexAB-oprM genes . Mol Microbiol.
2008; ; 68 : :223.–240. 44.
Singh
PK
,
Parsek
MR
,
Greenberg
EP
,
Welsh
MJ
. A component of innate immunity prevents bacterial biofilm development . Nature.
2002; ; 417 : :552.–555. 45.
Yang
L
,
Liu
Y
, et al.
Combating biofilms . FEMS Immunol Med Microbiol.
2011. 46.
Tiller
JC
,
Liao
CJ
,
Lewis
K
,
Klibanov
AM
. Designing surfaces that kill bacteria on contact . Proc Natl Acad Sci USA.
2001; ; 98 : :5981.–5985. 47.
Hentzer
M
,
Givskov
M
. Pharmacological inhibition of quorum sensing for the treatment of chronic bacterial infections . J Clin Invest.
2003; ; 112 : :1300.–1307. 48.
Hoffmann
N
,
Lee
B
,
Hentzer
M
, et al.
Azithromycin blocks quorum sensing and alginate polymer formation and increases the sensitivity to serum and stationary-growth-phase killing of Pseudomonas aeruginosa and attenuates chronic P. aeruginosa lung infection in Cftr-/-
mice . Antimicrob Agents Chemother.
2007; ; 51 : :3677.–3687. 49.
Saiman
L
,
Marshall
BC
,
Mayer-Hamblett
N
, et al.
Azithromycin in patients with cystic fibrosis chronically infected with Pseudomonas aeruginosa: a randomized controlled trial . JAMA.
2003; ; 290 : :1749.–1756. 50.
Feola
DJ
,
Garvy
BA
,
Cory
TJ
, et al.
Azithromycin alters macrophage phenotype and pulmonary compartmentalization during lung infection with Pseudomonas
. Antimicrob Agents Chemother.
2010; ; 54 : :2437.–2447. 51.
Cirioni
O
,
Giacometti
A
,
Ghiselli
R
, et al.
RNAIII-inhibiting peptide significantly reduces bacterial load and enhances the effect of antibiotics in the treatment of central venous catheter-associated Staphylococcus aureus infections . J Infect Dis.
2006; ; 193 : :180.–186. 52.
Antoniani
D
,
Bocci
P
,
Maciag
A
, et al.
Monitoring of diguanylate cyclase activity and of cyclic-di-GMP biosynthesis by whole-cell assays suitable for high-throughput screening of biofilm inhibitors . Appl Microbiol Biotechnol.
2010; ; 85 : :1095.–1104. 53.
Walz
JM
,
Avelar
RL
,
Longtine
KJ
, et al.
Anti-infective external coating of central venous catheters: a randomized, noninferiority trial comparing 5-fluorouracil with chlorhexidine/silver sulfadiazine in preventing catheter colonization . Crit Care Med.
2010; ; 38 : :2095.–2102. 54.
Kohler
T
,
Perron
GG
,
Buckling
A
,
van Delden
C.
Quorum sensing inhibition selects for virulence, cooperation in Pseudomonas aeruginosa
. PLoS Pathog.
2010; ; 6 : :e1000883.. 55.
Davies
DG
,
Marques
CN
. A fatty acid messenger is responsible for inducing dispersion in microbial biofilms . J Bacteriol.
2009; ; 191 : :1393.–1403. 56.
Boles
BR
,
Horswill
AR.
Agr-mediated dispersal of Staphylococcus aureus biofilms . PLoS Pathog.
2008; ; 4 : :e1000052.. 57.
Kolodkin-Gal
I
,
Romero
D
,
Cao
S
, et al.
D-amino acids trigger biofilm disassembly . Science.
2010; ; 328 : :627.–629. 58.
O’Toole
GA
. Microbiology: Jekyll or hide? . Nature.
2004; ; 432 : :680.–681. 59.
Kim
JS
,
Heo
P
,
Yang
TJ
, et al.
Selective killing of bacterial persisters by a single chemical compound without affecting normal antibiotic-sensitive cells . Antimicrob Agents Chemother.
2011; ; 55 : :5380.–5383. 60.
Allison
KR
,
Brynildsen
MP
,
Collins
JJ
. Metabolite-enabled eradication of bacterial persisters by aminoglycosides . Nature.
2011; ; 473 : :216.–220. 61.
Pflumm
M
. Caught on film . Nat Med.
2011; ; 17 : :650.–653. 62.
Ebert
T
,
Smith
S
,
Pancari
G
, et al.
Development of a rat central venous catheter model for evaluation of vaccines to prevent Staphylococcus epidermidis and Staphylococcus aureus early biofilms . Hum Vaccin.
2011; ; 7 : :630.–638. 63.
Brady
RA
,
O’May
GA
,
Leid
JG
, et al.
Resolution of Staphylococcus aureus biofilm infection using vaccination and antibiotic treatment . Infect Immun.
2011; ; 79 : :1797.–1803. 64.
Filloux
A
,
Ventre
I
. Des senseurs pour contrôler le style de vie bactérien : le choix entre infection chronique ou aiguë . Med Sci (Paris).
2006; ; 22 : :811.–814. 65.
Kojic
EM
,
Darouiche
RO
. Candida infections of medical devices . Clin Microbiol Rev.
2004; ; 17 : :255.–267. 66.
Ramage
G
,
Mowat
E
,
Jones
B
, et al.
Our current understanding of fungal biofilms . Crit Rev Microbiol.
2009; ; 35 : :340.–355. 67.
Muller
FM
,
Seidler
M
,
Beauvais
A.
,
Aspergillus fumigatus biofilms in the clinical setting . Med Mycol.
2011; ; 49 ( suppl 1) : :S96.–100. 68.
Beauvais
A
,
Schmidt
C
,
Guadagnini
S
, et al.
An extracellular matrix glues together the aerial-grown hyphae of Aspergillus fumigatus
. Cell Microbiol.
2007; ; 9 : :1588.–1600. 69.
Loussert
C
,
Schmitt
C
,
Prevost
MC
, et al.
In vivo biofilm composition of Aspergillus fumigatus
. Cell Microbiol.
2010; ; 12 : :405.–410. 70.
Spoering
AL
,
Lewis
K
. Biofilms and planktonic cells of Pseudomonas aeruginosa have similar resistance to killing by antimicrobials . J Bacteriol.
2001; ; 183 : :6746.–6751. 71.
Cateau
E
,
Rodier
MH
,
Imbert
C
. Candidoses associées aux cathéters : quelle place pour les verrous antifongiques ? . Med Sci (Paris).
2012; ; 28 : :740.–745. 72.
Goodman
SD
,
Obergfell
KP
,
Jurcisek
JA
, et al.
Biofilms can be dispersed by focusing the immune system on a common family of bacterial nucleoid-associated proteins . Mucosal Immunol.
2011; ; 4 : :625.–637. 73.
Glonti
T
,
Chanishvili
N
,
Taylor
PW
. Bacteriophage-derived enzyme that depolymerizes the alginic acid capsule associated with cystic fibrosis isolates of Pseudomonas aeruginosa
. J Appl Microbiol.
2010; ; 108 : :695.–702. |