| |
| Med Sci (Paris). 2012 August; 28(8-9): 701–703. Published online 2012 August 22. doi: 10.1051/medsci/2012288009.TMC1 et TMC2 Partenaires essentiels dans l’audition et l’équilibre Gwenaëlle S.G. Géléoc1* 1F.M. Kirby Neurobiology Center, Department of otolaryngology, Boston Children’s Hospital and Harvard Medical School, 300 Longwood Avenue, Boston, MA 02115-5737, États-Unis. MeSH keywords: Adenoviridae, génétique, Animaux, Cils vibratiles, physiologie, Potentiels microphoniques cochléaires, Modèles animaux de maladie humaine, Thérapie génétique, Vecteurs génétiques, usage thérapeutique, Cellules ciliées vestibulaires, Ouïe, Surdité neurosensorielle, congénital, physiopathologie, thérapie, Humains, Mécanorécepteurs, Protéines membranaires, déficit, Souris, Souris knockout, Mutants neurologiques de souris, Vertige, Labyrinthe vestibulaire |
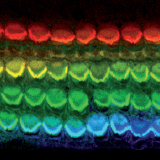
Photo : surface apicale de l’organe auditif de Corti de souris dévoilant une rangée de cellules sensorielles internes (rouge) et trois rangées de cellules ciliées externes (jaune, vert et bleu). Marquage réalisé avec une toxine fluorescente marquant les filaments d’actine (Alexafluor-Phalloidin) suivi d’un ajustement artistique en fausses couleurs (© Dr Jeffrey Holt). La surdité est le déficit sensoriel le plus fréquent. On estime à 1/700 la fréquence des naissances d’enfants atteints de surdité profonde ou sévère, et environ 80 % des surdités précoces sont d’origine génétique. Durant les deux dernières décennies, de nombreux gènes de surdité ont été identifiés grâce à l’étude de lignées de souris mutantes [
1]. De telles lignées sont en particulier à l’origine de la découverte de deux gènes exprimés par les cellules sensorielles de l’oreille interne (cellules ciliées) et indispensables à l’audition : transmembrane channel-like 1 et 2 (Tmc1 et Tmc2). Les cellules ciliées de l’oreille interne sont des éléments clés du système sensoriel auditif et vestibulaire [1]. Elles jouent le rôle de capteurs mécaniques grâce à la présence d’une touffe de stéréocils (ou microvillosités) qui émergent à leur extrémité apicale dans le fluide environnant (Figure 1A, 1B) [
2] Le déplacement de ces stéréocils déclenche une cascade d’événements qui débute par l’ouverture de canaux mécanosensibles et l’entrée de cations qui dépolarisent la cellule sensorielle (Figure 1C). Le signal engendré par cette transduction mécanoélectrique se propage aux fibres nerveuses afférentes, puis au système nerveux central chargé de décoder l’information.
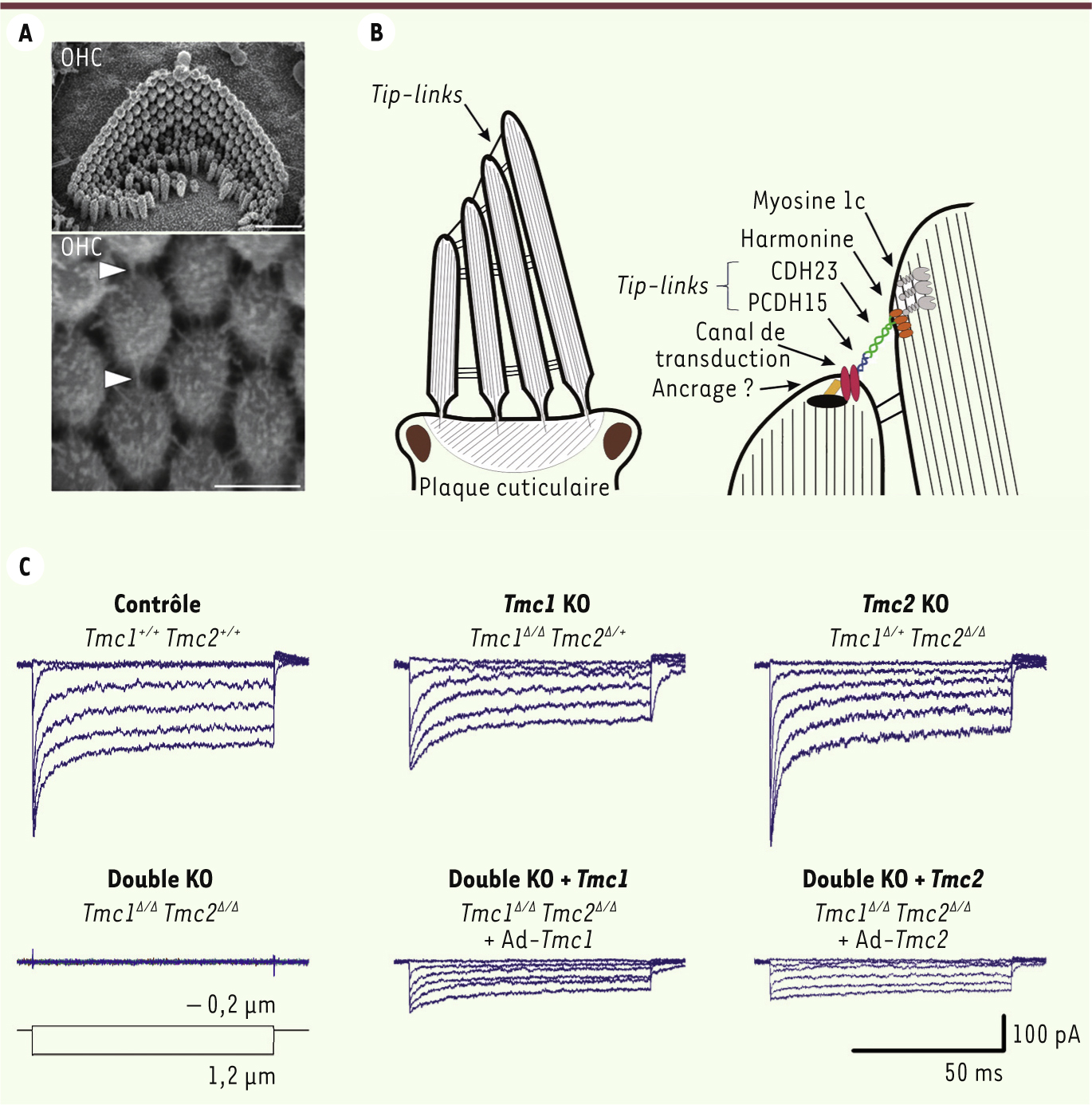
 | Figure 1.
Structure apicale des cellules ciliées sensorielles et transduction mécanoélectrique. A. Photographies obtenues par microscopie électronique montrant la structure stérociliée présente à l’apex des cellules sensorielles externes, les outer hair cells (OHC), en l’absence de TMC1 et TMC2, trois jours après la naissance. La structure ciliée ainsi que les liens apicaux ( tip-links) sont préservés. Barre d’échelle : 1 µm (panneau du haut) et 250 nm (panneau du bas). B. Schéma de la touffe ciliaire et du complexe mécanoélectrique présent à l’extrémité des stéréocils. PCDH15 : protocadherin-15, CDH23 : cadherin-23. C. Courants de mécanotransduction évoqués par des déplacements de la touffe ciliaire de cellules ciliées externes (OHC) de souris contrôles et mutantes ( knockout [KO] ; notées ∆) pour Tmc1 et/ou Tmc2. Analyse du rétablissement de la mécanosensitivité après réinsertion des séquences codantes (ADNc) pour Tmc1 (Ad- Tmc1) ou Tmc2 (Ad- Tmc1) au moyen de vecteurs adénoviraux. Ces enregistrements proviennent de tissus prélevés durant la 1 re semaine postnatale (portion apicale de la cochlée). Les panneaux A et C extraits de [
6] ont été modifiés et utilisés avec la permission du J Clin Invest.
|
Différents éléments formant le complexe mécanosensible présent à l’extrémité des stéréocils ont été identifiés au cours des dernières années, mais le présumé canal de transduction demeure une énigme. Divers travaux de recherche ont démontré la présence de TMC1 et TMC2 dans les cellules ciliées de l’oreille interne. Par ailleurs, des mutations du gène TMC1/Tmc1 sont à l’origine de surdités chez l’homme et la souris. Ainsi, TMC1 apparaît comme un élément nécessaire au bon fonctionnement des cellules ciliées. Nos travaux révèlent le rôle joué par TMC1 et TMC2 dans les cellules ciliées de l’oreille interne. Ils font suite à plus de 50 années de recherche dans ce domaine. |
Chronologie d’une découverte En 1956, le Pr M.S. Deol décrit un nouveau mutant murin souffrant de surdité récessive, deafness (dn). La transmission mendélienne des souris dn suggère qu’une mutation d’un gène unique est responsable de ce phénotype [
3]. Les souris homozygotes (dn/dn) se révèlent profondément sourdes dès la naissance. Dès cette époque, M.S. Deol et W. Kocher notent également chez les mutants de légers troubles de l’équilibre ainsi qu’une dégénérescence de l’épithélium sensoriel auditif à partir du dixième jour postnatal. En 1980, K.P. Steel et G.R. Bock [
4] décrivent chez ces souris l’absence de potentiel microphonique cochléaire (signal électrique produit par les cellules ciliées), malgré la présence de cellules sensorielles relativement bien conservées après la naissance chez les souris homozygotes dn/dn. Par ailleurs, ils notent que le potentiel endocochléaire (potentiel transépithélial existant entre les compartiments endolymphatiques et périlymphatiques de la cochlée) est normal chez les souris homozygotes dn/dn. Ces auteurs proposent alors deux hypothèses : selon la 1re, les cellules sensorielles ne sont pas stimulées mécaniquement ; selon la seconde, le mécanisme responsable de la génération des potentiels microphoniques après la stimulation mécanique est absent. Le potentiel microphonique résultant de l’entrée d’ions dans les cellules sensorielles, K.P. Steel et G.R. Bock concluent que les canaux ioniques mécanosensibles ne doivent pas s’ouvrir normalement chez les souris homozygotes dn/dn. Une trentaine d’années plus tard, nos travaux viennent valider cette hypothèse si pertinente pour l’époque. En 2002, K. Kurima et al. [
5] identifient le gène impliqué dans une forme de surdité héréditaire dominante (DFNA36) ou récessive (DFNB7/B11) chez l’homme comme étant TMC1 (présent sur le chromosome 9q13-21). Son orthologue murin Tmc1 est alors identifié comme étant muté chez les souris dn mutantes. TMC1/Tmc1 est exprimé dans les cellules ciliées, de même qu’un autre membre de cette famille, présent sur le chromosome 20 (20p13), TMC2. Ces deux gènes codent pour des protéines à motifs transmembranaires (TM). De manière concomitante, S. Vreugde et al. [6] décrivent une nouvelle mutation du gène Tmc1 créée par mutagenèse induite (N-éthyl N-nitrosourée) chez la souris Beethoven (Bth). Chez cette souris comme chez la souris dn, les cellules ciliées dégénèrent durant la 2e semaine postnatale tout en maintenant leur mécanosensibilité [
7]. |
TMC1 et TMC2 : acteurs essentiels au bon fonctionnement des cellules ciliées Dans le but de déterminer le rôle joué par TMC1 et TMC2 dans l’oreille interne, nous avons choisi de combiner diverses approches. Chez la souris, les cellules ciliées se différencient à partir du 13e jour embryonnaire et leur maturation progresse le long de l’organe auditif (cochlée), de la base (zone de réception des hautes fréquences) vers la partie apicale (réception des basses fréquences). Bien que Tmc1 et Tmc2 soient tous deux exprimés par les cellules sensorielles de l’oreille interne, l’étude quantitative d’ARN messager (ARNm) le long de la cochlée montre une dynamique d’expression différente : l’expression de Tmc2 précède celle de Tmc1 mais apparaît transitoire, déclinant dramatiquement après le 3e jour postnatal (P3) à la base de la cochlée, et le 5e jour postnatal (P5) à l’apex [
8]. Nos travaux récents démontrent ainsi un switch d’expression, ou échange, entre Tmc2 et Tmc1 durant la 1re semaine postnatale. L’expression de ces gènes dans l’oreille interne apparaît par hybridation in situ comme étant spécifique des cellules sensorielles. Afin de déterminer le rôle joué par ces deux gènes, nous avons produit deux lignées de souris génétiquement modifiées : l’une porte une mutation nulle pour Tmc1 (Tmc1Δ/Δ
) et l’autre une mutation nulle pour Tmc2 (Tmc2Δ/Δ
). Dans cette dernière lignée où Tmc2 est absente, les souris ne présentent aucun déficit auditif, tandis que l’absence de Tmc1 se traduit par une défaillance auditive sévère, démontrée par l’analyse des potentiels évoqués auditifs du tronc cérébral (auditory brainstem response [ABR]). Les souris double-mutantes (Tmc1Δ/Δ
; Tmc2Δ/Δ
), qui ont une absence totale des deux gènes, présentent en outre des troubles comportementaux : elles tournent en rond et hochent fréquemment la tête. Ces troubles, qui accompagnent fréquemment les déficits sensoriels auditifs, suggèrent que ces gènes occupent aussi une fonction importante dans le système vestibulaire. Suspectant une origine sensorielle, nous avons analysé la morphologie et la physiologie des cellules ciliées chez ces différents modèles mutants. En l’absence de Tmc1 ou/et de Tmc2, les cellules sensorielles et leur touffe ciliaire sont bien préservées durant la 1re semaine postnatale (Figure 1A). L’analyse des courants de mécanotransduction induits par un déplacement de la touffe ciliaire révèle que seules les cellules des souris doubles-mutantes perdent leur capacité de réponse, ceci tout au long de la cochlée (Figure 1C). Ces résultats suggèrent une redondance entre les deux gènes, tout au moins durant le développement de l’organe sensoriel auditif. |
Sauvetage des cellules ciliées par thérapie génique à base d’un vecteur viral La question que nous nous sommes posés est très simple : serait-il possible de réparer les cellules sensorielles des souris doubles-mutantes ? Dans de très nombreux cas de surdité congénitale touchant des gènes exprimés dans les cellules sensorielles, les structures ciliées apicales sont endommagées. Dans le cas des souris Tmc1/2 doubles-mutantes, la structure apicale reste relativement bien conservée durant la 1re semaine postnatale. Nous nous sommes donc demandé si la réintroduction des gènes manquants pourrait permettre de rétablir la mécanosensibilité des cellules ciliées. Nous avons ainsi créé des vecteurs adénoviraux nous permettant de réintroduire les gènes Tmc1 et/ou Tmc2 dans les cellules ciliées de cochlées prélevées durant la 1re semaine postnatale chez les souris doubles-mutantes (Tmc1Δ/Δ
; Tmc2Δ/Δ
). La réintroduction des gènes Tmc1 ou Tmc2 restitue la mécanosensibilité dans les cellules ciliées cochléaires (Figure 1C), ce qui n’est pas le cas pour la forme mutante dn de Tmc1 [8]. Ces résultats sont très encourageants car ils suggèrent qu’ajouter le maillon manquant durant la période critique du développement permettrait de rétablir le fonctionnement des récepteurs sensoriels de l’oreille. Il est envisageable que l’application de cette technique in vivo chez la souris double-mutante puisse ainsi restituer, au moins en partie, une réceptivité auditive et vestibulaire. |
Les protéines transmembrane channel-like (TMC) : une famille au rôle inconnu Tandis que huit gènes appartenant à la famille des TMC ont été identifiés chez les vertébrés, leur fonction reste inconnue. Dans l’oreille interne, TMC1 et TMC2 sont nécessaires au bon fonctionnement des cellules ciliées durant le développement. Ils contribuent à l’initiation et au bon fonctionnement du complexe moléculaire mécanosensible présent à l’extrémité des stéréocils. Forment-ils le canal de mécanotransduction dont l’identité reste un mystère ? Bien que cela soit possible, il reste à démontrer que ces molécules sont capables de former un canal transmembranaire dont les propriétés biophysiques (en particulier perméabilité et pharmacologie) reflètent celles des canaux mécanosensibles des cellules ciliées. Les gènes Tmc sont exprimés dans de nombreux tissus [
9] et ils codent pour des protéines possédant 6 à 8 domaines transmembranaires relativement bien conservés entre l’homme et la souris (75 à 96 % d’homologie). De tels chiffres suggèrent que ces protéines jouent un rôle essentiel, non seulement dans les cellules ciliées, mais aussi dans de nombreux autres types cellulaires - peut-être mécanosensibles. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
L’auteur remercie Deborah Scheffer, Véronique Pingault et Alban Latrimonière pour leurs commentaires sur le manuscrit. Ce travail a été soutenu par le National Institutes of Health (NIDCD).
|
1.
Hardelin
JP
,
Denoyelle
F
,
Levilliers
J
, et al.
Les surdités héréditaires : génétique moléculaire . Med Sci (Paris).
2004; ; 20 : :311.–316. 2.
Grillet
N.
Harmonine est un composant de la machinerie de mécanotransduction auditive . Med Sci (Paris).
2009; ; 25 : :903.–906. 3.
Deol
MS
,
Kocher
W.
A new gene for deafness in the mouse . Heredity.
1958; ; 12 : :463.–466. 4.
Steel
KP
,
Bock
GR.
The nature of inherited deafness in deafness mice . Nature.
1980; ; 288 : :159.–161. 5.
Kurima
K
,
Peters
LM
,
Yang
Y
, et al.
Dominant and recessive deafness caused by mutations of a novel gene, TMC1, required for cochlear hair-cell function . Nat Genet.
2002; ; 30 : :277.–284. 6.
Vreugde
S
,
Erven
A
,
Kros
CJ
, et al.
Beethoven, a mouse model for dominant, progressive hearing loss DFNA36 . Nat Genet.
2002; ; 30 : :257.–258. 7.
Marcotti
W
,
Erven
A
,
Johnson
SL
, et al.
Tmc1 is necessary for normal functional maturation and survival of inner and outer hair cells in the mouse cochlea . J Physiol.
2006; ; 574 : :677.–698. 8.
Kawashima
Y
,
Géléoc
GS
,
Kurima
K
, et al.
Mechanotransduction in mouse inner ear hair cells requires transmembrane channel-like genes . J Clin Invest.
2011; ; 121 : :4796.–4809. 9.
Keresztes
G
,
Mutai
H
,
Heller
S.
TMC and EVER genes belong to a larger novel family, the TMC gene family encoding transmembrane proteins . BMC Genomics.
2003; ; 4 : :24.. |