| |
| Med Sci (Paris). 2012 August; 28(8-9): 698–700. Published online 2012 August 22. doi: 10.1051/medsci/2012288008.Le cytomégalovirus dit stop à l’autophagie Un mécanisme de défense antivirale Marion Lussignol,1** Magali Chaumorcel,1 Lina Mouna,1 and Audrey Esclatine1* 1Inserm UMR 984, Université Paris Sud, Faculté de Pharmacie, 5, rue Jean-Baptiste Clément, 92296Châtenay-Malabry Cedex, France MeSH keywords: Protéines régulatrices de l'apoptose, physiologie, Autophagie, Bécline-1, Cytomegalovirus, Infections à cytomégalovirus, anatomopathologie, virologie, Fibroblastes, Interactions hôte-pathogène, Humains, Protéines membranaires, Modèles biologiques, Phagosomes, Récepteur de type Toll-2, Réplication virale |
L’autophagie est un mécanisme complexe de défense antivirale L’autophagie - du grec αυτο (soi-même) et φαγειν (manger) - est avant tout un mécanisme constitutif de dégradation des protéines de longue durée de vie et des organites, comme les mitochondries endommagées. Elle se déroule en plusieurs étapes : une membrane préautophagosomale ou phagophore se forme notamment à partir des membranes du réticulum endoplasmique et séquestre une partie du cytoplasme (Figure 1). Cette structure membranaire se courbe en faisant intervenir des protéines Atg (autophagy related genes) spécifiques de l’autophagie, puis se ferme pour donner l’autophagosome, une vésicule à double membrane caractéristique de la voie autophagique. L’autophagosome fusionne ensuite avec un lysosome pour donner l’autolysosome dans lequel le contenu est dégradé par les enzymes lysosomales. Une protéine de la machinerie autophagique, bécline 1, qui est une protéine hautement régulée, intervient dans les étapes de formation et de maturation des autophagosomes (Figure 1).
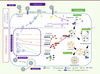 | Figure 1.
Modulation de l’autophagie par le CMV au cours du cycle viral. L’autophagie débute par la formation du phagophore, initiée par le complexe bécline 1/Vps34 (vacuolar protein sorting 34)/ATG14. Puis le phagophore s’allonge, se recourbe et se referme pour former l’autophagosome. Cette étape d’élongation fait intervenir les deux systèmes de conjugaison Atg5-Atg12 et LC3 (light chain 3)-phosphatidylethanolamine. L’autophagosome fusionne ensuite avec le lysosome pour former l’autolysosome, faisant intervenir cette fois le complexe bécline 1/Vps34/UVRAG (UV radiation resistance associated gene) au cours de la maturation. Le contenu de l’autolysosome est dégradé par les enzymes lysosomales. Les premières étapes de l’infection des cellules par le CMV stimulent l’autophagie. Après une liaison initiale aux héparanes sulfates, le virus se fixe sur des récepteurs membranaires spécifiques, puis entre par fusion de son enveloppe avec la membrane plasmique et libère sa nucléocapside. Lors de son contact avec la surface cellulaire, le virus se fixe également sur le récepteur de type Toll TLR2, et ainsi active une cascade de signalisations. Dans la cellule, la nucléocapside migre et libère son génome dans le noyau. La fixation du virus sur les héparanes sulfates est nécessaire à la stimulation précoce de l’autophagie. Le génome viral semble être également impliqué dans cette stimulation, mais la fixation du virus sur TLR2 pourrait également jouer un rôle. Débute ensuite la synthèse séquentielle des protéines virales très précoces, précoces, puis la réplication de l’ADN, et enfin la synthèse des protéines tardives. On note alors une inhibition de la formation des autophagosomes. La protéine TRS1, une protéine précoce, est capable d’inhiber l’autophagie en se liant à bécline 1. |
Depuis quelques années, il a été montré que l’autophagie peut également participer à la protection de la cellule vis-à-vis des infections, notamment des infections virales. Ce mécanisme antiviral semble revêtir plusieurs aspects. Il pourrait s’agir de capturer des virus ou des protéines virales dans les autophagosomes pour cibler leur dégradation par la voie autophagique. On parle alors de xénophagie. Par exemple, au cours de l’infection par le virus Sindbis, le stress engendré par l’accumulation des protéines virales dans les neurones est contrecarré par la dégradation autophagique de ces agrégats [
1,
13]. L’autophagie participe aussi à l’immunité innée, notamment en facilitant l’interaction des génomes viraux avec les récepteurs membranaires de type Toll (Toll-like receptors ou TLR) présents dans les endosomes. Son rôle dans l’immunité adaptative serait de contribuer à la présentation des antigènes viraux aux cellules effectrices de l’immunité [
2,
14]. Face à ces mécanismes de défense cellulaire, les virus ne se laissent pas faire. Ainsi, dans la famille des Herpès-virus, plusieurs protéines virales sont capables de bloquer l’autophagie, comme la viral Fas-associated death domain-like interleukin-1β-converting enzyme-inhibitory protein (vFLIP) de l’Herpèsvirus humain 8 (HHV-8), qui bloque l’action d’Atg3 [
3]. Contrairement à la protéine anti-autophagique cellulaire Bcl-2 (B-cell lymphoma 2) dont l’action est régulée, son homologue chez HHV-8, nommée vBcl-2, se lie et bloque l’activité de bécline 1 de manière non réversible [
4]. |
La machinerie autophagique s’emballe en réponse à l’infection Le cytomégalovirus (CMV), un virus de la famille des Herpès, cause des infections asymptomatiques chez les sujets sains. En revanche, il est responsable d’infections congénitales et de graves manifestations cliniques chez les personnes immunodéprimées, comme après une greffe d’organe. Nos travaux, ainsi que ceux de l’équipe de Chris Preston, ont récemment montré que l’infection des cellules par le CMV entraîne très rapidement une induction de l’autophagie [
5,
6]. En effet, la cellule répond au stress de l’infection en accumulant aussi bien des autophagosomes que des autolysosomes dans le cytoplasme (figure 1). Un virus inactivé, qui ne fabrique pas de nouvelles protéines virales mais est capable d’entrer dans la cellule, stimule l’autophagie. Cette activation de l’autophagie est donc due à la détection du virus ou de ses composants par la cellule. Chris Preston et ses collaborateurs proposent le génome viral comme signal d’activation, même si la majorité de l’ADN viral libre est plutôt nucléaire [6]. Nous explorons actuellement l’hypothèse selon laquelle la fixation du virus sur TLR2 serait responsable de l’activation précoce de l’autophagie. En effet, le CMV interagit avec TLR2 à la surface de la cellule, entraînant une cascade de signalisations [
7]. De plus, l’activation des TLR déclenche en général une induction de l’autophagie [
8]. Le déclenchement de l’autophagie en réponse à l’infection par le CMV ne semble pas un fait isolé, mais plutôt un mécanisme général puisqu’il a été rapporté pour d’autres virus [2]. L’interaction du virus de la rougeole avec son récepteur CD46, ou encore la fixation des protéines d’enveloppe du VIH (virus de l’immunodéficience humaine) sur ses récepteurs et corécepteurs à la surface des cellules stimule immédiatement l’autophagie. On peut imaginer qu’il s’agit d’une réponse rapide de la cellule pour mettre en place son système de défense. Dans le cas du CMV, la finalité de cette réponse autophagique n’est pas encore bien comprise. Dans le contexte de l’encéphalite herpétique à HSV-1 (Herpes simplex virus de type 1), l’activation de l’autophagie semble diminuer la virulence d’HSV-1 dans les neurones et ainsi les protéger de la multiplication virale [
9, 13]. |
Le CMV est armé pour se défendre contre l’autophagie Grâce à ses protéines virales, le CMV va mettre en place dans un second temps un système de blocage actif et performant de l’autophagie. Ce blocage se produit au moment de la formation des autophagosomes (Figure 1). C’est la particularité du cycle de multiplication du CMV, particulièrement lent dans le règne des virus, qui a facilité la mise en évidence de ces deux phases de modulation de l’autophagie au cours de l’infection [5,
10]. La protéine précoce TRS1 (terminal repeat short 1) du CMV a été identifiée par notre laboratoire comme un inhibiteur fort de l’autophagie [5]. D’ailleurs, un virus mutant △TRS1, qui n’exprime pas TRS1, n’est plus capable d’inhiber l’autophagie. Comme d’autres protéines virales inhibitrices de l’autophagie, TRS1 va bloquer l’initiation de l’autophagie en se liant à bécline 1 (Figure 1). Ce mécanisme d’action n’allait pas de soi car TRS1 bloque aussi la protéine kinase R (PKR), un senseur de l’infection virale qui fait partie d’une voie de stimulation de l’autophagie [
11,
12]. Malgré cette liaison directe à PKR, TRS1 agit indépendamment de PKR pour bloquer l’autophagie via bécline 1. Il semble que le virus soit également capable de moduler la kinase mTOR (mammalian target of rapamycin), également impliquée dans la régulation de l’autophagie [10]. Même si à l’heure actuelle, le rôle de l’autophagie vis-à-vis du CMV n’a pas été clairement explicité, le fait que le virus ait développé au moins une protéine virale pour bloquer spécifiquement cette voie confirme bien qu’il s’agit d’un mécanisme antiviral important dont il sera primordial de comprendre le fonctionnement dans le futur. Un proche cousin du CMV, HSV-1, est également capable de bloquer l’autophagie, notamment grâce à la protéine virale ICP34.5 (infected cell protein 34.5) [9, 11]. Bien qu’il n’existe pas d’homologie entre les protéines TRS1 et ICP34.5, leur mécanisme d’action semble similaire puisque ICP34.5 se lie à bécline 1 pour bloquer les étapes initiales de l’autophagie. Il ne semble pas que l’autophagie soit capable de limiter la multiplication d’HSV-1 d’une manière significative, du moins in vitro, mais elle permet peut être de le faire in vivo et de contrer sa neurovirulence. Il est intéressant de noter que deux virus voisins utilisent une stratégie similaire de blocage de l’activité de bécline 1 via deux protéines structurellement très différentes. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Orvedahl
A
,
MacPherson
S
,
Sumpter
R
Jr
, et al.
Autophagy protects against Sindbis virus infection of the central nervous system . Cell Host Microbe.
2010; ; 7 : :115.–127. 2.
Joubert
PE
,
Pombo Gregoire
I
,
Meiffren
G
, et al.
Autophagie et pathogènes - « Bon appétit Messieurs ! ».
Med Sci (Paris).
2011; ; 27 : :41.–47. 3.
Lee
JS
,
Li
Q
,
Lee
JY
, et al.
FLIP-mediated autophagy regulation in cell death control . Nat Cell Biol.
2009; ; 11 : :1355.–1362. 4.
Pattingre
S
,
Tassa
A
,
Qu
X
, et al.
Bcl-2 antiapoptotic proteins inhibit Beclin 1-dependent autophagy . Cell.
2005; ; 122 : :927.–939. 5.
Chaumorcel
M
,
Lussignol
M
,
Mouna
L
, et al.
The human cytomegalovirus protein TRS1 inhibits autophagy via its interaction with Beclin 1 . J Virol.
2011; ; 86 : :2571.–2584. 6.
McFarlane
S
,
Aitken
J
,
Sutherland
JS
, et al.
Early induction of autophagy in human fibroblasts after infection with human cytomegalovirus or herpes simplex virus 1 . J Virol.
2011; ; 85: :4212.–4221. 7.
Juckem
LK
,
Boehme
KW
,
Feire
AL
,
Compton
T
. Differential initiation of innate immune responses induced by human cytomegalovirus entry into fibroblast cells . J Immunol.
2008; ; 180 : :4965.–4977. 8.
Delgado
MA
,
Elmaoued
RA
,
Davis
AS
, et al.
Toll-like receptors control autophagy . EMBO J.
2008; ; 27 : :1110.–1121. 9.
Orvedahl
A
,
Alexander
D
,
Talloczy
Z
, et al.
HSV-1 ICP34.5 confers neurovirulence by targeting the Beclin 1 autophagy protein . Cell Host Microbe.
2007; ; 1 : :23.–36. 10.
Chaumorcel
M
,
Souquere
S
,
Pierron
G
, et al.
Human cytomegalovirus controls a new autophagy-dependent cellular antiviral defense mechanism . Autophagy.
2008; ; 4 : :1.–8. 11.
Talloczy
Z
,
Jiang
W
,
Virgin
HWt
, et al.
Regulation of starvation- and virus-induced autophagy by the eIF2alpha kinase signaling pathway . Proc Natl Acad Sci USA.
2002; ; 99 : :190.–195. 12.
Hakki
M
,
Marshall
EE
,
De Niro
KL
,
Geballe
AP
. Binding and nuclear relocalization of protein kinase R by human cytomegalovirus TRS1 . J Virol.
2006; ; 80 : :11817.–11826. 13.
Puyal
J
,
Ginet
V
,
Vaslin
A
,
Truttmann
AC
,
Clarke
PG
. Les deux visages de l’autophagie dans le système nerveux . Med Sci (Paris).
2009; ; 25 : :383.–390. 14.
English
L
,
Chemali
M
,
Desjardins
M
. Contribution de l’autophagie dans l’apprêtement d’antigènes viraux endogènes . Med Sci (Paris).
2009; ; 25 : :906.–909. |