| |
| Med Sci (Paris). 2012 August; 28(8-9): 687–689. Published online 2012 August 22. doi: 10.1051/medsci/2012288004.Implications du gène d’horloge Reverbα dans l’obésité Julien Delezie,1 Paul Pévet,1 and Étienne Challet1* 1Département neurobiologie des rythmes, Institut des neurosciences cellulaires et intégratives, CNRS UPR 3212 associé à l’université de Strasbourg, 5, rue Blaise Pascal, 67084Strasbourg, France MeSH keywords: Adiposité, génétique, Animaux, Horloges biologiques, physiologie, Troubles chronobiologiques, métabolisme, physiopathologie, Rythme circadien, Diabète de type 2, étiologie, Ration calorique, Métabolisme énergétique, Induction enzymatique, Humains, Hyperglycémie, Métabolisme des lipides, Lipoprotein lipase, déficit, Souris, Souris knockout, Modèles biologiques, Membre-1 du groupe D de la sous-famille-1 de récepteurs nucléaires, Obésité, Récepteurs cytoplasmiques et nucléaires, Protéines de répression |
En raison de sa prévalence sans cesse croissante, l’obésité, que l’on peut définir comme un excès de masse adipeuse, est devenue un problème majeur de santé publique, dans la mesure où la surcharge adipeuse est associée à de nombreuses complications métaboliques, telles que le diabète, l’hypertension et l’athérosclérose. Les facteurs génétiques mis à part, les deux causes principales d’obésité sont une surconsommation d’aliments riches en calories et un mode de vie sédentaire [
1,
2]. Caractérisée plus récemment, la désorganisation temporelle est un facteur aggravant qui favorise les désordres métaboliques [
3]. D’où la nécessité de prendre en considération la rythmicité journalière de la prise alimentaire et du métabolisme énergétique. |
Le concept de « chronobésité » Des horloges moléculaires dans le cerveau et les organes périphériques régulent notre physiologie sur 24 h. Ces variations endogènes, appelées rythmes circadiens (du latin circa : environ, et dies : jour), permettent aux organismes d’anticiper et d’être préparés aux changements périodiques de l’environnement, incluant le cycle lumière-obscurité et la disponibilité en nourriture. Or, des conditions inhabituelles d’éclairement (exposition à la lumière au cours de la nuit) ou des repas pris à des heures inadaptées pour l’organisme (pendant les heures normalement consacrées au sommeil) sont à la fois des situations de désynchronisation (c’est-à-dire qui altèrent la rythmicité circadienne) et des facteurs de risque métabolique. Ces arguments nous ont conduits à définir le concept de « chronobésité », c’est-à-dire une surcharge lipidique causée par une désorganisation circadienne [
4]. |
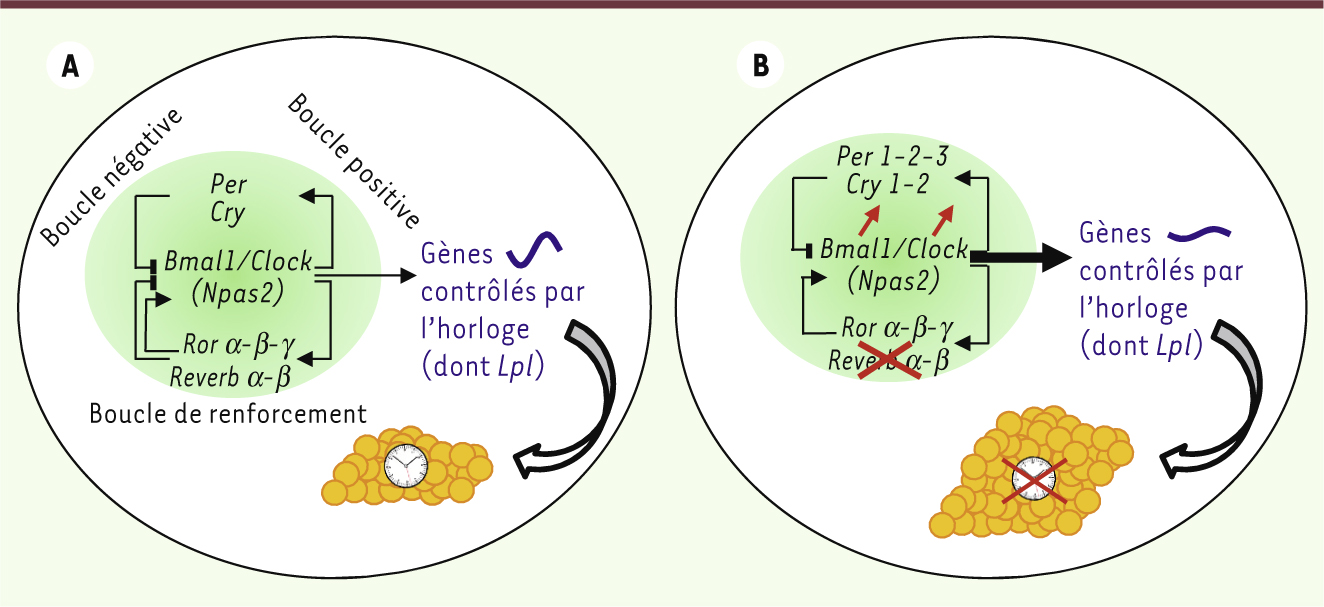
Les rythmes circadiens sont produits par un réseau d’horloges endogènes, dont la principale est située dans les noyaux suprachiasmatiques de l’hypothalamus. L’horloge suprachiasmatique est surtout remise à l’heure par la lumière ambiante perçue par la rétine. Les autres horloges et oscillateurs secondaires sont largement distribués dans l’organisme : rétine et nombreuses régions cérébrales, la quasi-totalité des tissus périphériques, dont le foie, le pancréas et les tissus adipeux. Ces horloges secondaires sont, pour la plupart, très sensibles à l’effet synchroniseur des repas. Quelle que soit la structure considérée, le fonctionnement des horloges circadiennes repose sur des boucles d’autorégulation d’environ 24 h qui impliquent des acteurs spécifiques appelés protéines d’horloge. Parmi elles, CLOCK (ou neuronal PAS domain-containing protein 2 [NPAS2]) et brain and muscle Arnt-like protein-1 (BMAL1) sont des régulateurs d’une boucle de rétroaction positive, leurs dimères étant capables d’activer la transcription de nombreux autres gènes d’horloge, tels que Period (Per) 1-2-3, Cryptochrome (Cry) 1-2, et les récepteurs nucléaires Ror (orphan nuclear receptor) α-β-γ et Reverbα-β (encore appelés Nr1d1-2) (→) [
9].
(→) Voir la Nouvelle de M. Teboul et F. Delaunay, page 689 de ce numéro
Les protéines CRY et PER forment une boucle de rétroaction négative par leur inhibition de la transactivation induite par les hétérodimères CLOCK/BMAL1 ou NPAS2/BMAL1. Les protéines ROR et REVERB, activent ou répriment respectivement la transcription de Bmal1, Npas2 et Clock, définissant une boucle de renforcement. De plus, des modifications post-traductionnelles, comme la phosphorylation des protéines d’horloge, vont également moduler leur activité transcriptionnelle ou leur capacité à dimériser, ainsi que leur localisation subcellulaire et leur dégradation [
5] (Figure 1).
 | Figure 1.
L’absence de Reverbα in vivo conduit à une surexpression du gène Lpl. Le gène codant pour la lipoprotéine lipase ( Lpl) appartient à la catégorie des gènes contrôlés par l’horloge, dans la mesure où sa transcription est rythmique dans le tissu adipeux, le muscle et le foie (à des niveaux plus faibles). L’un des régulateurs circadiens de Lpl est la protéine d’horloge CLOCK, avec ou sans BMAL1. La surexpression de Clock et Bmal1 chez les souris déficientes en Reverbα se traduit par une augmentation des niveaux d’ARNm codant la Lpl, notamment dans le tissu adipeux blanc (d’après [
6]). |
|
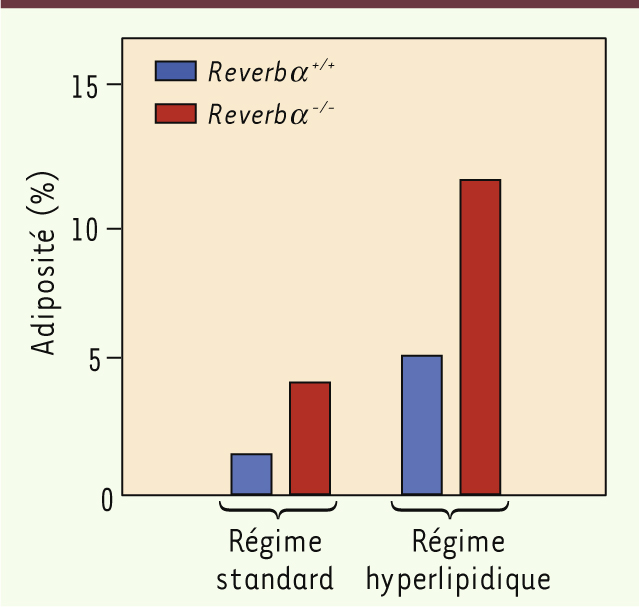
Rôle de REVERBα et Lpl dans la chronobésité Dans une étude récente, publiée dans le FASEB Journal [6], en collaboration avec un laboratoire strasbourgeois (institut pluridisciplinaire Hubert Curien, CNRS, université de Strasbourg), un laboratoire tourangeau (physiologie de la reproduction et des comportements, Inra, CNRS, université François Rabelais) et un laboratoire niçois (institut de biologie Valrose, CNRS, université de Nice), nous démontrons qu’une altération génétique des oscillations moléculaires provoquée par une invalidation du gène Reverbα chez la souris conduit à un syndrome d’obésité et d’hyperglycémie chronique [6], renforçant l’idée selon laquelle une organisation temporelle adéquate des événements métaboliques, qui dépend de nos horloges internes, est essentielle pour conserver une bonne santé. Menée au Chronobiotron, une plateforme d’expérimentation animale spécialisée dans l’analyse des rythmes biologiques (UMS 3415, CNRS et université de Strasbourg), cette nouvelle étude démontre que le gène Reverbα joue un rôle d’intégrateur moléculaire qui assure l’utilisation des substrats énergétiques au bon moment de la journée. Les souris dont le gène Reverbα a été invalidé deviennent obèses et hyperglycémiques, même si elles mangent la même quantité de nourriture, au même moment de la journée et avec le même niveau d’activité physique que les souris témoins. La différence majeure réside dans la manière dont les souris déficientes en Reverbα métabolisent les nutriments. En effet, ces souris deviennent obèses car elles synthétisent beaucoup plus de lipides pendant la phase de prise alimentaire et d’activité, et utilisent moins de glucides pendant la phase de repos [6]. En fait, le degré d’adiposité des souris déficientes en Reverbα nourries avec un régime normocalorique atteint celui des souris normales nourries avec un régime riche en graisses, donc hypercalorique. De plus, l’adiposité des souris déficientes en Reverbα croît de manière exponentielle si elles sont alimentées avec ce régime hypercalorique (Figure 2).
 | Figure 2.
L’absence de Reverbα in vivo provoque une augmentation de l’adiposité. Les souris déficientes en Reverbα ( Reverbα
-/- ;histogrammes rouges) nourries avec un régime standard ont une adiposité (définie comme le rapport de la masse adipeuse sur la masse corporelle) supérieure à celle des souris témoins ( Reverbα
+/+ ; histogrammes bleus). Cette altération métabolique est très largement amplifiée par un régime hyperlipidique (histogrammes de droite) (d’après [ 6]). |
La lipoprotéine lipase (Lpl) est une enzyme qui hydrolyse les triglycérides contenus dans les VLDL (very low density lipoproteins) et les chylomicrons et favorise la pénétration des acides gras dans les cellules, musculaires et adipeuses en particulier. Nos travaux révèlent également que l’expression du gène codant pour la Lpl chez les souris déficientes en Reverbα est fortement surexprimée, de manière constitutive ou à certaines heures du cycle selon l’organe considéré. Or, nous montrons que CLOCK, seul ou avec BMAL1, est capable d’activer la transcription de Lpl [6]. Cette dérégulation de la Lpl, qui favoriserait l’utilisation des acides gras dans le muscle et l’adipogenèse dans le tissu adipeux blanc, aurait pour origine la surexpression de CLOCK en l’absence de REVERBα (Figure 1).
D’autres études publiées récemment mettent en évidence une synergie d’action de REVERBα et REVERBβ dans la rythmicité circadienne et le métabolisme : les souris chez lesquelles les deux gènes sont invalidés ont une stéatose hépatique sévère, sont hyperglycémiques et quasiment arythmiques, même en présence d’un cycle de lumière et d’obscurité [
7–9] (→).
(→) Voir la Nouvelle de M. Teboul et F. Delaunay, page 689 de ce numéro
Nos résultats, ainsi que ces autres travaux, ouvrent la voie au développement de nouvelles stratégies thérapeutiques ciblant les voies de signalisation associées aux protéines REVERB pour limiter ou traiter les désordres circadiens et leurs conséquences sur l’homéostasie énergétique, comme l’illustre d’ailleurs une autre publication récente [
10]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Nous remercions tous les coauteurs de notre article dans FASEB journal pour leur aide.
|
1.
Barness
LA
,
Opitz
JM
,
Gilbert-Barness
E
. Obesity: genetic, molecular, and environmental aspects . Am J Med Genet A.
2007; ; 143A : :3016.–3034. 2.
Bergouignan
A
,
Rudwill
F
,
Simon
C
,
Blanc
S.
Physical inactivity as the culprit of metabolic inflexibility: evidence from bed-rest studies . J Appl Physiol.
2011; ; 111: :1201.–1210. 3.
Delezie
J
,
Challet
E
. Interactions between metabolism and circadian clocks: reciprocal disturbances . Ann NY Acad Sci.
2011; ; 1243 : :30.–46. 4.
Challet
E
. Horloges circadiennes, troubles métaboliques et chronobésité . Obesity.
2009; ; 3 : :73.–85. 5.
Dardente
H
. Redondance génétique et synchronisation cellulaire dans les horloges circadiennes . Med Sci (Paris).
2008; ; 24 : :270.–276. 6.
Delezie
J
,
Dumont
S
,
Dardente
H
, et al.
The nuclear receptor REV-ERBalpha is required for the daily balance of carbohydrate and lipid metabolism . FASEB J.
2012 ( sous presse.). 7.
Bugge
A
,
Feng
D
,
Everett
LJ
, et al.
Rev-erbalpha and Rev-erbbeta coordinately protect the circadian clock and normal metabolic function . Genes Dev.
2012; ; 26 : :657.–667. 8.
Cho
H
,
Zhao
X
,
Hatori
M
, et al.
Regulation of circadian behaviour and metabolism by REV-ERB-alpha and REV-ERB-beta . Nature.
2012; ; 485 : :123.–127. 9.
Teboul
M
,
Delaunay
F
. Les récepteurs REVERBα et REVERBβ donnent le tempo . Med Sci (Paris).
2012; ; 28 : :689.–692. 10.
Solt
LA
,
Wang
Y
,
Banerjee
S
, et al.
Regulation of circadian behaviour and metabolism by synthetic REV-ERB agonists . Nature.
2012; ; 485 : :62.–68. |