| |
| Med Sci (Paris). 2012 August; 28(8-9): 683–687. Published online 2012 August 22. doi: 10.1051/medsci/2012288003.Une altération de la neurogenèse conduit à des troubles de l’olfaction dans la sclérose en plaques Vanja Tepavčević,1 Brahim Nait-Oumesmar,1 and Anne Baron-Van Evercooren1* 1Centre de recherche de l’institut du cerveau et de la moelle épinière (Cricm), université Pierre et Marie Curie (UPMC) Paris 6, UMR-S975, Inserm U975, CNRS UMR 7225, assistance publique-hôpitaux de Paris (AP-HP), hôpital Pitié-Salpêtrière, 47, boulevard de l’Hôpital, 75013Paris, France MeSH keywords: Animaux, Lignage cellulaire, Mouvement cellulaire, Cytokines, pharmacologie, Maladies démyélinisantes, Gyrus denté, anatomopathologie, Encéphalomyélite auto-immune expérimentale, physiopathologie, Épendyme, Humains, Ventricules latéraux, Souris, Souris de lignée C57BL, Modèles neurologiques, Sclérose en plaques, complications, Cellules souches neurales, physiologie, Neurogenèse, Troubles de l'olfaction, étiologie, Bulbe olfactif, Oligodendroglie |
Les cellules souches du gyrus denté et de la zone sous-ventriculaire Ces dernières décennies ont été marquées par la découverte de cellules souches (CS) dans certaines régions du cerveau adulte : le gyrus denté et la zone sous-ventriculaire (ZSV). Ces cellules donnent naissance, tout au long de la vie, à des neurones aux fonctions particulières : les neurones issus des cellules souches du gyrus denté s’intègrent dans les circuits propres à cette structure [
1] et participent, directement ou indirectement, à la ségrégation spatiale des réseaux neuronaux [
2]. Les cellules souches de la ZSV assurent le renouvellement des interneurones et neurones périglomérulaires du bulbe olfactif dont la fonction principale est d’assurer la mémoire olfactive à long terme [
3,
4]. La ZSV est composée de plusieurs types cellulaires définis selon des critères immunohistologiques et ultrastructuraux. Les cellules souches de cette niche (dites cellules B) expriment la GFAP (glial fibrillary acidic protein) et contactent la lumière du ventricule avec leur cil primaire [
5]. Elles prolifèrent lentement et engendrent les cellules de précurseurs intermédiaires (type C) qui, eux, se divisent rapidement et se différencient ensuite en neuroblastes (cellules de type A). Ces derniers migrent au sein de la voie rostrale de migration (VRM) vers le bulbe olfactif où ils donnent naissance aux neurones granulaires et périglomérulaires [
6]. Alors que la genèse des neurones du bulbe olfactif constitue la fonction primordiale de la ZSV dans le cerveau adulte, des études de traçage cellulaire démontrent que les cellules B sont aussi à l’origine d’une population d’oligodendrocytes dans la substance blanche périventriculaire. La balance entre neurogenèse et oligodendrogenèse dans le cerveau post-natal et adulte serait gouvernée par l’interaction de déterminants neurogéniques tels que les facteurs Dlx2 (distal-less homeobox 2), Pax6 (paired box protein 6), et Olig2 (oligodendrocyte lineage transcription factor) qui régulent la genèse des oligodendrocytes, et dans certains cas, celle des astrocytes [
7,
8]. |
Fonctions potentielles des cellules souches de la ZSV dans la sclérose en plaques Alors que dans le cerveau sain, les cellules souches ont un destin essentiellement neuronal, un certain nombre de travaux démontrent qu’elles ont la possibilité de se différencier vers d’autres types cellulaires (oligodendrocytes et astrocytes) en réponse à différentes situations lésionnelles [
9]. Une telle plasticité pourrait être utile à des tentatives de réparation, mais ses conséquences sur le fonctionnement normal de la niche et sa contribution à des déficits neurologiques demeuraient jusqu’alors inconnues. Au cours de ces dernières années, notre laboratoire s’est intéressé au potentiel de différenciation en oligodendrocytes des cellules de la ZSV dans des situations de démyélinisation. Les lésions de démyélinisation périventriculaires sont fréquentes dans la sclérose en plaques (SEP), une pathologie inflammatoire démyélinisante dont la durée est bien souvent associée à un échec de remyélinisation. La présence d’une niche de cellules souches à proximité de ces lésions pourrait constituer une source cellulaire d’intérêt pour la remyélinisation. En effet, l’induction de lésions de démyélinisation dans la zone périventriculaire augmente la prolifération des cellules de la ZSV et induit leur migration ectopique vers les lésions de démyélinisation où elles se différencient en oligodendrocytes [
10,
11]. En dépit de ces observations expérimentales, la question de l’intégrité de la niche des cellules souches en situation de démyélinisation chronique inflammatoire reste débattue [11,
12], et les conséquences d’une altération de la niche sur le renouvellement des neurones du bulbe olfactif et l’olfaction restaient largement inexplorées. Par ailleurs, la fonction exacte de la ZSV chez l’homme est encore floue [
13,
14]. En particulier, sa contribution à une neurogenèse bulbaire est encore discutée chez l'homme [
15]. Les lésions de démyélinisation périventriculaire sont fréquentes dans la SEP et l’étude de la ZSV à proximité des lésions suggère, comme chez le rongeur, une augmentation de l’oligodendrogenèse et une migration ectopique de précurseurs gliaux vers les lésions [
16,
17]. Mais les conséquences de ces altérations sur la neurogenèse et les déficits olfactifs rencontrés chez les patients atteints de SEP [
18] restaient à démontrer. Ces troubles olfactifs dans la SEP se caractérisent par des déficits de la reconnaissance olfactive n’affectant pas la sensibilité de détection. |
Rôle des cellules souches de la ZSV en situation de démyélinisation Notre hypothèse est qu’une pathologie démyélinisante semblable à la SEP peut conduire à une altération de la neurogenèse dans la ZSV et avoir des conséquences fonctionnelles sur l’olfaction. Nous nous sommes aussi interrogés sur le rôle d’une inflammation démyélinisante comme la SEP dans les modifications de l’oligodendrogenèse dans la ZSV. Pour répondre à ces questions, nous avons développé un modèle animal présentant, de façon très reproductible, des lésions inflammatoires démyélinisantes dans la substance blanche périventriculaire. Alors que l’encéphalomyélite allergique expérimentale (EAE) classique chez la souris mime l’inflammation et certains déficits cliniques de la SEP, les lésions ciblent surtout la moelle épinière, et sont peu fréquentes au niveau cérébral. De plus, les signes cliniques de l’EAE sont généralement considérés comme des indicateurs de l’évolution de la maladie, mais ils conviennent peu à l'évaluation de la pathologie périventriculaire qui souvent débute plus tôt dans la maladie. Ce modèle ne permet donc pas de suivre d’une façon précise les modifications survenant dans la ZSV en réponse à l’inflammation [17]. Afin de contourner cet écueil, nous avons développé un protocole d’EAE ciblée (EAEc) dans le corps calleux de souris C57/Bl6, en nous inspirant d’un modèle développé dans la moelle épinière de rat [
19]. Ce protocole consiste à immuniser des souris de façon subclinique à l’aide du peptide MOG (myelin oligodendrocyte glycoprotein) et d’adjuvant de Freund, puis d’injecter dans le corps calleux un cocktail de cytokines pro-inflammatoires (transforming growth factor-α [TNFα] et interféron-γ [IFNγ]) permettant d’y attirer les cellules inflammatoires. Le déroulement temporel de la pathologie chez les souris atteintes d’EAEc associe successivement : une inflammation de l’encéphale avec des infiltrats inflammatoires dans le corps calleux, une phase de démyélinisation et une atteinte axonale, suivie d’une phase de remyélinisation. Ce modèle présente plusieurs avantages pour l’étude de la ZSV : (1) la présence de lésions inflammatoires périventriculaires chez tous les animaux, suivies d’une démyélinisation dans cette même localisation ; (2) l’injection de cytokines induit sans équivoque la pathologie dans le cerveau de tous les animaux, permettant ainsi une étude séquentielle précise de la dynamique des altérations de la ZSV. Nous avons analysé les modifications cellulaires et structurales de la ZSV par immunohistochimie et microscopie électronique, ainsi que la prolifération et le destin cellulaires par des études d’incorporation de BrdU (bromodéoxyuridine) (Figure 1). Nos résultats démontrent que le nombre de cellules inflammatoires fluctue au cours de la pathologie : il augmente rapidement au début de la maladie (1re semaine) et s’accompagne d’une diminution transitoire de la prolifération dans la ZSV et d’une déplétion des neuroblastes. De plus, le nombre de cellules B (cellules souches) - qui contactent le liquide céphalorachidien des ventricules latéraux avec leur cil unique -, diminue alors que celui des cellules C (précurseurs intermédiaires) demeure inchangé. Après cette phase initiale, la prolifération des cellules de la ZSV conduit à une amplification des cellules B et C, mais ne permet pas de corriger le déficit en neuroblastes chez les animaux atteints d’EAEc comparés aux animaux contrôles. Par ailleurs, les neuroblastes de la ZSV migrent de façon ectopique dans le corps calleux et le striatum. Au cours des phases chroniques tardives, on observe une persistance de cellules inflammatoires, une perte de neuroblastes et une augmentation des cellules de type C. Afin de mieux appréhender les mécanismes à l’origine de la déplétion de neuroblastes dans la ZSV en réponse à l’EAEc, nous avons émis l’hypothèse que les cellules de type C qui, en conditions normales, génèrent principalement des neuroblastes, se différencient préférentiellement en oligodendrocytes dans ce modèle. L’analyse de l’expression de déterminants neurogéniques, tels que Dlx2, et oligodendrogéniques, tels que Olig2, par les cellules de type C a démontré que l’EAEc était associée à une réduction de la fraction Dlx2+ au profit de la population Olig2+, indiquant un changement de leur destin cellulaire au cours de la maladie. De plus, notre étude montre que des modifications de la voie de signalisation BMP (bone morphogenic protein)/pSMAD seraient impliquées dans ce changement de la destinée des cellules de type C, l’expression de pSMAD étant fortement réduite dans la ZSV des animaux atteints d’EAEc.
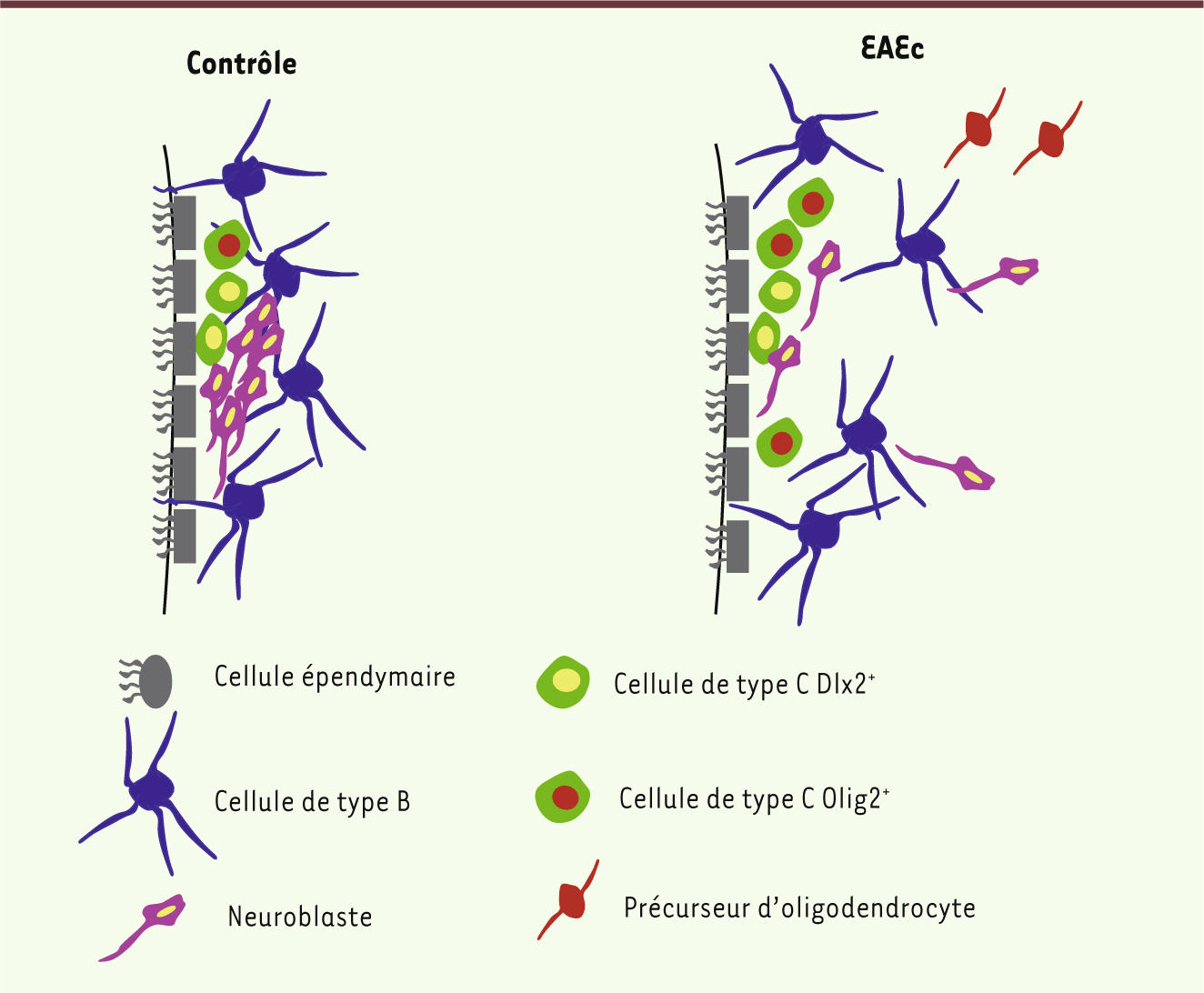
 | Figure 1.
La zone sous-ventriculaire (ZSV) est modifiée au cours de l’EAE ciblée (EAEc). Dans le cerveau sain de souris adultes (contrôle, panneau de gauche), la niche de cellules souches est adjacente à la couche de cellules épendymaires multiciliées (gris). Les cellules souches primaires de la ZSV (cellules B1) sont des astrocytes (en bleu) qui sont en contact avec le ventricule par un cil unique. Les cellules B1 prolifèrent lentement et génèrent les cellules de type C à prolifération rapide (vert). Une sous-population de cellules C exprimant Dlx2 (cellules vertes à noyau jaune) prédomine par rapport à la sous-population de cellules C exprimant Olig2 (cellules vertes à noyau rouge) et donne naissance aux neuroblastes (rouge) qui migrent vers le bulbe olfactif. Dans la ZSV d’EAEc (EAEc, panneau de droite), le nombre de cellules B contactant le ventricule est réduit. La population de cellules C Olig2-positives augmente alors que le nombre de cellules C Dlx2-positives demeure inchangé. Ceci conduit à une augmentation du nombre de cellules oligodendrogliales aux dépens du nombre de neuroblastes migrant vers le bulbe olfactif. De plus, certains neuroblastes migrent de façon ectopique dans le striatum et corpus calleux. |
|
Cellules souches de la ZSV et neurogenèse du bulbe olfactif À la suite de ces données, nous avons exploré les conséquences fonctionnelles des altérations observées dans la ZSV sur la neurogenèse au sein du bulbe olfactif. Des études de suivi cellulaire ont démontré que l’attaque inflammatoire initiale diminue de manière significative le nombre des cellules des grains nouvellement produites dans le bulbe olfactif de souris EAEc, mais augmente le nombre d’oligodendrocytes dérivés de la ZSV dans le corps calleux. L’analyse immunohistochimique de la doublecortine, un marqueur de neurones immatures, montre aussi de façon frappante que pendant la phase chronique de la maladie (trois mois après induction), la neurogenèse bulbaire demeure perturbée. Afin de déterminer si toutes ces altérations de la ZSV pouvaient avoir des conséquences fonctionnelles sur l’olfaction, nous avons analysé la discrimination olfactive et la mémoire olfactive à court (30 min) et long terme (40 jours) chez les animaux atteints d’EAEc. Deux tests distincts de discrimination d’odeurs n’ont pas permis d’établir l’altération de ces paramètres chez les souris EAEc, même au cours de la phase chronique de la maladie. Quant à la mémoire olfactive, à court terme elle n’est pas affectée, mais à long terme elle est clairement affectée, corroborant d’autres observations indiquant que la mémoire olfactive à long terme est la fonction principale de la neurogenèse adulte [3, 4]. Pour examiner la validité expérimentale de nos résultats dans la pathologie humaine, nous avons recherché une altération de la neurogenèse dans la ZSV de patients atteints de SEP (Figure 2). L’analyse immunohistochimique de la doublecortine indique la présence de neurones immatures dans les ZSV de cerveaux de patients SEP et de sujets contrôles. Cependant, le nombre de neuroblastes est significativement réduit dans la ZSV de patients SEP comparé au nombre dans la ZSV de sujets non atteints. Nos études précédentes indiquaient une augmentation de progéniteurs gliaux dans cette même région [16]. Cela suggère que, comme dans le modèle d’EAEc chez la souris, l’inflammation démyélinisante proche de la ZSV induit chez l’homme un déséquilibre de la balance neurogenèse/gliogenèse dans la ZSV, avec un enrichissement en précurseurs gliaux au détriment de la genèse de nouveaux neurones.
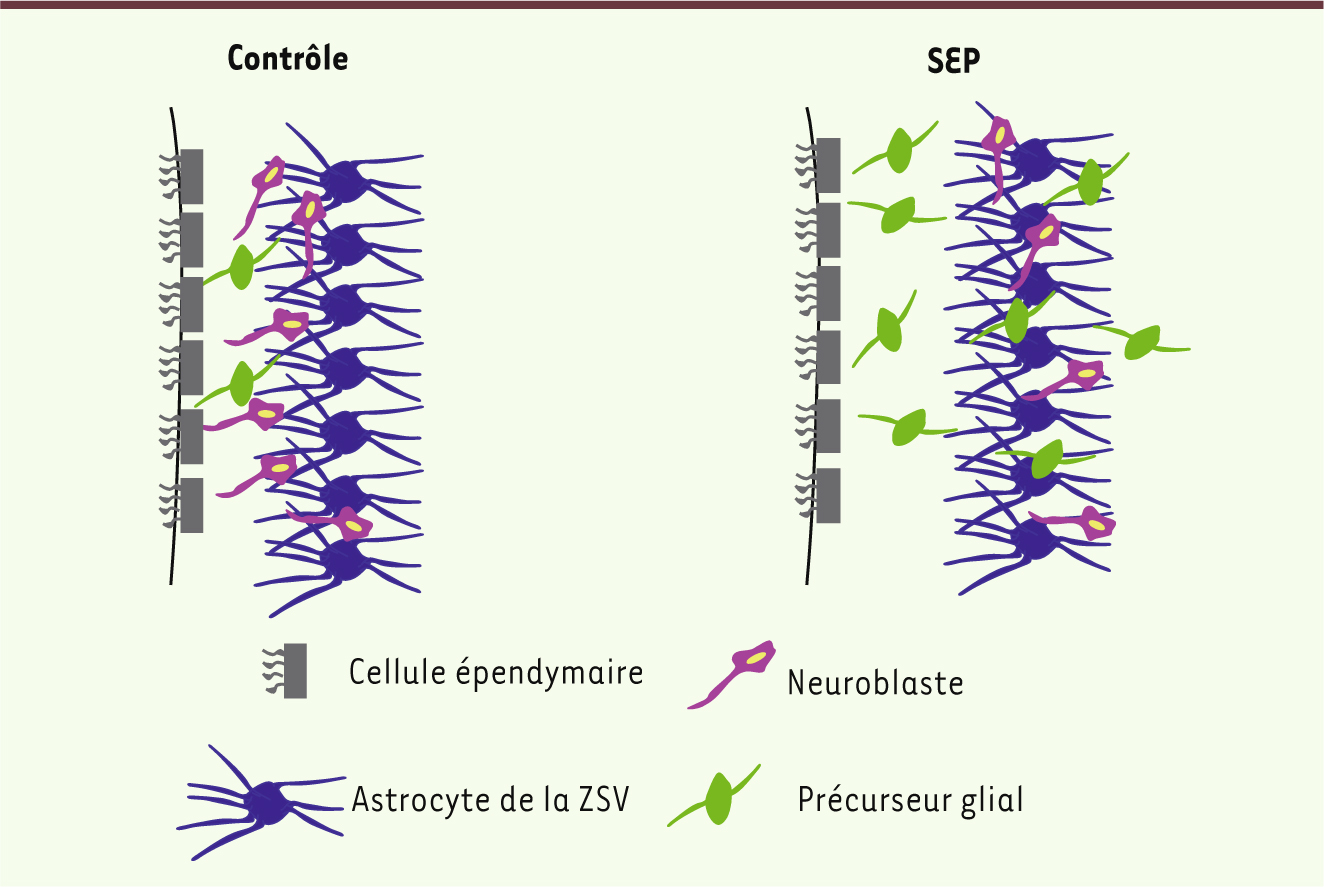
 | Figure 2.
La ZSV change également chez les patients atteints de SEP. Une des différences majeures entre l’architecture de la ZSV humaine et celle de souris est la présence de régions cellulaires bien définies. Il s’agit de la couche de cellules épendymaires (gris), une zone hypocellulaire (entre l’épendyme [gris] et les astrocytes [bleus]), le ruban astrocytaire (bleu), et la zone de transition adjacente au parenchyme. Chez les contrôles sans pathologies neurologiques, les neuroblastes (rouge) et quelques progéniteurs gliaux (vert) sont localisés dans la zone hypocellulaire et, plus rarement, dans le ruban astrocytaire. Dans la ZSV de cerveau SEP, le nombre de cellules dans la zone hypocellulaire augmente et comprend principalement des progéniteurs gliaux précoces, alors que le nombre de neuroblastes diminue. De plus, les neuroblastes et progéniteurs gliaux précoces se situent principalement dans et au-delà du ruban astrocytaire, ce qui suggère leur migration ectopique dans le parenchyme. |
En conclusion, le modèle d’EAE ciblée dans la substance blanche périventriculaire chez la souris nous a permis d’établir plusieurs conclusions concernant la fonction de la ZSV.
-
L’effet majeur d’une inflammation démyélinisante de type SEP est l’altération de la neurogenèse adulte qui conduit à une déplétion à long terme de la genèse des cellules des grains.
-
Néanmoins, la genèse des oligodendrocytes en réponse à la démyélinisation périventriculaire n’est pas affectée par l’inflammation démyélinisante.
-
L’altération de la neurogenèse au profit de l’oligodendrogenèse se produit principalement dans les cellules de type C, et semble impliquer la voie de signalisation BMP.
-
Ces événements conduisent à des altérations de mémoire olfactive à long terme chez la souris mimant ainsi les déficits olfactifs observés chez les patients atteints de SEP.
Notre travail apporte une explication alternative aux déficits olfactifs observés chez les patients atteints de SEP, attribués jusqu’à présent aux lésions inflammatoires dans les régions fronto/temporales [18,
20]. Bien que d’autres éléments expérimentaux soient nécessaires pour valider cette hypothèse, nos résultats alimentent l’idée grandissante que le dysfonctionnement des cellules souches neurales adultes contribue à la pathogenèse cérébrale. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a été réalisé avec le soutien de l’Inserm, les Fondations ELA, ENP (École des neurosciences de Paris), et ARSEP (Aide à la recherche sur la SEP). V. Tepavčević a reçu le soutien de l’UPMC et de la FRM (Fondation pour la recherche médicale), B. Nait-Oumesmar et A. Baron-Van Evercooren sont récipiendaires de contrats d’interface AP-HP (Fédération de neurologie, Hôpital Pitié-Salpêtrière, Paris).
|
1.
Toni
N
,
Laplagne
DA
,
Zhao
C
, et al.
Neurons born in the adult dentate gyrus form functional synapses with target cells . Nat Neurosci.
2008; ; 11 : :901.–907. 2.
Clelland
CD
,
Choi
M
,
Romberg
C
, et al.
A functional role for adult hippocampal neurogenesis in spatial pattern separation . Science.
2009; ; 325 : :210.–213. 3.
Lazarini
F
,
Mouthon
M
,
Gheusi
G
, et al.
Cellular, behavioral effects of cranial irradiation of the subventricular zone in adult mice . PLoS One.
2009; ; 4 : :e7017.. 4.
Sultan
S
,
Mandairon
N
,
Kermen
F
, et al.
Learning-dependent neurogenesis in the olfactory bulb determines long-term olfactory memory . FASEB J.
2010; ; 24 : :2355.–2363. 5.
Doetsch
F
,
Caillé
I
,
Lim
D
, et al.
Subventricular zone astrocytes are neural stem cells in the adult mammalian brain . Cell.
1999; ; 97 : :703.–716. 6.
Carleton
A
,
Petreanu
L
,
Lansford
R
, et al.
Becoming a new neuron in the adult olfactory bulb . Nat Neurosci.
2003; ; 6 : :507.–518. 7.
Hack
M
,
Saghatelyan
A
,
de Chevigny
A
, et al.
Neuronal fate determinants of adult olfactory bulb neurogenesis . Nat Neurosci.
2005; ; 8 : :865.–872. 8.
Marshall
C
,
Novitch
B
,
Goldman
J.
Olig2 directs astrocyte and oligodendrocyte formation in postnatal subventricular zone cells . J Neurosci.
2005; ; 25 : :7289.–7298. 9.
Kazanis
I.
The subependymal zone neurogenic niche: a beating heart in the centre of the brain: how plastic is adult neurogenesis? Opportunities for therapy and questions to be addressed . Brain.
2009; ; 132 : :2909.–2921. 10.
Nait-Oumesmar
B
,
Decker
L
,
Lachapelle
F
, et al.
Progenitor cells of the adult mouse subventricular zone proliferate, migrate and differentiate into oligodendrocytes after demyelination . Eur J Neurosci.
1999; ; 11 : :4357.–4366. 11.
Picard-Riera
N
,
Decker
L
,
Delarasse
C
, et al.
Experimental autoimmune encephalomyelitis mobilizes neural progenitors from the subventricular zone to undergo oligodendrogenesis in adult mice . Proc Natl Acad Sci USA.
2002; ; 99 : :13211.–13216. 12.
Pluchino
S
,
Muzio
L
,
Imitola
J
, et al.
Persistent inflammation alters the function of the endogenous brain stem cell compartment . Brain.
2008; ; 131 : :2564.–2578. 13.
Curtis
M
,
Kam
M
,
Nannmark
U
, et al.
Human neuroblasts migrate to the olfactory bulb via a lateral ventricular extension . Science.
2007; ; 315 : :1243.–1249. 14.
Sanai
N
,
Tramontin
A
,
Quiñones-Hinojosa
A
, et al.
Unique astrocyte ribbon in adult human brain contains neural stem cells but lacks chain migration . Nature.
2004; ; 427 : :740.–744. 15.
Bédard
A
,
Parent
A.
Evidence of newly generated neurons in the human olfactory bulb . Res Dev Brain Res.
2004; ; 151 : :159.–168. 16.
Nait-Oumesmar
B
,
Picard-Riera
N
,
Kerninon
C
, et al.
Activation of the subventricular zone in multiple sclerosis: evidence for early glial progenitors . Proc Natl Acad Sci USA.
2007; ; 104 : :4694.–4699. 17.
Wu
C
,
Chang
A
,
Smith
M
, et al.
Beta4 tubulin identifies a primitive cell source for oligodendrocytes in the mammalian brain . J Neurosci.
2009; ; 29 : :7649.–7657. 18.
Demarquay
G
,
Ryvlin
P
,
Royet
J.
Olfaction and neurological diseases: a review of the literature . Rev Neurol (Paris).
2007; ; 163 : :155.–167. 19.
Kerschensteiner
M
,
Stadelmann
C
,
Buddeberg
B
, et al.
Targeting experimental autoimmune encephalomyelitis lesions to a predetermined axonal tract system allows for refined behavioral testing in an animal model of multiple sclerosis . Am J Pathol.
2004; ; 164 : :1455.–1469. 20.
Doty
R
,
Li
C
,
Mannon
L
,
Yousem
D.
Olfactory dysfunction in multiple sclerosis. Relation to plaque load in inferior frontal and temporal lobes . Ann NY Acad Sci.
1998; ; 855 : :781.–786. |