| |
| Med Sci (Paris). 2012 June; 28(6-7): 646–651. Published online 2012 July 16. doi: 10.1051/medsci/2012286019.Actualité sur les lymphocytes T régulateurs CD4 +
Aurélie Siri,1*# Hubert de Boysson,1# and Guilaine Boursier1 1Master Immunotechnologies et biothérapies, université Pierre et Marie Curie - Paris 6 (PRES Sorbonne Universités), 4, place Jussieu, 75005Paris, France |
Le système immunitaire peut discriminer une grande variété d’antigènes du soi et du non-soi. Des mécanismes de contrôle sont nécessaires afin de moduler l’activité des cellules effectrices et éviter le déclenchement d’une réaction immunitaire inadaptée contre les antigènes du soi. L’existence d’un système de régulation a été suggérée dès les années 1970 [
1], mais il faut attendre les années 1990 pour que soit identifiée une population de lymphocytes T (LT) CD4+ dits régulateurs (Treg), capables de moduler l’activité d’une grande diversité de cellules des systèmes immunitaires inné et adaptatif. Les travaux de ces 15 dernières années ont permis d’isoler plusieurs populations de Treg, qui se distinguent par leur origine, leurs marqueurs de surface et leurs fonctions. Les Treg les mieux connus et les plus étudiés sont les lymphocytes T naturels CD4+CD25+FOXP3+ d’origine thymique. Leur implication dans de nombreux contextes physiologiques ou pathologiques a été clairement établie. Par ailleurs, on peut également citer les lymphocytes Tr1 producteurs d’interleukine (IL)-10 et les T helper de type 3 (Th3) producteurs de TGF-β (transforming growth factor-b), également classés parmi les Treg. Il apparaît que les Treg jouent un rôle central dans les maladies auto-immunes, l’allergie, les infections chroniques, la croissance tumorale et la transplantation [
2]. |
L’existence des Treg a été suggérée en observant le rôle central du thymus dans le développement d’une population de lymphocytes T régulatrice [
3,
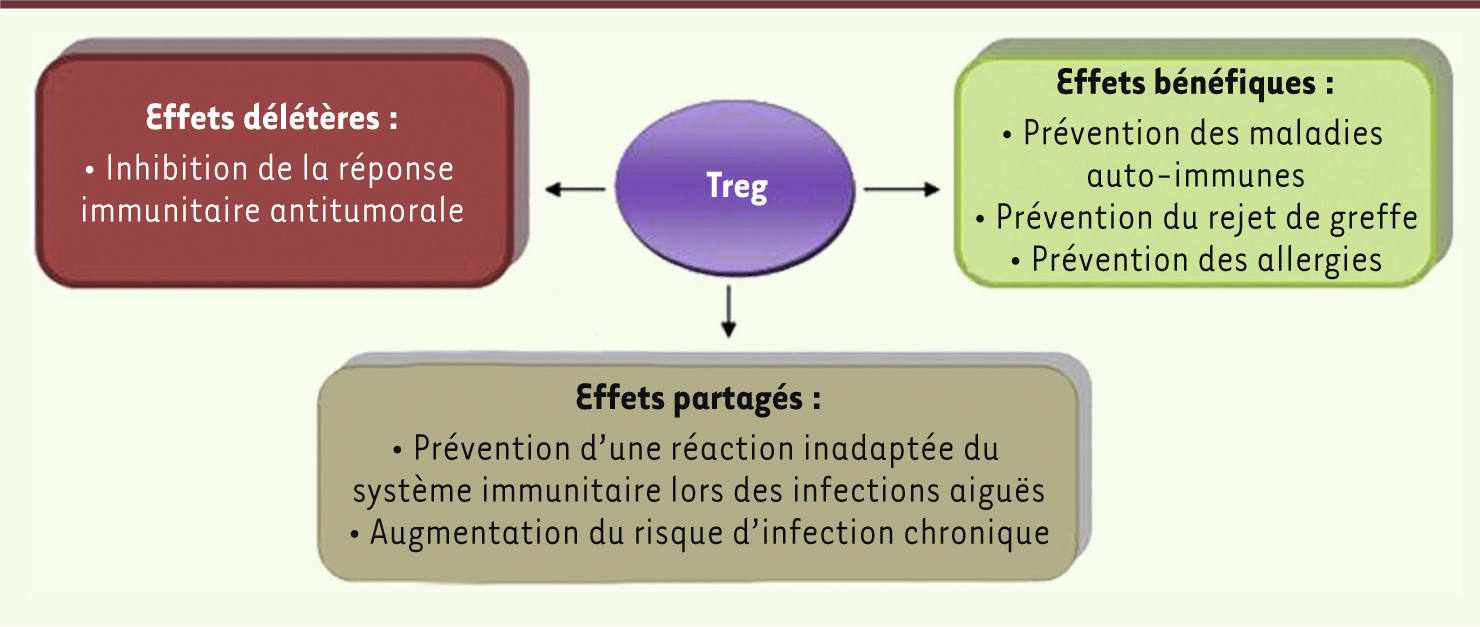
4]. Les progéniteurs immatures, ancêtres des lymphocytes T et issus de la moelle osseuse, migrent dans le thymus où ils se différencient. À la fin de cette différenciation T, les cellules les plus autoréactives sont éliminées. Certaines peuvent échapper à cette sélection et coloniser la périphérie. Différents mécanismes de tolérance périphérique vont alors participer à la prévention des maladies auto-immunes et les Treg jouent un rôle majeur dans ces mécanismes. Les Treg ne sont pas une population homogène et unique. Il est admis que les Treg issus du thymus sont dits naturels (nTreg) et dépendent de l’interleukine-2 pour leur survie. De nombreuses expériences ont montré que des lymphocytes T aux fonctions régulatrices pouvaient également être induits (iTreg) en périphérie à partir de lymphocytes T conventionnels naïfs. L’environnement cytokinique (IL-10 et TGF-β en particulier) est essentiel à la production et à l’induction de ces Treg induits (Figure 1).
 | Figure 1.
Les lymphocytes T régulateurs, une population aux multiples facettes.
|
|
Caractéristiques des Treg naturels (nTreg) Au fil des années, plusieurs marqueurs plus ou moins spécifiques des Treg ont été caractérisés. Historiquement, ces lymphocytes ont d’abord été identifiés par le phénotype peu spécifique CD5fort (en 1985) ou CD45RCfaible (en 1990). En 1995, S. Sakaguchi et al. [
5] ont permis un progrès décisif en identifiant à leur surface le marqueur CD25 (chaîne α du récepteur de l’IL-2), marqueur plus spécifique encore utilisé aujourd’hui. En effet, les résultats montrent que la déplétion, chez la souris, des cellules CD4+CD25+ conduit au développement de maladies auto-immunes, suggérant que les cellules CD25+ régulent la réponse inflammatoire et que l’IL-2 est indispensable au maintien de ces cellules [1, 5]. Ce marqueur fut le seul utilisé pendant près de 10 ans pour reconnaître les Treg. Son inconvénient majeur est d’être également exprimé à la surface des lymphocytes T effecteurs (Teff) activés, quoique généralement à des niveaux plus faibles que sur les Treg. Ainsi, le phénotype CD25fort est retenu pour isoler les Treg, mais un marquage plus spécifique devenait nécessaire. En 2003, plusieurs équipes montrent que le facteur de transcription FOXP3 (forkhead box p3) est exprimé par les Treg [
6]. Le gène FOXP3 est essentiel au développement des Treg comme en témoigne la survenue chez l’homme du syndrome IPEX1, un tableau auto-immun survenant lorsque ce facteur est muté. De fait, FOXP3 joue un rôle central dans la différenciation et le maintien des Treg. Il est admis que les nTreg sont de phénotype CD4+CD25+FOXP3+. Chez la souris, ce marquage est spécifique des Treg. Cependant, chez l’homme, il a été montré récemment que les Teff peuvent exprimer faiblement et transitoirement FOXP3 lors de leur activation [
7]. Afin d’optimiser l’identification des nTreg, de nombreux autres marqueurs peuvent être utilisés en combinaison avec CD25 et/ou FOXP3. Le CD127 (chaîne α du récepteur de l’IL-7) par exemple n’est pas ou peu exprimé par les Treg [
8]. De même, l’expression de CD45RA permet de différencier les Treg au repos (CD45RA+FOXP3faible) ou activés (CD45RA- FOXP3fort) de Teff exprimant faiblement FOXP3 (CD45RA-) [2,
9]. Les Treg CD4+FOXP3+ présentent certains des marqueurs de LT activés : ils expriment plus fortement à leur surface des marqueurs d’activation tels que CD5, CD25, CD44, CD103, CTLA-4 ou le GITR (glucocorticoid-induced tumor necrosis factor [TNF] receptor). Les nTreg présentent aussi des marqueurs absents de la surface des Teff tel que GARP (glycoprotein A repetitions predominant) [
10]. |
Rôle physiopathologique des Treg Treg et maladies auto-immunes L’absence de Treg entraîne, chez l’animal comme chez l’homme, un syndrome auto-immun témoignant du rôle central des Treg dans la prévention d’une autoréactivité pathogène [
11,
12]. L’auto-immunité peut donc être définie comme une rupture de tolérance au soi, dont l’origine est probablement multifactorielle (génétique, infectieuse, environnementale). Chez l’homme, de nombreuses maladies auto-immunes seraient associées à un déficit quantitatif ou qualitatif des Treg [
13]. Le nombre de Treg est un facteur essentiel au maintien de l’homéostasie, et une quantité inadaptée de ces cellules peut faire pencher la balance en faveur des Teff autoréactifs. De manière intéressante, une augmentation de Treg a été observée dans les tissus cibles de patients atteints de sclérose en plaques, de polyarthrite rhumatoïde ou de psoriasis, suggérant que le défaut de régulation dans les tissus inflammatoires serait lié à un déficit fonctionnel des Treg. L’activité et la fonctionnalité des Treg sont difficiles à évaluer et reposent le plus souvent sur des expériences de cocultures in vitro de Treg et de Teff. La fonction des Treg est analysée par l’inhibition de la prolifération des Teff et par la production de cytokines anti-inflammatoires, telles que l’IL-10 et le TGF-β. Ces déficits fonctionnels des Treg sont encore mal compris et relèvent probablement de facteurs intrinsèques (contacts cellulaires insuffisants, défauts de transduction du signal ou des mécanismes de suppression), mais également extrinsèques (balance inadaptée entre cytokines pro- et anti-inflammatoires, résistance des Teff à l’action des Treg) [ 13]. La connaissance de ces mécanismes pourrait permettre de développer de nouvelles approches thérapeutiques visant à restaurer le phénomène de tolérance. Treg et cancer L’immunologie appliquée à la cancérologie a bénéficié ces dernières années de progrès significatifs. La mise en évidence d’antigènes associés aux tumeurs pourrait ouvrir la voie à de nouvelles approches thérapeutiques visant à induire ou à majorer la réponse immunitaire contre les cellules tumorales. Des travaux récents ont confirmé que certains Treg reconnaissent spécifiquement les antigènes associés aux tumeurs et peuvent supprimer la réponse immune dirigée contre les cellules tumorales. De même, un nombre anormalement élevé de Treg a été detecté dans le sang, les tumeurs et les ganglions drainants de patients atteints de mélanome, de lymphome de Hodgkin et de différents carcinomes. Cette observation est corrélée à un mauvais pronostic. Il a été montré que ces Treg sont de phénotype mémoire et inhibent très tôt la réponse immune antitumorale [
14]. L’implication néfaste des Treg a également été évoquée dans plusieurs modèles animaux chez lesquels la déplétion des cellules CD25 fort permet d’obtenir une régression tumorale. De même, l’injection d’une suspension de cellules CD4 + dont on a éliminé les Treg pourrait entraîner une réponse antitumorale efficace [
15,
16]. Ces découvertes permettent d’envisager aujourd’hui de nouveaux traitements plus spécifiques ayant pour but de stimuler une réponse effectrice aux dépens de la réponse régulatrice. Cette démarche est actuellement testée dans plusieurs protocoles cliniques en cours d’essais. Dans la transplantation d’organe La transplantation d’organe a également bénéficié des progrès de l’immunologie. Le contrôle du rejet reste la principale priorité et repose pour le moment surtout sur l’utilisation d’immunosuppresseurs qui minimisent la réaction des Teff allogéniques dirigée contre les antigènes du greffon. Toutefois, ces traitements occasionnent d’importants effets indésirables et n’empêchent que partiellement le rejet chronique, qui représente toujours la principale cause d’échec de greffe. Dans plusieurs modèles animaux, la déplétion des Treg entraîne une perte rapide du greffon, tandis que leur transfert adoptif permet une survie prolongée de la greffe. Chez l’homme, un nombre important de Treg a été trouvé dans des biopsies ou dans les urines de patients faisant un rejet aigu de greffe de cœur et de rein respectivement. Ces observations suggèrent que les Treg agissent en réponse à l’activité des Teff responsables du rejet. Par ailleurs, d’autres travaux rapportent un taux de Treg significativement bas dans le sang de patients ayant un rejet chronique de greffe de foie. Ainsi, le résultat de la greffe (tolérance ou rejet) dépend probablement de la balance entre Teff allogéniques et Treg [
17]. Treg et maladie du greffon contre l’hôte Le rôle des Treg a également été caractérisé dans la maladie du greffon contre l’hôte (GVHD), complication redoutable des greffes de cellules souches hématopoïétiques [
18]. Lors de cette complication, les Teff compétents du donneur déclenchent une réponse immunitaire contre les antigènes du receveur. Cette réaction peut être prévenue par le transfert de Treg. À ce titre, des stratégies d’induction ou de thérapies cellulaires semblent aujourd’hui prometteuses [ 18]. Treg et infections chroniques Dans des modèles animaux d’infections par Candida, Pneumocystis, Leishmania ou Listeria, il semble que le nombre de Treg soit augmenté dans le sang et les organes infectés. Chez l’homme, certaines infections virales (virus de l’hépatite C et de l’immunodéficience humaine notamment) s’accompagnent d’une expansion dérégulée du compartiment des Treg ainsi que d’une augmentation des cytokines anti-inflammatoires [
19]. Ainsi, les Treg semblent contrôler la balance entre une réponse anti-infectieuse efficace et une réaction inflammatoire délétère. En effet, dans les infections chroniques, la stimulation continue du système immunitaire aboutirait, en l’absence de régulation, à une expansion disproportionnée des Teff spécifiques du pathogène. Toutefois, l’origine de l’augmentation des Treg dans ces infections reste encore controversée, même si quelques études suggèrent que certains pathogènes favoriseraient l’expansion des Treg pour échapper au système immunitaire [ 19]. Treg et allergie L’allergie résulte principalement de l’action des Teff Th2, ce qui explique l’augmentation des IgE. Il a été montré que ces phénomènes étaient corrélés à une diminution fonctionnelle des Treg, expliquant le déséquilibre en faveur d’une réponse pro-inflammatoire. Plusieurs modèles ont déjà montré que la restauration de l’équilibre entre Teff et Treg permettait de diminuer le phénomène d’allergie [ 2,
20]. |
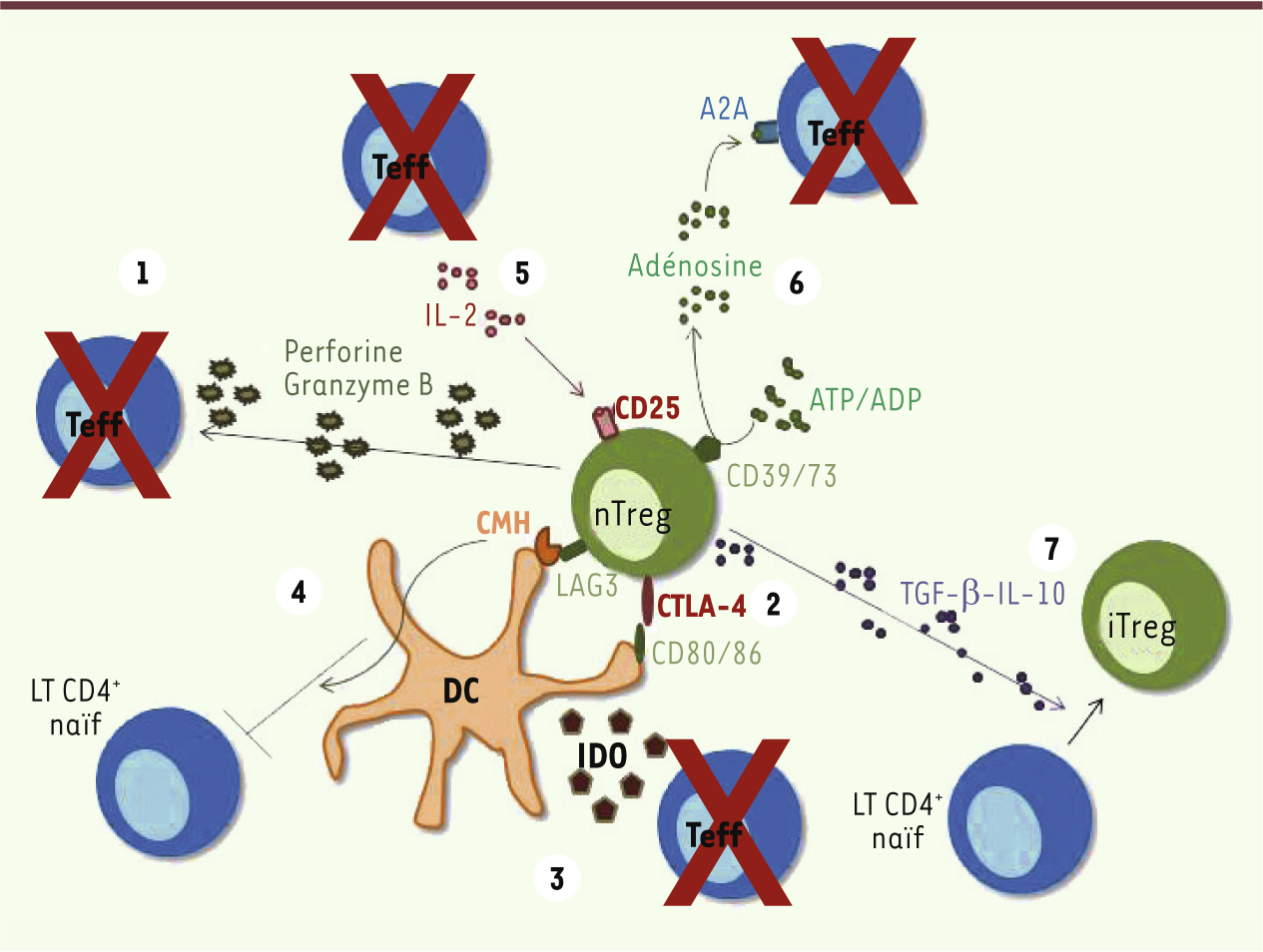
Mécanismes des fonctions suppressives des nTreg Les nTreg naïfs qui ont quitté le thymus vont coloniser les tissus lymphoïdes et certains tissus non lymphoïdes (graisse, peau, foie). Ils peuvent exercer leur fonction suppressive dans ces deux types de tissus. Ils représentent environ 10 % des lymphocytes T CD4 périphériques [7]. Lors de la rencontre avec un antigène, les nTreg s’activent et expriment des récepteurs de chimiokines et des molécules d’adhésion leur permettant de quitter le ganglion et de migrer vers les tissus inflammatoires où ils exercent leurs fonctions suppressives. Il existe de nombreux mécanismes suppresseurs (Figure 2), et nous allons décrire les principaux.
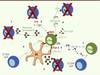 | Figure 2.
Mécanisme des fonctions suppressives des nTreg. (1) Lyse des Teff via une production de granzyme et de perforine ; (2) liaison du CTLA-4 avec CD80/86 induisant une diminution des capacités activatrices de la cellule dendritique (DC) (diminution de la présentation antigénique, production de cytokines anti-inflammatoires, production d’IDO) ; (3) métabolite toxique pour les Teff ; (4) compétition dans la liaison au CMH II entre Treg et Teff (liaison de LAG3 au CMH II, plus stable que la liaison du TCR au CMH II) ; (5) capture de l’IL-2 via le CD25 permettant de limiter l’expansion et la survie des Teff ; (6) production d’adénosine via la dégradation de l’ATP/ADP par le CD39/73 permettant d’inhiber les Teff ; (7) induction de iTreg via la production de TGF-β. |
Production de cytokines ou métabolites toxiques L’IL-10 et le TGF-β sont des cytokines essentielles aux nTreg pour l’exercice de leurs fonctions suppressives. Outre son activité suppressive, le TGF-β est important pour le développement des iTreg (voir plus loin). Chez la souris, l’IL-35 semble également jouer un rôle suppresseur. Il s’agit d’une protéine hétérodimérique composée de la chaîne p35 de l’IL-12 et d’Ebi3 (Epstein-Barr virus induced gene 3). Son expression par les nTreg est sous le contrôle de Foxp3 [
21]. Les nTreg déficients en p35 ou Ebi3 ont des capacités suppressives réduites in vitro et sont incapables de contrôler les pathologies inflammatoires de l’intestin. L’HO-1 (heme oxygenase-1) produite par les nTreg permet de catalyser la formation de monoxyde de carbone à partir d’hème. Ceci permet de limiter la production d’IL-2, une cytokine indispensable à la prolifération des lymphocytes T [
22]. De façon similaire, le CD39 et le CD73 (deux ectoenzymes qui catalysent la formation d’adénosine) exprimés à la surface des nTreg permettent la production d’adénosine à partir d’ATP et d’ADP extracellulaires [
23]. L’adénosine est capable d’inhiber les Teff par l’intermédiaire du récepteur A2A de ces derniers. Interaction des nTreg avec les Teff
In vitro, il a été démontré que les nTreg sont capables de bloquer la prolifération des Teff en l’absence de cellules présentatrices d’antigène, confirmant un effet direct des nTreg sur les Teff, entre autres grâce à l’AMPc [
24,
25]. Les nTreg sont également capables de lyser directement les Teff en libérant du granzyme B et de la perforine [
26]. D’autres travaux ont également montré que l’interaction nTreg/Teff permet d’induire l’apoptose via le facteur proapoptotique Bim exprimé par les Teff. De fait, les Teff déficients en Bim sont capables de résister à la suppression exercée par les nTreg. Enfin, les Treg activés expriment fortement le CD25, récepteur à l’IL-2 de haute affinité. Les Treg peuvent capturer l’IL-2 présente dans le milieu et, par compétition, en priver les Teff. De plus, l’IL-2 est utilisée par les Treg pour favoriser leur survie [
27]. En pathologie humaine, les déficits en CD25 entraînent des syndromes inflammatoires lymphoprolifératifs associés à des atteintes auto-immunes, indiscernables du syndrome IPEX. Interaction des nTreg avec les cellules présentatrices d’antigène L’interaction des nTreg avec les cellules présentatrices d’antigène induit de profondes modifications altérant la capacité de ces dernières à activer les lymphocytes T CD4 + naïfs. Différents mécanismes, comme le blocage de la présentation antigénique et de la maturation des cellules dendritiques, concourent à cet effet. Les nTreg induisent également la production de facteurs suppresseurs par les cellules dendritiques comme l’IDO (indoléamine 2,3-dioxygénase) après l’interaction du CD80/86 avec le récepteur inhibiteur CTLA-4 (cytotoxic T-lymphocyte antigen 4). L’IDO entraîne le catabolisme du tryptophane en un métabolite toxique pour les Teff. |
Caractéristiques des Treg induits (iTreg) Les iTreg se différencient en cellules suppressives à la périphérie. Cette différenciation se fait à partir de lymphocytes T CD4+ naïfs et dépend du milieu cytokinique, de l’activation antigénique et de la coexistence d’autres cellules. Les iTreg ne sont pas homogènes et sont difficiles à caractériser in vivo en raison de l’absence de marqueurs spécifiques. Deux populations semblent toutefois mieux caractérisées : les iTreg Foxp3+ et les Tr1. Les iTreg Foxp3+
In vitro, la culture de lymphocytes T CD4 + naïfs avec du TGF-β permet d’induire des lymphocytes T aux fonctions suppressives et au phénotype proche des nTreg. En effet, ces iTreg sont de phénotype CD25 +FOXP3 +. In vivo, ces iTreg seraient abondants dans l’intestin. Il semble que dans ce tissu, l’action conjointe du TGF-β, des cellules dendritiques CD103 + et de l’acide rétinoïque permet d’induire des iTreg essentiels au maintien de la tolérance, notamment vis-à-vis des antigènes alimentaires et de la flore commensale du tube digestif. Parmi ces iTreg, soulignons l’existence des Th3, une population régulatrice produisant de grandes quantités de TGF-β et particulièrement importante pour les tissus en contact avec l’environnement (en particulier les muqueuses respiratoires et digestives). Les Tr1 Cette population a été découverte en 1997 lors de la stimulation de lymphocytes T CD4 + naïfs par l’antigène ovalbumine en présence d’IL-10. Son profil cytokinique est défini, après activation, comme étant IL-10 fort, TGF-β fort, IL-5 fort, IFN-³ faible, IL-2 faible et IL-4 -. Cependant, selon leur mode d’induction, il peut exister quelques variations. De manière consensuelle, il est admis que cette population produit de l’IL-10 et ne produit pas d’IL-4, ce qui la distingue des Th2 [
28]. L’IL-10 est une cytokine anti-inflammatoire particulièrement importante dans les mécanismes de tolérance au niveau des tissus d’interface avec l’environnement. En effet, il a été montré in vivo que les souris déficientes en IL-10 développent spontanément un tableau de colite, réversible avec l’administration de Tr1. Les Tr1 ont la particularité de migrer aux sites inflammatoires sans activation antigénique préalable. Les Tr1 activés produisent de l’IL-10 et expriment différents marqueurs - CD40L, CD69, CD28, CTLA-4 et HLA-DR - communs aux nTreg. L’IL-10 est la cytokine clé grâce à laquelle les Tr1 exercent leurs fonctions suppressives par un effet indirect dit bystander, in vitro et in vivo (Figure 3). D’autres mécanismes comme la production de TGF-β, ainsi que certains signaux issus de contacts cellulaires passant par le CTLA-4, le TGF-β membranaire, le GITR et le PD-1 ( programmed death receptor-1) participent aux fonctions suppressives des Tr1 dans certaines conditions [
29,
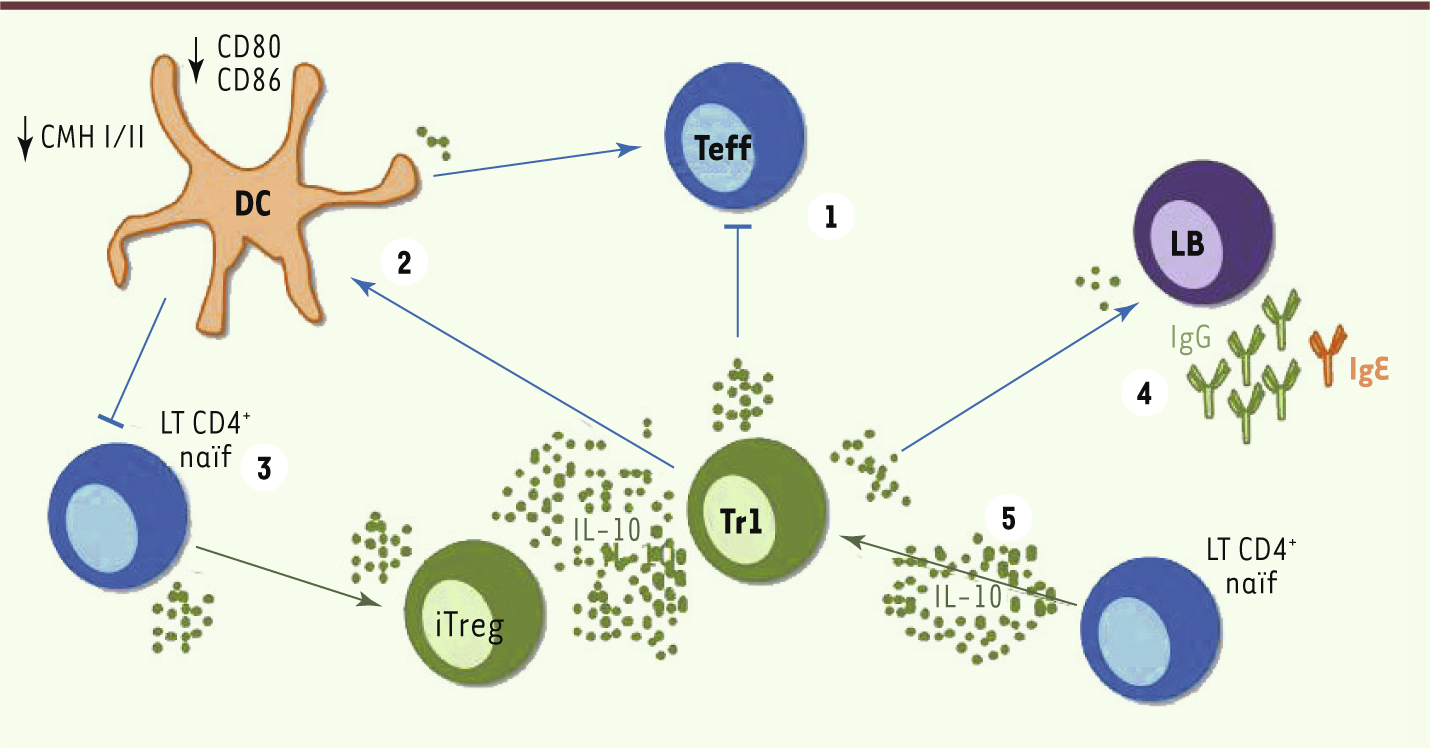
30]. L’IL-10 inhibe la production de chimiokines, molécules influençant la migration des LT, et des cytokines proinflammatoires par les cellules présentatrices d’antigènes. Elle entraîne une diminution de l’expression du complexe majeur d’histocompatibilité (CMH) de classe I et II et des molécules de costimulation comme le CD80/CD86 et le CD58 sur les cellules dendritiques. Ces différents mécanismes permettent de stopper l’activation des Teff naïfs, d’induire une anergie des Teff activés et d’activer ou d’induire d’autres Treg.
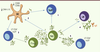 | Figure 3.
Effets suppresseurs de l’IL-10. (1) Inhibition des Teff ; (2) diminution de l’expression du CMH I/II et du CD80/86 sur les cellules dendritiques ; (3) induction de iTreg à partir de lymphocytes T naïfs ; (4) orientation de la commutation de classe des lymphocytes B (LB) vers une production d’IgG4 plutôt que d’IgE ; (5) différenciation de lymphocytes T naïfs en Tr1. |
|
Depuis leur redécouverte en 1995, les Treg ont fait l’objet de milliers de publications. La découverte de leur implication dans de nombreux processus physiologiques et pathologiques, l’identification de certains marqueurs et la compréhension de leurs mécanismes de suppression, permettent d’entrevoir aujourd’hui leur potentiel thérapeutique. Leur utilité thérapeutique est déjà en cours d’évaluation dans différentes pathologies comme les hémopathies malignes ou, de façon plus récente, dans les maladies auto-immunes. Les résultats sont prometteurs, mais différents obstacles restent à franchir avant une utilisation thérapeutique en routine. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Les auteurs remercient Benoit Salomon pour ses conseils avisés lors de la rédaction de ce manuscrit, ainsi que Leslie Gosse (de la promotion ITB 2010-2011) et son équipe enseignante pour leur soutien et leur aide.
|
1.
Chatenoud
L
,
Salomon
B
,
Bluestone
JA
. Suppressor T cells: they’re back and critical for regulation of autoimmunity!
Immunol Rev.
2001; ; 182 : :149.–163. 2.
Sakaguchi
S
,
Miyara
M
,
Costantino
CM
,
Hafler
DA
. FOXP3+ regulatory T cells in the human immune system . Nat Rev Immunol.
2010; ; 10 : :490.–500. 3.
Aschenbrenner
K
,
D’Cruz
LM
,
Vollmann
EH
, et al.
Selection of Foxp3+ regulatory T cells specific for self antigen expressed and presented by Aire+ medullary thymic epithelial cells . Nat Immunol.
2007; ; 8 : :351.–358. 4.
Asano
M
,
Toda
M
,
Sakaguchi
N
,
Sakaguchi
S
. Autoimmune disease as a consequence of developmental abnormality of a T cell subpopulation . J Exp Med.
1996; ; 184 : :387.–396. 5.
Sakaguchi S, Sakaguchi
N
,
Asano
M
, et al.
Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alpha-chains (CD25). Breakdown of a single mechanism of self-tolerance causes various autoimmune diseases . J Immunol.
1995; ; 155 : :1151.–1164. 6.
Hori
S
,
Nomura
T
,
Sakaguchi
S
. Control of regulatory T cell development by the transcription factor Foxp3 . Science.
2003; ; 299 : :1057.–1061. 7.
Campbell
DJ
,
Koch
MA
. Phenotypical and functional specialization of FOXP3+ regulatory T cells . Nat Rev Immunol.
2011; ; 11 : :119.–130. 8.
Liu
W
,
Putnam
AL
,
Xu-Yu
Z
, et al.
CD127 expression inversely correlates with FoxP3 and suppressive function of human CD4+ T reg cells . J Exp Med.
2006; ; 203 : :1701.–1711. 9.
Miyara
M
,
Yoshioka
Y
,
Kitoh
A
, et al.
Functional delineation and differentiation dynamics of human CD4+ T cells expressing the FoxP3 transcription factor . Immunity.
2009; ; 30 : :899.–911. 10.
Tran
DQ
,
Andersson
J
,
Wang
R
, et al.
GARP (LRRC32) is essential for the surface expression of latent TGF-beta on platelets and activated FOXP3+ regulatory T cells . Proc Natl Acad Sci USA.
2009; ; 106 : :13445.–13450. 11.
Kim
JM
,
Rasmussen
JP
,
Rudensky
AY
. Regulatory T cells prevent catastrophic autoimmunity throughout the lifespan of mice . Nat Immunol.
2007; ; 8 : :191.–197. 12.
Malek
TR
,
Yu
A
,
Vincek
V
, et al.
CD4 regulatory T cells prevent lethal autoimmunity in IL-2Rbeta-deficient mice. Implications for the nonredundant function of IL-2 . Immunity.
2002; ; 17 : :167.–178. 13.
Buckner
JH
. Mechanisms of impaired regulation by CD4+CD25+FOXP3+ regulatory T cells in human autoimmune diseases . Nat Rev Immunol.
2010; ; 10 : :849.–859. 14.
Darrasse-Jeze
G
,
Bergot
AS
,
Durgeau
A
, et al.
Tumor emergence is sensed by self-specific CD44hi memory Tregs that create a dominant tolerogenic environment for tumors in mice . J Clin Invest.
2009; ; 119 : :2648.–2662. 15.
Maury
S
,
Lemoine
FM
,
Hicheri
Y
, et al.
CD4+CD25+ regulatory T cell depletion improves the graft-versus-tumor effect of donor lymphocytes after allogeneic hematopoietic stem cell transplantation . Sci Transl Med.
2010; ; 2 : :41ra52.. 16.
Nishikawa
H
,
Sakaguchi
S
. Regulatory T cells in tumor immunity . Int J Cancer.
2010; ; 127 : :759.–767. 17.
Boros
P
,
Bromberg
JS
. Human FOXP3+ regulatory T cells in transplantation . Am J Transplant.
2009; ; 9 : :1719.–1724. 18.
Cohen
JL
,
Trenado
A
,
Vasey
D
, et al.
CD4+CD25+ immunoregulatory T cells: new therapeutics for graft-versus-host disease . J Exp Med.
2002; ; 196 : :401.–406. 19.
Mittrucker
HW
,
Kaufmann
SH
. Mini-review: regulatory T cells and infection: suppression revisited . Eur J Immunol.
2004; ; 34 : :306.–312. 20.
Palomares
O
,
Yaman
G
,
Azkur
AK
, et al.
Role of Treg in immune regulation of allergic diseases . Eur J Immunol.
2010; ; 40 : :1232.–1240. 21.
Collison
LW
,
Workman
CJ
,
Kuo
TT
, et al.
The inhibitory cytokine IL-35 contributes to regulatory T-cell function . Nature.
2007; ; 450 : :566.–569. 22.
Choi
BM
,
Pae
HO
,
Jeong
YR
, et al.
Critical role of heme oxygenase-1 in Foxp3-mediated immune suppression . Biochem Biophys Res Commun.
2005; ; 327 : :1066.–1071. 23.
Deaglio
S
,
Dwyer
KM
,
Gao
W
, et al.
Adenosine generation catalyzed by CD39 and CD73 expressed on regulatory T cells mediates immune suppression . J Exp Med.
2007; ; 204 : :1257.–1265. 24.
Bopp
T
,
Becker
C
,
Klein
M
, et al.
Cyclic adenosine monophosphate is a key component of regulatory T cell-mediated suppression . J Exp Med.
2007; ; 204 : :1303.–1310. 25.
Piccirillo
CA
,
Shevach
EM
. Cutting edge: control of CD8+ T cell activation by CD4+CD25+ immunoregulatory cells . J Immunol.
2001; ; 167 : :1137.–1140. 26.
Grossman
WJ
,
Verbsky
JW
,
Barchet
W
, et al.
Human T regulatory cells can use the perforin pathway to cause autologous target cell death . Immunity.
2004; ; 21 : :589.–601. 27.
Grinberg-Bleyer
Y
,
Baeyens
A
,
You
S
, et al.
IL-2 reverses established type 1 diabetes in NOD mice by a local effect on pancreatic regulatory T cells . J Exp Med.
2010; ; 207 : :1871.–1878. 28.
Roncarolo
MG
,
Gregori
S
,
Battaglia
M
, et al.
Interleukin-10-secreting type 1 regulatory T cells in rodents and humans . Immunol Rev.
2006; ; 212 : :28.–50. 29.
Levings
MK
,
Roncarolo
MG
. Phenotypic and functional differences between human CD4+CD25+ and type 1 regulatory T cells . Curr Top Microbiol Immunol.
2005; ; 293 : :303.–326. 30.
Wu
K
,
Bi
Y
,
Sun
K
,
Wang
C
. IL-10-producing type 1 regulatory T cells and allergy . Cell Mol Immunol.
2007; ; 4 : :269.–275. |