| |
| Med Sci (Paris). 2012 December; 28(12): 1029–1031. Published online 2012 December 21. doi: 10.1051/medsci/20122812002.Les calpaïnes : un rôle décisif dans la vie et la mort de la niche épithéliale infectée par l’entéropathogène Shigella flexneri
Jean Bergounioux1,2 and Laurence Arbibe1,2* 1Unité de pathogénie microbienne moléculaire, département de biologie cellulaire et infection, Institut Pasteur, 25, rue du Docteur Roux, 75015Paris, France 2Inserm U786, Institut Pasteur, 25, rue du Docteur Roux, 75015Paris, France MeSH keywords: Animaux, Calpain, métabolisme, physiologie, Dysenterie bacillaire, microbiologie, anatomopathologie, Activation enzymatique, Humains, Muqueuse intestinale, Viabilité microbienne, Modèles biologiques, Shigella flexneri, croissance et développement, Transduction du signal |
L’éradication des pathogènes par l’organisme hôte fait appel à des stratégies très diverses incluant le suicide de la cellule hôte. Ainsi, les voies de mort apoptotique ou nécrotique sont impliquées dans le contrôle de la dissémination d’un certain nombre de pathogènes viraux [
1]. Le protooncogène p53 est un élément central des voies de signalisation proapoptotiques. Sa stabilisation conduit à l’induction d’une voie apoptotique intrinsèque mitochondriale et à la mort cellulaire, ce qui limite la multiplication des pathogènes intracellulaires comme les virus [
2]. La mort nécrotique met en jeu l’activation précoce de la famille des kinases RIP (receptor-interacting protein) et sa phase d’exécution aboutit à la dégradation active des membranes cellulaires mitochondriales et lysosomales, conduisant ainsi à la destruction de la niche épithéliale virale. L’ensemble de ces travaux identifient la mort cellulaire de la cellule hôte comme une stratégie efficace permettant de limiter la dissémination et la réplication du pathogène. En conséquence, celui-ci doit être capable de neutraliser les voies de signalisation conduisant à la mort de la cellule hôte [1]. Shigella flexneri est un bacille à Gram négatif agent de la dysenterie bacillaire. L’établissement de sa niche réplicative au sein des cellules épithéliales coliques est une étape centrale dans la physiopathogenèse de la maladie. Or, alors que Shigella est capable de tuer rapidement les cellules immunitaires qu’elle rencontre, ce n’est pas le cas des cellules entérocytaires infectées qui restent vivantes et métaboliquement actives plusieurs heures après l’infection [
3]. Divers travaux ont montré que Shigella retarde la mort apoptotique et nécrotique de la cellule épithéliale hôte. Ainsi, elle bloque le clivage de la caspase 3 induit en réponse à divers stimulus proapoptotiques, via l’injection de la protéine de virulence SPA15. De plus, sa mise en jeu de la voie de signalisation Nod1 (nucleotide-binding oligomerization domain-containing protein 1) enclenche une voie de survie cellulaire retardant l’apparition de la mort nécrotique [
4,
5]. L’ensemble de ces études suggèrent que dans les cellules non phagocytaires, les voies de signalisation conduisant à la nécrose ou à l’apoptose cellulaires sont activement ciblées par Shigella via des mécanismes encore peu identifiés. Notre travail démontre que Shigella, en activant précocement les protéases de type calpaïne, déstabilise p53 et bloque ainsi un processus de mort apoptotique impliquant p53 [
6]. Cependant, cette activité calpaïne va favoriser une mort nécrotique tardive, limitant ainsi considérablement la prolifération bactérienne intracellulaire. Ce travail démontre le rôle central de cette classe de protéases dans la décision de vie ou de mort de la niche épithéliale bactérienne. |
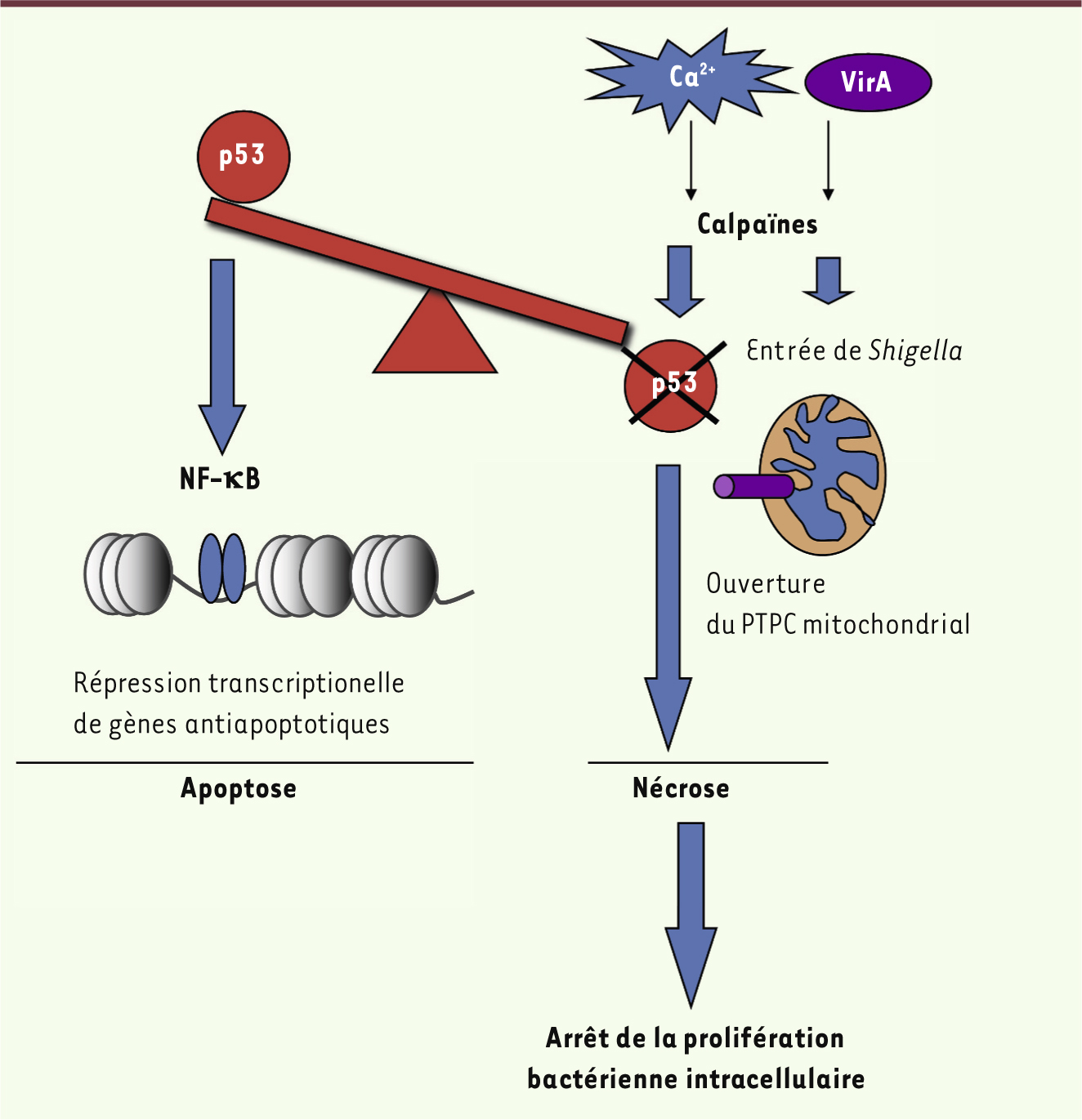
Le point de vue du pathogène : une activité calpaïne concourant à l’élimination du protooncogène p53 dans un contexte de stress génotoxique L’observation de micronoyaux1 dans les cellules épithéliales infectées par Shigella nous a permis d’identifier un stress génotoxique majeur survenant dès les premières minutes de l’infection. Bien que ce stress active la voie de réponse au stress génotoxique, comme en atteste l’activation de la kinase ATM (ataxia telangiectasia mutated) dans la cellule infectée, celle-ci n’est pas suivie d’une stabilisation de la protéine p53 mais, à l’inverse, d’une diminution rapide de son taux intracellulaire. L’ubiquitine ligase E3 Mdm2 (mouse double minute 2) est responsable de l’ubiquitination de p53 et de sa dégradation par le protéasome. Mdm2 peut être activée par la voie Akt/PKB (protéine kinase B) via la phosphorylation de ses résidus sérine 166 et 186. La voie de signalisation Akt/PKB, mise en jeu par la protéine de virulence IpgD (une inositol phosphate phosphatase) de Shigella, conduit à cette phosphorylation activatrice de Mdm2. En conséquence, IpgD favorise la dégradation de p53 en activant Mdm2 dans les temps précoces de l’infection. Cependant, l’infection cellulaire avec une souche de Shigella mutante n’exprimant pas IpgD n’élimine pas complètement la dégradation de p53 en réponse à l’infection, suggérant un mécanisme additionnel de dégradation. Les calpaïnes sont des hétérodimères associant une sous-unité enzymatique et une sous-unité régulatrice, la calpaïne 4 (Capn4). Leur activité protéolytique est induite par la mobilisation de calcium intracellulaire et favorisée par la dégradation de leur inhibiteur endogène, la calpastatine. Or, Shigella induit une dégradation très rapide de la calpastatine. La protéine de virulence VirA de Shigella possède un homologue chez E. Coli, EspG, qui active les calpaïnes par un mécanisme encore non élucidé [
7]. Nous avons démontré que l’expression de VirA sous la dépendance d’un promoteur inductible suffit à induire une activation des calpaïnes. Ainsi, l’activité protéolytique des calpaïnes est fortement réduite dans les cellules infectées par une souche déficiente pour VirA. In vitro, VirA interagit directement avec la calpastatine et favorise sa dégradation dans les cellules infectées. Le mécanisme par lequel VirA induit une activité protéolytique permettant la dégradation de la calpastatine reste à élucider. Ces résultats indiquent que l’induction d’une activité calpaïne au décours de l’infection constitue une stratégie active de ce pathogène. Des travaux antérieurs réalisés in vitro ont montré que les calpaïnes dégradent p53, générant ainsi deux fragments instables de 33 et 41 kDa secondairement dégradés par la voie du protéasome [
8]. Nous avons détecté l’apparition de ces produits de clivage de p53 au décours de l’infection, et diverses approches expérimentales nous ont permis de montrer que l’activité calpaïne était directement impliquée dans ce clivage. En conclusion, l’ensemble de ces données indiquent un rôle central des calpaïnes dans la dégradation de p53, qui pose également la question de la signification fonctionnelle de cette déstabilisation au décours de l’infection. L’utilisation de la lignée entérocytaire colorectale HCT116 et de son homologue dans laquelle l’expression de p53 est invalidée nous a permis d’analyser spécifiquement le rôle de p53 dans la réponse à l’infection. Nos résultats indiquent que l’invalidation de p53 bloque l’induction du clivage de la caspase 3 ou de PARP1 (poly[ADP-ribose]polymérase), indiquant un rôle central de p53 dans l’induction de l’apoptose cellulaire lors de l’infection. Nous montrons également que p53 exerce une activité proapoptotique via le facteur de transcription NF-κB en réprimant l’expression des gènes antiapoptotiques Bcl2 et Bcl-xL. Ainsi, la déstabilisation rapide de p53 par Shigella constitue une stratégie permettant au pathogène de bloquer l’apparition d’une mort cellulaire apoptotique, préservant ainsi sa niche épithéliale. |
Le point de vue de l’hôte : une activité calpaïne conduisant au « suicide cellulaire par nécrose » afin de stopper la prolifération bactérienne L’implication des calpaïnes dans le contrôle de la viabilité de la cellule épithéliale nous a conduits à nous interroger sur son impact sur la vie intracellulaire du pathogène. L’analyse en vidéomicroscopie montre que la déficience cellulaire en Capn4 n’affecte pas la mobilité bactérienne, mais restreint le nombre de foyers d’entrée bactériens. En effet, nos résultats indiquent un rôle des calpaïnes dans la dynamique du cytosquelette d’actine lors de l’infection, leur inactivation réduisant considérablement la formation d’extensions filopodiales membranaires nécessaires à la capture bactérienne par la cellule. De façon intéressante, malgré la réduction du nombre de foyers d’entrée bactériens, nous avons observé une amplification majeure de la croissance bactérienne intracellulaire dans les cellules déficientes en Capn4, suggérant un rôle additionnel des calpaïnes dans la restriction de la prolifération bactérienne intracellulaire. Nous avons donc émis l’hypothèse d’un rôle actif des calpaïnes dans la restriction de la prolifération bactérienne intracellulaire. Comme la viabilité de la cellule épithéliale est indispensable à la réplication bactérienne, nous avons recherché si l’activité calpaïne intervenait dans la mort de la niche épithéliale au décours de l’infection. Diverses approches expérimentales ont permis de montrer que, dans des systèmes cellulaires où p53 est rapidement éliminée (et consécutivement la mort apoptotique inhibée), Shigella induit de façon prépondérante une mort cellulaire de type nécrotique, ce qu’atteste une condensation chromatinienne majeure suivie d’une dilatation du volume cellulaire et parfois d’effraction bactérienne dans l’espace extracellulaire. De façon évidente, l’apparition des signes de nécrose cellulaire coïncide alors avec l’arrêt de la prolifération bactérienne, ce qui indique le rôle décisif de la viabilité cellulaire dans la réplication bactérienne intracellulaire. En relation directe avec cette observation, l’inactivation des calpaïnes ralentit considérablement l’apparition de la nécrose cellulaire, favorisant ainsi l’explosion de la prolifération bactérienne intracellulaire. |
Cetteétude montre que les calpaïnes régulent différentes étapes de la physiopathogenèse de Shigella. À un temps précoce de l’infection, cette activité protéasique, indispensable à l’entrée de la bactérie dans la cellule, permet également d’inactiver une voie de signalisation proapoptotique dépendante de p53 (Figure 1). Cependant, ce type de stratégie bactérienne dans un contexte de stress génotoxique n’est pas sans risque sur la stabilité du génome hôte car p53 joue un rôle essentiel dans la réponse de réparation de l’ADN. Le stress génotoxique intense survenant dès les premières minutes de l’infection suggère un rôle causal direct du pathogène qui reste à identifier. Cette étude démontre également le rôle central que joue la nécrose de la niche épithéliale dans la restriction de la croissance bactérienne intracellulaire. Le rôle majeur des calpaïnes dans l’exécution de ce type de mort confère à cette classe de protéases une fonction importante dans la défense antibactérienne vis-à-vis de certains pathogènes tels que Shigella. Il sera donc intéressant d’examiner si d’autres pathogènes capables d’activer les calpaïnes, tels que E. coli ou Cryptosporidium, suivent la même destinée intracellulaire [7,
9].
 | Figure 1.
Régulation des différentes étapes de la physiopathogenèse de Shigella flexneri par les calpaïnes. PTPC : permeability transition pore complex. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Lamkanfi
M
,
Dixit
VM.
Manipulation of host cell death pathways during microbial infections . Cell Host Microbe.
2010; ; 8 : :44.–54. 2.
Ludwig
S
,
Pleschka
S
,
Planz
O
,
Wolff
T.
Ringing the alarm bells: signalling and apoptosis in influenza virus infected cells . Cell Microbiol.
2006; ; 8 : :375.–386. 3.
Sansonetti
PJ
,
Mounier
J.
Metabolic events mediating early killing of host cells infected by Shigella flexneri . Microb Pathog.
1987; ; 3 : :53.–61. 4.
Faherty
CS
,
Maurelli
AT.
Spa15 of Shigella flexneri is secreted through the type III secretion system and prevents staurosporine-induced apoptosis . Infect Immun.
2009; ; 77 : :5281.–5290. 5.
Carneiro
LA
,
Travassos
LH
,
Soares
F
, et al.
Shigella induces mitochondrial dysfunction and cell death in nonmyleoid cells . Cell Host Microbe.
2009; ; 5 : :123.–136. 6.
Bergounioux
J
,
Elisee
R
,
Prunier
AL
, et al.
Calpain activation by the Shigella flexneri effector VirA regulates key steps in the formation and life of the bacterium’s epithelial niche . Cell Host Microbe.
2012; ; 11 : :240.–252. 7.
Dean
P
,
Muhlen
S
,
Quitard
S
,
Kenny
B.
The bacterial effectors EspG and EspG2 induce a destructive calpain activity that is kept in check by the co-delivered Tir effector . Cell Microbiol.
2011; ; 12 : :1308.–1321. 8.
Pariat
M
,
Carillo
S
,
Molinari
M
, et al.
Proteolysis by calpains: a possible contribution to degradation of p53 . Mol Cell Biol.
1997; ; 17 : :2806.–2815. 9.
Perez-Cordon
G
,
Nie
W
,
Schmidt
D
, et al.
Involvement of host calpain in the invasion of Cryptosporidium parvum . Microbes Infect.
2011; ; 13 : :103.–107. |