| |
| Med Sci (Paris). 2012 May; 28(5): 512–518. Published online 2012 May 30. doi: 10.1051/medsci/2012285016.Les phospholipases, enzymes clés de la physiologie spermatique Quels enjeux thérapeutiques ? Christophe Arnoult,1,2* Jessica Escoffier,3 Léa Munch,1,2 Virginie Pierre,1,2 Sylviane Hennebicq,1,2,4 Gérard Lambeau,5,6 and Pierre Ray1,2,7 1Équipe génétique, infertilité et thérapeutiques, laboratoire AGIM (âge, imagerie et modélisation), CNRS FRE3405, 38700La Tronche, France 2Université Joseph Fourier, Grenoble, 38000, France 3Department of veterinary and animal sciences, university of Massachusetts-Amherst, Amherst, 01003 MA, États-Unis 4Centre hospitalo-universitaire (CHU) de Grenoble, centre d’assistance médicale à la procréation - centre d’étude et de conservation des œufs et du sperme (AMP-CECOS), Grenoble, 38043, France 5CNRS, UMR7275, Sophia Antipolis, Valbonne, 06560, France 6Université de Nice-Sophia Antipolis, Valbonne, 06000, France 7CHU de Grenoble, unité fonctionnelle (UF) de biochimie et génétique moléculaire, Grenoble, 38000, France |
Malgré l’importance des recherches sur ce sujet, le rôle central des lipides du spermatozoïde dans la physiopathologie de la fécondation reste méconnu. L’objectif de cette revue est de présenter les dernières découvertes concernant les phospholipases spermatiques des mammifères, enzymes spécialisées dans l’hydrolyse des phospholipides. Nous en rappelerons brièvement la diversité et le mode d’action, puis nous montrerons l’implication de ces enzymes spermatiques dans toutes les étapes clés de la biologie du spermatozoïde jusqu’à l’activation ovocytaire, et finalement nous envisagerons leur possible utilité comme cibles thérapeutiques. |
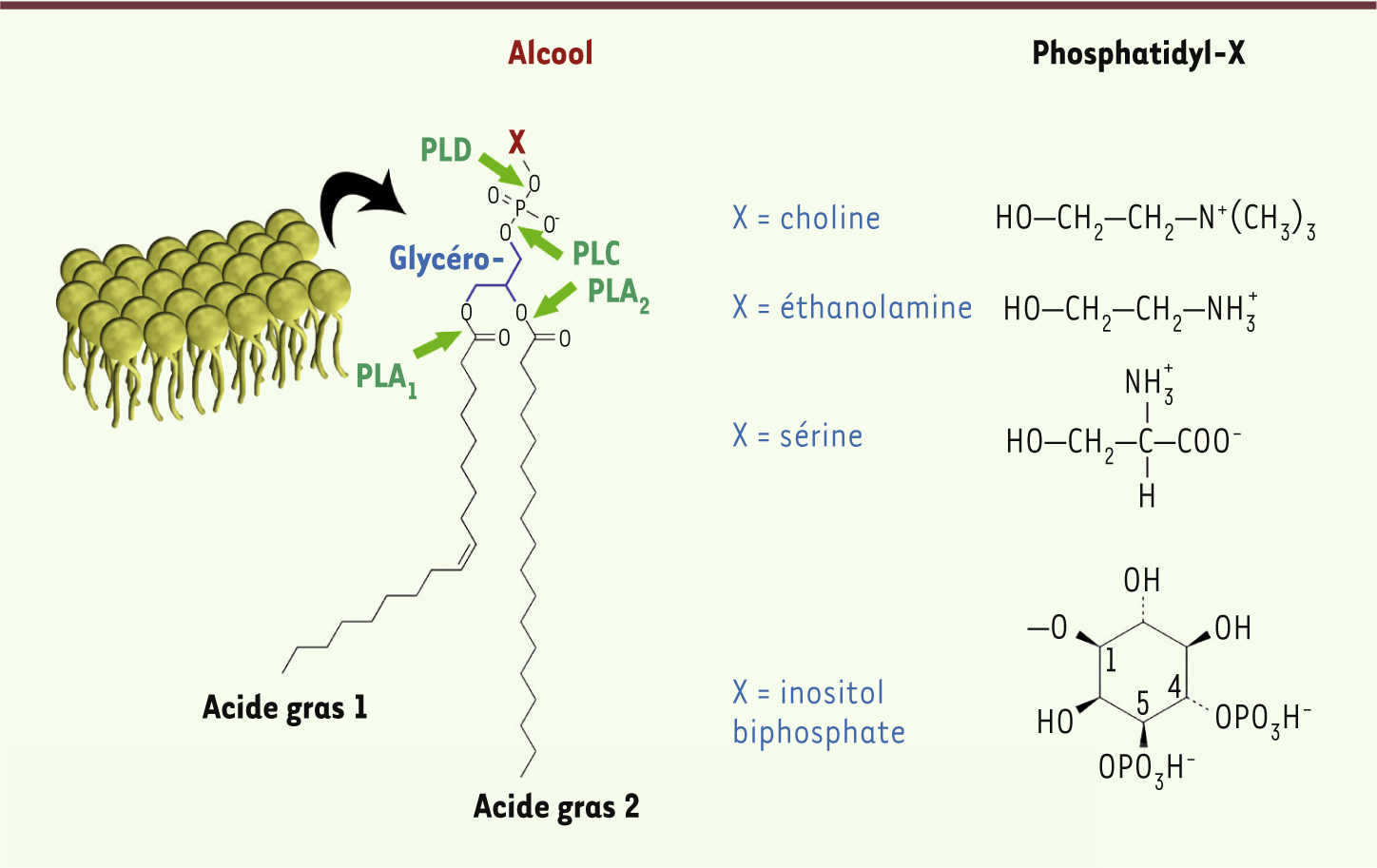
Les phospholipases, une famille d’enzymes hétérogènes ciblant les glycérophospholipides Les phospholipides sont les principaux constituants des membranes biologiques et il est maintenant bien établi que leur rôle va bien au-delà de celui d’un simple composant structural. Ils sont impliqués soit directement, soit indirectement, via leur hydrolyse, dans d’innombrables voies de signalisation cellulaire. Les glycérophospholipides (GPL) sont des molécules amphipathiques constituées d’une tête polaire phosphoalcoolique reliée, via une molécule de glycérol, à une queue hydrophobe constituée de deux acides gras [1]. Choline et éthanolamine sont les résidus alcool les plus courants au niveau de la partie polaire, mais d’autres, tels que la sérine ou l’inositol biphosphate, composent certaines GPL (Figure 1). Tous ces GPL sont hydrolysés par une superfamille de protéines, les phospholipases (PL). Les PL sont séparées en quatre familles sans homologie structurale, sur la base de la localisation du site enzymatique d’hydrolyse : (1) les PLA1 hydrolysent la liaison sn-1 et les PLA2 la liaison sn-2 des GPL ; ces enzymes libèrent un acide gras (AG) et un lysophospholipide (LP) ; (2) les PLB hydrolysent les deux liaisons sn et libèrent donc deux acides gras ; (c) les PLC hydrolysent spécifiquement la liaison sn-3 du phosphatidylinositol 4,5 biphosphate (PIP2) libérant un inositol 1,4,5 triphosphate (IP3) et laissant dans la membrane un diacylglycérol ; et (4) les PLD hydrolysent la liaison phosphoalcoolique et libèrent un acide phosphatidique et un alcool. Les réactions chimiques catalysées par ces enzymes sont illustrées dans la Figure 1. Ces PL sont soit intracellulaires, soit sécrétées ; dans ce dernier cas, elles agissent alors de manière autocrine/paracrine. Les différents métabolites obtenus après hydrolyse agissent soit directement comme messagers secondaires, soit en participant à la synthèse de médiateurs lipidiques (prostaglandines, leucotriènes). Chaque type cellulaire contient un panel particulier de PL lui permettant de répondre à des stimulus tant externes qu’internes [2, 3].
 | Figure 1.
Structure chimique des glycérophospholipides. Les GPL sont construits autour d’une molécule de glycérol, où deux groupements hydroxyles sont estérifiés par différents acides gras (AG) et le troisième par l’acide phosphorique. Différents alcools (molécules X) sont finalement greffés sur l’acide phosphorique par une liaison ester pour former du phosphatidylcholine, phosphatidyléthanolamine, phosphatidylsérine ou phosphatidylinositol 4,5 biphosphate. Leur propriété amphipathique est notable avec un pôle hydrophobe dû aux AG et un pôle hydrophile dû à l’ester phosphorique et à l’alcool. La localisation des coupures réalisées par les différentes PL est indiquée par des flèches vertes. La PLB coupe les deux liaisons sn1 et sn2 et a donc une activité PLA1 et PLA2. |
Dans le spermatozoïde, plusieurs PL ont été décrites. Leur rôle est très différent dans la physiologie spermatique : trois PLC (PLCβ1, PLCδ4 et PLCζ), deux PLA2 (une PLA2 sécrétée [sPLA2] de groupe X [sPLA2-GX] et une PLA2 intracellulaire indépendante du calcium [iPLA2]) et une PLD. Ces PL agissent à différents niveaux et régulent les grandes étapes de la fonction spermatique que sont la mobilité spermatique, la capacitation et la réaction acrosomique. La PLCζ, quant à elle, participe à l’activation ovocytaire lors de l’arrivée du spermatozoïde dans l’ooplasme. |
Le spermatozoïde, une physiologie complexe Les spermatozoïdes stockés dans la queue de l’épididyme [45] (→) sont des cellules encore quiescentes, immatures et éloignées de leur cible biologique [4]. Lors de leur expulsion du tractus génital mâle, ils sont mélangés au liquide séminal, ce qui provoque un brusque changement environnemental et un réveil physiologique comme en témoigne leur mobilité nouvelle. Le liquide séminal joue un rôle physiologique important et complexe [5, 6] mais dont la description est hors du champ de cette revue. L’acquisition de la mobilité va permettre aux spermatozoïdes de traverser la glaire cervicale et de progresser dans le tractus génital femelle où ils interagissent fortement avec l’épithélium utérin et tubaire [7]. L’arrivée dans l’utérus correspond à un nouveau changement d’environnement (pH, concentrations ioniques, osmolarité, présence d’un nouvel environnement protéique) qui influe considérablement sur les spermatozoïdes. De profondes modifications protéiques et lipidiques interviennent donc lors du cheminement du spermatozoïde vers l’ovocyte [8]. Cette étape obligatoire, appelée capacitation [9], prépare le spermatozoïde à sa rencontre avec l’ovocyte. Lors de celle-ci, autre étape importante de la physiologie spermatique, le spermatozoïde réalise alors la réaction acrosomique [10]. Celle-ci, longtemps considérée comme un simple événement d’exocytose, permet non seulement la sécrétion de protéases facilitant l’entrée du spermatozoïde à travers la zone pellucide ovocytaire, mais également l’extériorisation des récepteurs Izumo1 [48] (→→) (identifiés chez la souris) jusqu’alors masqués et intervenant dans la fusion des deux gamètes [11]. Ces trois étapes que sont la modification de la mobilité, la capacitation et la réaction acrosomique impliquent chacune spécifiquement des dizaines, voire des centaines, de protéines différentes, et de nombreuses voies de signalisation cellulaire ont été décrites sans qu’une hiérarchie ne soit véritablement définie. (→) Voir l’article de A. Noblanc et al., page 519 de ce numéro (→→) Voir m/s n° 5, mai 2005, page 480 La population spermatique éjaculée est très hétérogène, ce qui se manifeste entre autres par des différences de mobilité, des anomalies morphologiques et nucléaires (compaction [46] (→) aneuploïdie, cassures). Cette hétérogénéité est marquée chez l’homme et explique les variations importantes du pouvoir fécondant des spermatozoïdes. Les causes de cette hétérogénéité sont peu comprises mais pourraient impliquer les processus de contrôle de la méiose, de la spermiogenèse ainsi que les processus de maturation épididymaire [45]. La maturation des spermatozoïdes après leur éjaculation est asynchrone, voire incomplète, ce qui accoît cette hétérogénéité chez l’homme comme chez la souris. Au final, sur les 200 à 300 millions de spermatozoïdes éjaculés, moins d’une dizaine atteindront l’ovocyte. Ainsi, les étapes que constituent la progression et la maturation spermatique dans les voies génitales femelles et l’interaction avec l’épithélium utérotubaire constitueraient de véritables filtres de sélection [12]. (→) Voir l’article de E. Montellier, et al. page 485 de ce numéro |
Rôles des phospholipases dans la mobilité spermatique L’axonème du spermatozoïde contient de plusieurs centaines à un millier de protéines différentes [13]. Leur rôle spécifique reste encore flou voire complètement inconnu pour nombre d’entre elles, ce qui explique notre peu de connaissances des mécanismes moléculaires contrôlant le battement flagellaire. Plusieurs enzymes jouent un rôle pivot dans ce battement : la sérine-thréonine kinase, la protéine kinase A (PKA) et les tyrosine kinases qui contrôlent les cycles de phosphorylation/déphosphorylation des protéines structurales de type dynéine [14]. Le calcium, messager secondaire complexe, est aussi un intervenant clé de ce processus. Il contrôle l’adénylate cyclase soluble et donc la production d’AMP cyclique [15], et les cycles de phosphorylation/déphosphorylation via la calmoduline [16]. Par ailleurs, il se fixe directement sur les protéines structurales de l’axonème et contrôle ainsi l’hyperactivation [17]. Bien que la signalisation lipidique ait été peu étudiée, plusieurs arguments impliquent les lipides membranaires du flagelle dans le contrôle du battement flagellaire. Tout d’abord, si une grande partie du calcium provient du milieu extracellulaire via un canal calcique spécifique aux spermatozoïdes appelé CatSper [18], une partie provient aussi d’un stock calcique intracellulaire et spécifique au spermatozoïde situé dans la double enveloppe nucléaire [19]. Ce calcium est relâché via le récepteur de l’IP3 (canal calcique), l’IP3 provenant de l’hydrolyse du PIP2 par une PLC (voir plus loin) [20]. De plus, plusieurs études ont montré que certaines asthénozoospermies (absence ou faible mobilité des spermatozoïdes [47] (→) sont associées chez l’homme à une composition lipidique défectueuse, caractérisée par un excès de cholestérol et de desmostérol, une faible concentration d’acide gras polyinsaturés (dont l’acide docosahexaénoïque) et une augmentation du contenu en acides gras saturés [21, 22]. Ces résultats indiquent que la composition lipidique est un élément crucial pour un fonctionnement optimal du flagelle, et que toute altération des enzymes impliquées dans le contrôle de la composition lipidique de la membrane plasmique peut entraîner une asthénozoospermie chez l’homme [21, 22] et la souris [23]. Cette diminution de la mobilité pourrait être liée à une altération de la fluidité membranaire, qui est très dépendante de la composition en lipides. Chez la souris, deux PL ont été impliquées dans le contrôle du battement flagellaire des spermatozoïdes matures : la PLA2 de groupe VIA (Ca2+-independent phospholipase A2 ou iPLA2β) et la PLA2 sécrétée de groupe X (sPLA2-GX). Les animaux déficients en iPLA2β ont une asthénozoospermie marquée et, chez les animaux contrôles, l’utilisation d’inhibiteurs spécifiques de cette enzyme produit un effet similaire sur la mobilité du spermatozoïde, deux observations qui démontrent le rôle de cette enzyme dans le maintien de la fonction flagellaire du spermatozoïde mature [24]. La sPLA2-GX sécrétée au cours de la capacitation inhibe quant à elle la mobilité flagellaire. Cependant, l’enzyme semble cibler plus particulièrement les spermatozoïdes dont la mobilité est déficiente, en rapport avec une composition lipidique membranaire particulière [25]. (→) Voir l’article de Denise Escalier et Aminata Touré, page 503 de ce numéro |
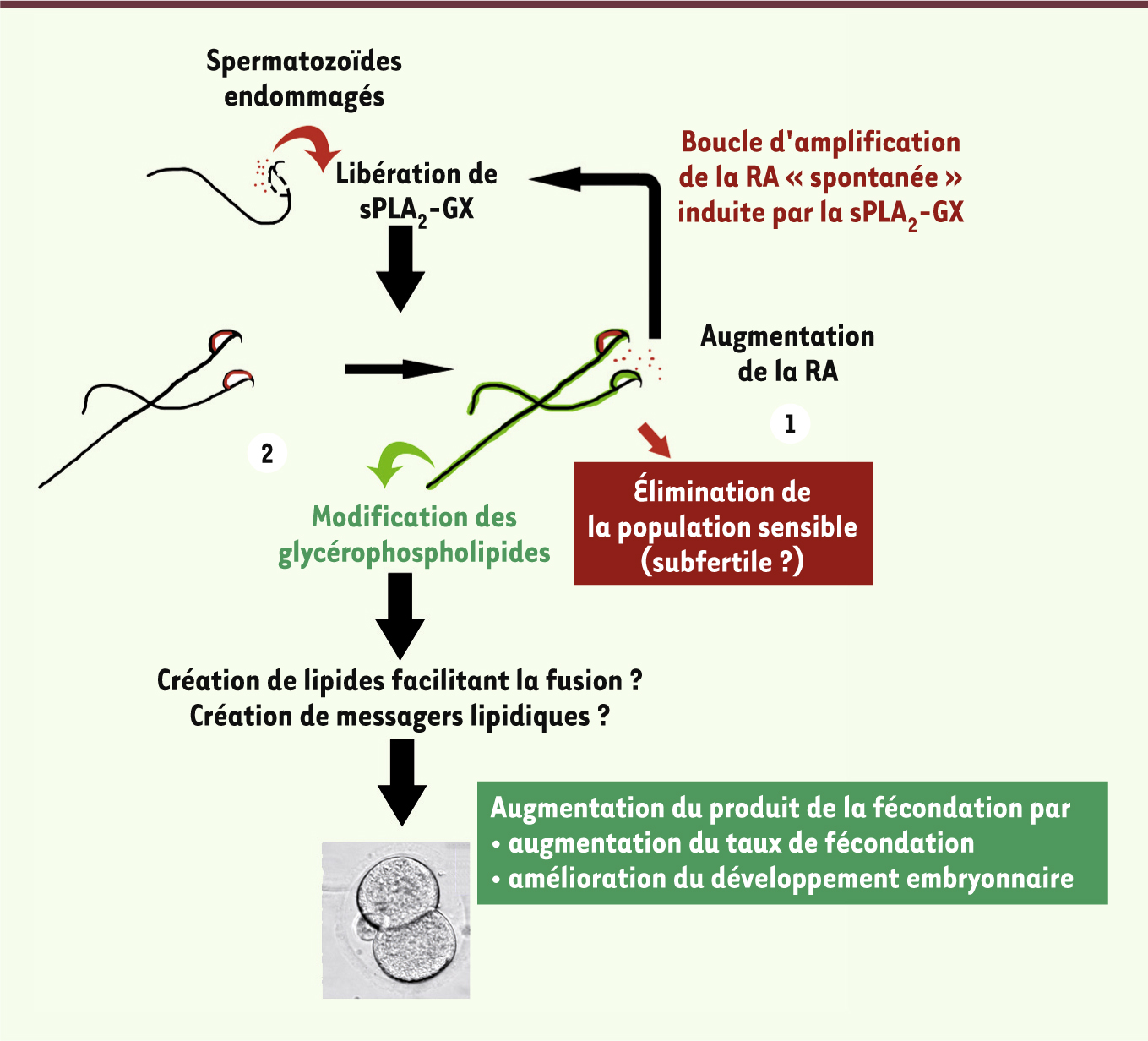
Rôles des phospholipases dans la capacitation La capacitation est définie comme une série d’événements complexes qui affectent le spermatozoïde lors de sa progression dans le tractus génital femelle et qui sont nécessaires pour que le spermatozoïde puisse féconder l’ovocyte [8, 9]. Les modifications biologiques nombreuses incluent, entre autres, la diminution du cholestérol de la membrane plasmique, un changement de fluidité membranaire, une réorganisation des lipides et des protéines membranaires, de multiples événements de phosphorylation, une alcalinisation du cytoplasme et une hyperpolarisation membranaire. Le rôle et l’importance de toutes ces modifications, et en particulier ceux de la polymérisation de l’actine, dans le pouvoir fécondant du spermatozoïde restent encore mal compris. Malgré tout, il a été montré que la formation des filaments d’actine est inhibée par des inhibiteurs de la PLD et est stimulée par l’apport de PLD exogène ou d’acide phosphatidique [26]. Cette multitude d’événements biologiques augmente l’hétérogénéité spermatique : à la fin de cette période de capacitation, de nombreuses sous-populations coexistent dont certaines n’ont pas réagi aux stimulus de capacitation tandis que d’autres ont réagi en excès (surcapacitation) entraînant une réaction acrosomique anticipée (spontanée). Chez la souris, cette réaction acrosomique spontanée est partiellement contrôlée par la sPLA2-GX. Celle-ci est en effet localisée dans l’acrosome des spermatozoïdes et est initialement libérée par des spermatozoïdes endommagés (Figure 2). La sPLA2-GX déclenche alors une réaction acrosomique dans d’autres spermatozoïdes, créant une boucle d’amplification de la réaction acrosomique dans la population spermatique. Curieusement, seule une sous-population de spermatozoïdes est sensible à l’activité de la sPLA2-GX. L’inhibition pharmacologique ou génétique de la sPLA2-GX entraîne une diminution du taux de fécondation et a un effet délétère sur le développement embryonnaire précoce, alors que le traitement de spermatozoïdes avec de la sPLA2-GX exogène conduit à l’effet inverse [27]. Ces résultats suggèrent que les modifications lipidiques induites par la sPLA2-GX au cours de la capacitation sont importantes pour insérer dans le spermatozoïde des messagers lipidiques secondaires favorisant le développement embryonnaire précoce. La sélection des spermatozoïdes reposerait donc, dans un premier temps, sur la traversée du mucus cervical, puis sur les interactions entre les spermatozoïdes et les cellules épithéliales utérotubaires [28] et, finalement, sur le contrôle de la réaction acrosomique précoce par la sPLA2-GX [25].
 | Figure 2.
Rôles physiologiques possibles de la sPLA2 de groupe X (sPLA2-GX) au cours de la capacitation du spermatozoïde de souris. Voie 1 : la sPLA 2-GX déclenche la réaction acrosomique (RA) d’une sous-population sensible. Ces spermatozoïdes ne peuvent plus participer à la fécondation, car ils sont incapables de traverser la zone pellucide et sont donc éliminés du processus de fécondation. Voie 2 : la sPLA 2-GX change la composition lipidique des spermatozoïdes insensibles à l’effet de la sPLA 2 sur la réaction acrosomique, et ces modifications sont nécessaires pour optimiser la fécondation (d’après [ 27]). |
|
Rôles des phospholipases dans la réaction acrosomique La réaction acrosomique, comme la majeure partie des voies d’exocytose, est régulée par le calcium. La signalisation calcique est ici complexe et fait intervenir de nombreux acteurs. Chez la souris, au moins trois types de canaux différents ont été impliqués : un canal calcique dépendant du voltage, le récepteur à l’IP3 et un canal calcique dépendant du niveau de remplissage des stocks calciques [10]. Le récepteur à l’IP3 est un canal calcique permettant la sortie du calcium stocké dans les compartiments intracellulaires tels que l’acrosome. Il est activé par une augmentation de la concentration en IP3, produit de dégradation du PIP2 par la PLC [29]. Bien que deux isoformes de PLC aient été caractérisées dans le spermatozoïde murin, PLCβ1 et PLCδ4, seule PLCδ4 semble intervenir dans la production d’IP3 au cours de la réaction acrosomique chez la souris. En effet, seules les souris mâles déficientes en protéine PLCδ4 ont une fécondité diminuée [30]. De plus, en l’absence de la PLCδ4, la signalisation calcique induite par ZP3 (zona protein 3), un des agonistes naturels de la réaction acrosomique chez la souris, est complètement inhibée [31]. Il est classiquement admis que le calcium ainsi mobilisé se fixe sur le complexe SNARE (soluble NSF attachment receptor)-synaptotagmine et permet la fusion entre la membrane plasmique et la membrane externe de l’acrosome [10]. Cependant, certains résultats font penser qu’une PLA2 pourrait être impliquée dans le mécanisme de fusion de ces deux membranes via la production de lipides qui facilitent la fusion. En effet, l’acide arachidonique et la lysophosphatidylcholine sont produits au cours de la réaction acrosomique, et ces deux molécules résultent de l’hydrolyse de phospholipides par une PLA2. De plus, le prétraitement des spermatozoïdes par un inhibiteur non spécifique des PLA2 bloque la réaction acrosomique [32]. La nature moléculaire de cette PLA2 n’a pas encore été élucidée. |
PLCζ, une phospholipase spermatique pour l’embryon Depuis de nombreuses années, on savait que l’activation ovocytaire était due à l’injection par le spermatozoïde d’un « facteur spermatique » lors de sa fusion avec l’ovocyte. La nature moléculaire de ce facteur est restée obscure jusqu’en 2002. À cette date, le gène codant pour une nouvelle isoforme de PLC, la PLCζ, a été cloné à partir d’une banque d’ADN complémentaire de testicule de souris [33]. La PLCζ est la plus petite des PLC connues à ce jour, et elle est dépourvue des domaines habituellement présents comme les domaines SH2 (Src homology 2), SH3 ou PH (pleckstrin homology). L’injection intraovocytaire de la protéine ou de son ARN messager est capable de mimer l’activation ovocytaire et de déclencher des oscillations calciques similaires à celles que provoque la fécondation [34]. Chez l’homme, la PLCζ se présente sous la forme d’un anneau à la base de l’acrosome. Sa localisation subcellulaire reste encore peu comprise mais la présence d’un acrosome est nécessaire puisque cette protéine est absente des spermatozoïdes de patients atteints de globozoospermie [35, 47]. La PLCζ a la particularité d’être extrêmement sensible au calcium, et on pense qu’elle est naturellement active aux concentrations cytosoliques de calcium (10-100 nM) [36]. Cependant, dans le spermatozoïde, elle serait inactivée par la fixation de son domaine C2 (calcium-binding motif) à certains phosphatidylinositides comme le PIP3 et le PIP5 [37]. |
Aujourd’hui, aucun médicament ne cible le spermatozoïde éjaculé. Pourtant, l’obtention de molécules capables de modifier la physiologie spermatique serait importante dans un but de contraception, et plus encore d’amélioration, de la procréation masculine, soit pour permettre le tri des spermatozoïdes, soit pour améliorer l’activation ovocytaire lors de procédure d’ICSI (intracytoplasmic sperm injection). Très clairement, les protéines dont l’absence chez la souris (invalidation du gène correspondant) ne provoque comme seul phénotype qu’une infertilité nette sont de bonnes cibles thérapeutiques dans le cadre du développement d’une molécule contraceptive mâle. C’est le cas de la PLCδ4. La PLCζ pourrait être aussi une bonne cible thérapeutique, car chez l’homme son absence liée à des facteurs génétiques cause une infertilité [38]. La qualité du sperme recueilli pour les fécondations in vitro (FIV) fait l’objet d’une grande attention lors des techniques d’aide médicale à la procréation (AMP) et plusieurs paramètres sont étudiés : concentration spermatique, morphologie, mobilité et plus récemment niveau de fragmentation de l’ADN. Cependant, ces paramètres ont une faible valeur prédictive quant à la réussite ultérieure de la FIV [39]. Les spermatozoïdes utilisés au cours de l’AMP sont généralement triés par une procédure de centrifugation dans un gradient de densité qui permet de sélectionner ceux qui sont mobiles et dont la morphologie est normale. Lors d’une procédure d’ICSI, le spermatozoïde est en plus sélectionné au microscope sur sa morphologie. Aujourd’hui, de nouvelles méthodes permettant d’éliminer une partie des spermatozoïdes présentant une fragmentation de l’ADN sont en cours d’évaluation [40, 41]. De nombreux auteurs ont montré qu’il existe une relation entre la fertilité et la composition lipidique des spermatozoïdes. Nous avons d’ailleurs montré que la modification des phospholipides des spermatozoïdes par certaines enzymes issues de venins est capable de moduler négativement le développement embryonnaire [42]. Malgré le rôle important des lipides membranaires du spermatozoïde dans les phases initiales du développement embryonnaire, ce paramètre n’est pas pris en compte dans le choix des spermatozoïdes pour les techniques d’AMP. Chez la souris, il existe un mécanisme physiologique contrôlé par la sPLA2-GX qui permet de cibler et d’éliminer une sous-population de spermatozoïdes présentant des anomalies des lipides composant leur membrane plasmique [27]. Il a été démontré que le traitement des spermatozoïdes par cette même enzyme avant FIV permet d’augmenter la fréquence de clivage des embryons (embryons deux cellules). On peut donc envisager l’utilisation de ce type de PL dans le cadre de l’AMP. Des expériences sur un modèle primate non humain sont actuellement en cours afin de tester l’intérêt potentiel des sPLA2 dans la FIV humaine. L’activation ovocytaire lors de l’ICSI reste une étape délicate qui dépend à la fois de la libération du facteur spermatique par le spermatozoïde et d’une entrée artificielle de calcium lorsque la pipette d’injection fait une brèche dans la membrane plasmique. La trituration du spermatozoïde, qui permet de déchirer la membrane plasmique du spermatozoïde et libère le facteur spermatique, est une étape nécessaire au succès de l’activation ovocytaire. Chez l’homme, environ 30 % des spermatozoïdes d’un éjaculat normal ne possèdent pas de PLCζ. Par ailleurs, certaines infertilités comme la globozoospermie sont associées à une absence de PLCζ et les spermatozoïdes sont alors incapables d’activer les ovocytes même lorsqu’ils sont injectés directement dans l’ooplasme [43]. Afin de pallier cette déficience, l’ionophore calcique A23187 a été utilisé avec succès au cours de la fécondation [35]. Cependant, le signal calcique qu’induit l’A23187 est très différent de celui que produit la libération naturelle de PLCζ dans l’ooplasme [44], et l’utilisation de PLCζ, pourrait se substituer avantageusement à celle d’ionophores calciques. Il apparaît évident qu’un contrôle plus objectif de la quantité de PLCζ libérée lors de l’ICSI pourrait être un facteur améliorant le rendement et la sécurité de ces techniques. Le Tableau I résume les potentialités de chaque PL comme cible thérapeutique.
Tableau I.
|
Contraception |
Tri de spermatozoïdes FIV/ICSI |
ICSI - activation |
| PLA2 sécrétée (sPLA2-GX) |
Non |
Oui |
Non |
|
|
Augmentation du taux de réaction acrosomique spontanée |
|
| PLA2 intracellulaire (iPLA2) |
? |
Non |
Non |
| PLCβ 1 |
Non |
Non |
Non |
| PLCδ 4 |
Oui |
Non |
Non |
|
Souris KO infertiles |
|
|
| PLCδ |
Oui |
Oui |
Oui |
|
Mutations de PLCζ entraînent une infertilité masculine |
Absence dans 30 % des spermatozoïdes humains |
Activation ovocytaire chez les patients sans PLCζ |
|
Absence dans les cellules somatiques |
|
|
| PLD |
? |
Non |
Non |
Phospholipases présentes dans le spermatozoïde et leur potentialité comme cible thérapeutique dans le cadre de la contraception et de l’AMP.
|
En conclusion, nous avons montré que les PL sont des enzymes centrales dans le contrôle de la physiologie spermatique et, par conséquent, toute modification de la composition phospholipidique de la membrane plasmique des spermatozoïdes affecte l’activité des PL et donc les voies de signalisation en aval. Ces résultats permettent d’expliquer en partie les relations qui existent entre infertilité et altération du profil lipidique spermatique chez les patients mâles infertiles. Plusieurs PL représentent des cibles thérapeutiques intéressantes pour développer des molécules stimulant la fertilité comme la sPLA2-GX et la PLCζ, alors que le développement d’inhibiteurs ciblant la PLCζ et la PLCδ4 représenterait une piste intéressante dans le cadre de la contraception masculine. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1. Larsson K, Quinn P, Sato K, Tiberg F. Lipids : structure, physical properties and functionality . Bridgwater: : The Oily Press Lipid Library; , 2006. 2. Lambeau G, Gelb MH. Biochemistry and physiology of mammalian secreted phospholipases A2 . Annu Rev Biochem. 2008; ; 77 : :495.–520. 3. Wymann MP, Schneiter R. Lipid signalling in disease . Nat Rev Mol Cell Biol. 2008; ; 9 : :162.–176. 4. Verma RJ. Sperm quiescence in cauda epididymis : a mini-review . Asian J Androl. 2001; ; 3 : :181.–183. 5. Robertson SA. Seminal plasma and male factor signalling in the female reproductive tract . Cell Tissue Res. 2005; ; 322 : :43.–52. 6. Rodriguez-Martinez H, Kvist U, Ernerudh J, et al. Seminal plasma proteins : what role do they play ? Am J Reprod Immunol. 2011; ; 66 : :11.–22. 7. Hung PH, Suarez SS. Regulation of sperm storage and movement in the ruminant oviduct . Soc Reprod Fertil. 2010; ; 67 : :257.–266. 8. Salicioni AM, Platt MD, Wertheimer EV, et al. Signalling pathways involved in sperm capacitation . Soc Reprod Fertil. 2007; ; 65 : :245.–259. 9. Travis AJ, Kopf GS. The role of cholesterol efflux in regulating the fertilization potential of mammalian spermatozoa . J Clin Invest. 2002; ; 110 : :731.–736. 10. Florman HM, Jungnickel MK, Sutton KA. Regulating the acrosome reaction . Int J Dev Biol. 2008; ; 52 : :503.–510. 11. Inoue N, Ikawa M, Isotani A, et al. The immunoglobulin superfamily protein Izumo is required for sperm to fuse with eggs . Nature. 2005; ; 434 : :234.–238. 12. Suarez SS. Regulation of sperm storage and movement in the mammalian oviduct . Int J Dev Biol. 2008; ; 52 : :455.–462. 13. Escalier D. Knockout mouse models of sperm flagellum anomalies . Hum Reprod Update. 2006; ; 12 : :449.–461. 14. Luconi M, Carloni V, Marra F, et al. Increased phosphorylation of AKAP by inhibition of phosphatidylinositol 3-kinase enhances human sperm motility through tail recruitment of protein kinase A . J Cell Sci. 2004; ; 117 : :1235.–1246. 15. Carlson AE, Hille B, Babcock DF. External Ca2+ acts upstream of adenylyl cyclase SACY in the bicarbonate signaled activation of sperm motility . Dev Biol. 2007; ; 312 : :183.–192. 16. Marin-Briggiler CI, Jha KN, Chertihin O, et al. Evidence of the presence of calcium/calmodulin-dependent protein kinase IV in human sperm and its involvement in motility regulation . J Cell Sci. 2005; ; 118 : :2013.–2022. 17. Suarez SS. Control of hyperactivation in sperm . Hum Reprod Update. 2008; ; 14 : :647.–657. 18. Qi H, Moran MM, Navarro B, et al. All four CatSper ion channel proteins are required for male fertility and sperm cell hyperactivated motility . Proc Natl Acad Sci USA. 2007; ; 104 : :1219.–1223. 19. Ho HC, Suarez SS. Characterization of the intracellular calcium store at the base of the sperm flagellum that regulates hyperactivated motility . Biol Reprod. 2003; ; 68 : :1590.–1596. 20. Ho HC, Suarez SS. An inositol 1,4,5-trisphosphate receptor-gated intracellular Ca2+ store is involved in regulating sperm hyperactivated motility . Biol Reprod. 2001; ; 65 : :1606.–1615. 21. Aksoy Y, Aksoy H, Altinkaynak K, et al. Sperm fatty acid composition in subfertile men . Prostaglandins Leukot Essent Fatty Acids. 2006; ; 75 : :75.–79. 22. Buffone MG, Verstraeten SV, Calamera JC, et al. High cholesterol content and decreased membrane fluidity in human spermatozoa are associated with protein tyrosine phosphorylation and functional deficiencies . J Androl. 2009; ; 30 : :552.–558. 23. Sato H, Taketomi Y, Isogai Y, et al. Group III secreted phospholipase A2 regulates epididymal sperm maturation and fertility in mice . J Clin Invest. 2010; ; 120 : :1400.–1414. 24. Bao S, Miller DJ, Ma Z, et al. Male mice that do not express group VIA phospholipase A2 produce spermatozoa with impaired motility and have greatly reduced fertility . J Biol Chem. 2004; ; 279 : :38194.–38200. 25. Escoffier J, Pierre V, Jemel I, et al. Group X secreted phospholipase A2 specifically decreases sperm motility in mice . J Cell Physiol. 2011; ; 226 : :2601.–2609. 26. Cohen G, Rubinstein S, Gur Y, et al. Crosstalk between protein kinase A and C regulates phospholipase D and F-actin formation during sperm capacitation . Dev Biol. 2004; ; 267 : :230.–241. 27. Escoffier J, Jemel I, tanemoto A, et al. Group X phospholipase A2 is released during sperm acrosome reaction and controls fertility outcome in mice . J Clin Invest. 2010; ; 120 : :1415.–1428. 28. Holt WV, Fazeli A. The oviduct as a complex mediator of mammalian sperm function and selection . Mol Reprod Dev. 2010; ; 77 : :934.–943. 29. O’Toole CM, Arnoult C, Darszon A, et al. Ca2+ entry through store-operated channels in mouse sperm is initiated by egg ZP3 and drives the acrosome reaction . Mol Biol Cell. 2000; ; 11 : :1571.–1584. 30. Fukami K, Nakao K, Inoue T, et al. Requirement of phospholipase Cdelta4 for the zona pellucida-induced acrosome reaction . Science. 2001; ; 292 : :920.–923. 31. Fukami K, Yoshida M, Inoue T, et al. Phospholipase Cdelta4 is required for Ca2+ mobilization essential for acrosome reaction in sperm . J Cell Biol. 2003; ; 161 : :79.–88. 32. Roldan ER, Shi QX. Sperm phospholipases and acrosomal exocytosis . Front Biosci. 2007; ; 12 : :89.–104. 33. Saunders CM, Larman MG, Parrington J, et al. PLC zeta : a sperm-specific trigger of Ca2+ oscillations in eggs and embryo development . Development. 2002; ; 129 : :3533.–3544. 34. Cox LJ, Larman MG, Saunders CM, et al. Sperm phospholipase Czeta from humans and cynomolgus monkeys triggers Ca2+ oscillations, activation and development of mouse oocytes . Reproduction. 2002; ; 124 : :611.–623. 35. Taylor SL, Yoon SY, Morshedi MS, et al. Complete globozoospermia associated with PLCzeta deficiency treated with calcium ionophore and ICSI results in pregnancy . Reprod Biomed Online. 2010; ; 20 : :559.–564. 36. Kouchi Z, Fukami K, Shikano T, et al. Recombinant phospholipase Czeta has high Ca2+ sensitivity and induces Ca2+ oscillations in mouse eggs . J Biol Chem. 2004; ; 279 : :10408.–10412. 37. Kouchi Z, Shikano T, Nakamura Y, et al. The role of EF-hand domains and C2 domain in regulation of enzymatic activity of phospholipase Czeta . J Biol Chem. 2005; ; 280 : :21015.–21021. 38. Kashir J, Konstantinidis M, Jones C, et al. A maternally inherited autosomal point mutation in human phospholipase C zeta (PLCzeta) leads to male infertility . Hum Reprod. 2012; ; 27 : :222.–231. 39. Muller CH. Rationale, interpretation, validation, and uses of sperm function tests . J Androl. 2000; ; 21 : :10.–30. 40. Rawe VY, Boudri HU, Sedo CA, et al. Healthy baby born after reduction of sperm DNA fragmentation using cell sorting before ICSI . Reprod Biomed Online. 2010; ; 20 : :320.–323. 41. Polak DF, Denaday F. Single and twin ongoing pregnancies in two cases of previous ART failure after ICSI performed with sperm sorted using annexin V microbeads . Fertil Steril. 2010; ; 94 : :351.. 42. Escoffier J, Couvet M, de Pomyers H, et al. Snake venoms as a source of compounds modulating sperm physiology: secreted phospholipases A2 from Oxyuranus scutellatus scutellatus impact sperm motility, acrosome reaction and in vitro fertilization in mice . Biochimie. 2010; ; 92 : :826.–836. 43. Yoon SY, Jellerette T, Salicioni AM, et al. Human sperm devoid of PLC, zeta 1 fail to induce Ca2+ release and are unable to initiate the first step of embryo development . J Clin Invest. 2008; ; 118 : :3671.–3681. 44. Ciapa B, Arnoult C. Could modifications of signalling pathways activated after ICSI induce a potential risk of epigenetic defects ? Int J Dev Biol. 2011; ; 55 : :143.–152. 45. Noblanc A, Drevet J, Kocer A. Dommages post-testiculaires aux gamètes males : rôles de l’épididyme . Med Sci (Paris). 2012; ; 28 : :519.–525. 46. Montellier E, Rousseaux S, Kochbin S. Feux croisés sur le nucléosome : bases moléculaires de la compaction du génome mâle haploïde . Med Sci (Paris). 2012; ; 28 : :485.–489. 47. Escalier D, Touré A. Malformations de l’appareil flagellaire du spermatozoïde impliquées dans l’infertilité chez l’homme . Med Sci (Paris). 2012; ; 28 : :503.–511. 48. Gilgenkrantz S. Izumo ou le mariage fusionnel entre spermatozoïde et ovocyte . Med Sci (Paris). 2005; ; 21 : :480.. |