| |
| Med Sci (Paris). 2012 May; 28(5): 473–475. Published online 2012 May 30. doi: 10.1051/medsci/2012285010.Le microenvironnement immunitaire, complice de la voie Wnt/β-caténine dans le cancer du foie Marie Anson,1 Mireille Viguier,1 Christine Perret,1 and Jean-Pierre Couty1* 1Oncogenèse des épithéliums digestifs, équipe institut Cochin, Inserm U1016, UMR CNRS8104, université Paris Descartes, université Paris Diderot, 27, rue du Faubourg St-Jacques, 75014Paris, France MeSH keywords: Animaux, Carcinomes, étiologie, génétique, immunologie, métabolisme, Communication cellulaire, physiologie, Transformation cellulaire néoplasique, Microenvironnement cellulaire, Humains, Cellules tueuses naturelles, Foie, cytologie, Tumeurs du foie, Souris, Modèles biologiques, Transduction du signal, Protéines de type Wingless, bêta-Caténine |
Le carcinome hépatocellulaire (CHC) Le carcinome hépatocellulaire (CHC) est la tumeur primitive du foie la plus fréquente. Il s’agit de la 5e cause de mortalité par cancer dans le monde avec une incidence estimée à plus de 500 000 nouveaux cas par an. Le pronostic vital est extrêmement faible, faute de traitements efficaces [1]. D’une façon générale, le CHC se développe fréquemment sur un foie cirrhotique ou dans le cadre d’une inflammation chronique. Les facteurs de risque sont bien identifiés : infection par les virus des hépatites B et C, exposition à des agents toxiques, abus d’alcool et désordres métaboliques. Toutefois, les mécanismes moléculaires qui conduisent à la transformation tumorale de l’hépatocyte restent encore mal compris. Trois voies de carcinogenèse sont le plus fréquemment impliquées : p53, Rb (retinoblastoma protein) et la voie Wnt/β-caténine [2, 3]. La combinaison de données clinicobiologiques et de génomique fonctionnelle a permis d’établir une classification des tumeurs en deux principaux groupes. Très schématiquement, on distingue les tumeurs de mauvais pronostic ayant une forte instabilité génomique (associées à une perte de fonction de l’axine 1 et de p53) et les tumeurs de faible instabilité génomique, de meilleur pronostic et où l’on classe les tumeurs exprimant des mutations gain de fonction dans le gène de la β-caténine [2]. |
Une voie de signalisation importante dans le cancer du foie : Wnt/β-caténine La voie de signalisation Wnt/β-caténine est très conservée dans le règne animal. Elle joue un rôle majeur dans le développement embryonnaire et intervient également chez l’adulte dans le contrôle de la prolifération et du destin cellulaires (pour revue [4–6]). C’est la β-caténine qui est le partenaire fondamental de cette voie de signalisation. L’activation du signal Wnt permet la stabilisation de la β-caténine et son association aux facteurs de transcription de la famille LEF/TCF (Figure 1). Ce complexe β-caténine/LEF-TCF contrôle un programme génique requis pour la réponse biologique. Notre groupe de recherche a clairement démontré l’implication de cette voie de signalisation dans la physiologie normale du foie, mais également son rôle oncogénique [3, 7–9]. La voie de signalisation Wnt/β-caténine est constitutivement activée dans 30 à 40 % des CHC chez l’homme [3, 8].
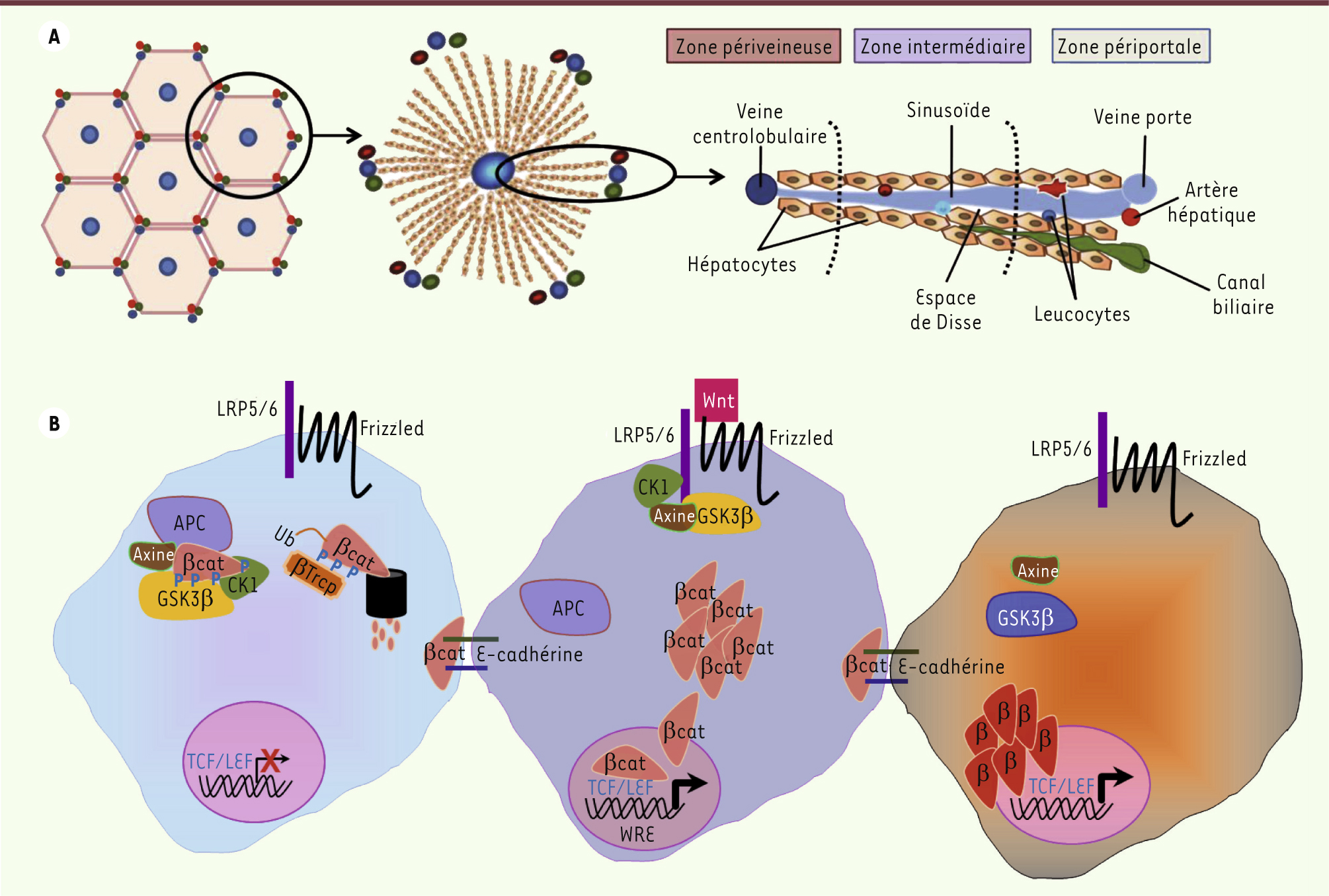
 | Figure 1.
A. Représentation schématique de l’organisation du foie. À gauche, le foie adulte se compose d’unités structurales polyédriques appelées lobules ou acinus hépatiques. Au centre, chaque lobule est constitué d’une veine centrobulaire, d’où partent les travées hépatocytaires et à chaque sommet du polyèdre se trouve un espace porte. À droite, Une travée d’hépatocytes, selon l’axe portocentral. B. Représentation schématique de la voie de signalisation Wnt/β-caténine. À gauche, en absence de facteur Wnt, la β-caténine (βcat) est phosphorylée par un complexe de dégradation alors qu’une partie de la β-caténine sert aux jonctions membranaires. Au centre, en présence de facteurs Wnt, le complexe de dégradation est déstabilisé, la β-caténine n’est plus phosphorylée et s’accumule dans le cytoplasme. La β-caténine migre ensuite dans le noyau où elle agit comme facteur de transcription, en partenariat avec les facteurs LEF/TCF. À droite, dans un hépatocyte transformé, des mutations gain de fonction de la β-caténine ou la perte d’APC conduisent à une activation aberrante de la β-caténine. |
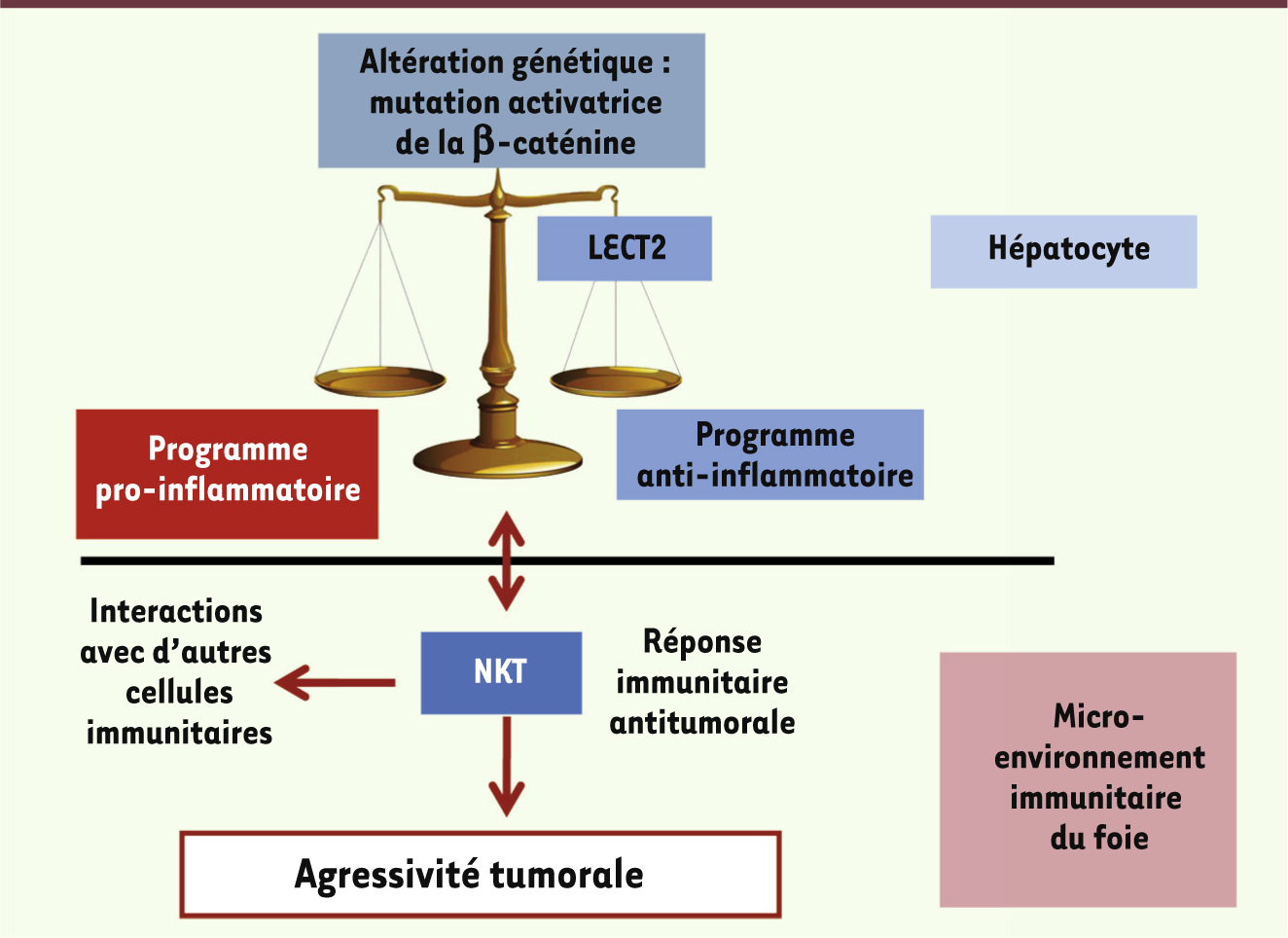
 | Figure 2.
Schéma de l’interaction entre LECT2 (dans l’hépatocyte) et l’environnement immunitaire du foie, en particulier les NKT, dans l’agressivité des tumeurs du foie. |
Récemment, nous avons identifié une cible moléculaire contrôlée par la β-caténine appelée LECT2 pour leukocyte cell-derived chemotaxin 2 [10]. On connaît encore très peu les fonctions de LECT2, bien qu’un rôle immunomodulateur lui ait été attribué. Ainsi, une augmentation du nombre des cellules natural killer T (NKT) est observée dans le foie des souris déficientes en LECT2. Ces données suggèrent l’interaction potentielle de la voie β-caténine avec le microenvironnement immunitaire hépatique. |
Microenvironnement immunitaire hépatique et cancer du foie Afin d’empêcher l’émergence de tumeurs, le système immunitaire assure en permanence une surveillance dynamique, vérification assidue du tissu/organe dont il contribue à assurer l’homéostasie. Toutefois, dans certains contextes, les effecteurs du système immunitaire favorisent paradoxalement la croissance tumorale. C’est de ces observations qu’est né le concept d’échappement des cellules cancéreuses à l’immunosurveillance, proposé comme 7e caractéristique fondamentale [11]. Le foie possède une structure particulière dont l’unité fonctionnelle est le lobule hépatique (Figure 1). Le sang y pénètre par un système original à double entrée : un sang artériel riche en oxygène et nutriments délivré par l’artère hépatique, et un sang veineux apporté par la veine porte en provenance du tractus intestinal, chargé en antigènes issus de l’alimentation et de la flore commensale microbienne. Ce sang veineux suit en permanence un processus d’épuration en cheminant à travers les espaces sinusoïdaux entourant les travées d’hépatocytes. Sa trajectoire au sein des lobules hépatiques est à sens unique, de l’espace porte vers l’espace centrolobulaire (Figure 1). Le foie a un passé hématologique important (c’est le lieu de l’hématopoïèse embryonnaire et fœtale) et garde à l’état adulte une composition immunitaire singulière. Il héberge une armée de cellules immunitaires qui reconnaissent les éléments étrangers et évitent que s’établisse une réaction inflammatoire trop violente à chaque prise alimentaire. Il est également le siège de mécanismes de tolérance immunitaire. Enfin, les cellules de l’immunité innée y sont abondantes, principalement représentées par les macrophages hépatiques - appelés cellules de Kupffer - et les cellules natural killer T (NKT). |
L’activation aberrante de la β-caténine dans l’hépatocyte génère un processus inflammatoire L’utilisation de modèles murins établis dans notre laboratoire, qui récapitulent les étapes d’initiation et de progression de la tumorigenèse hépatique induite par la β-caténine, a permis de montrer que l’activation de la β-caténine dans l’hépatocyte induisait un programme génique pro-inflammatoire. En effet, les données moléculaires qu’apportent le haut débit des ARNm et l’immunoprécipitation de la chromatine [9] ont permis de révéler que la β-caténine contrôle dans l’hépatocyte, directement et indirectement, la transcription de gènes impliqués dans l’immunité (chimiokines, cytokines, récepteurs). Par ailleurs, la signalisation NFkB, voie majeure de l’inflammation, se trouve stimulée en réponse à l’activation de la β-caténine. La conséquence de cette activation de la β-caténine et de NFkB dans l’hépatocyte se traduit par un remodelage important du microenvironnement hépatique, qui touche préférentiellement la population des cellules NKT produisant de grande quantité de cytokines comme l’interféron gamma (IFN-γ) et l’interleukine 4 (IL-4). |
LECT2, une cible de la β-caténine qui contrôle l’inflammation Le phénotype des souris déficientes en LECT2 nous a incité à explorer le rôle de ce facteur dans l’inflammation secondaire à l’activation de la β-caténine. En effet, de façon surprenante, la délétion de LECT2 l’aggrave considérablement et se traduit par une cytolyse hépatocytaire importante associée à un recrutement de polynucléaires neutrophiles. Dans ce contexte, les NKT changent leur polarisation cytokinique en produisant moins d’IFN-γ et beaucoup plus d’IL-4. Par analogie, la déplétion des NKT à l’aide d’anticorps spécifiques accentue également très fortement l’inflammation due à l’activation de la β-caténine [12]. Ces observations montrent que la signalisation β-caténine est capable d’induire simultanément dans l’hépatocyte, un programme pro- et anti-inflammatoire conditionnant le fonctionnement des cellules NKT. |
LECT2 et NKT, deux effecteurs interconnectés conditionnant l’agressivité tumorale induite par la β-caténine De façon intéressante, l’absence de LECT2 et/ou des NKT conduit à une aggravation très importante de la tumorigenèse induite par l’activation de la β-caténine, comme nous le démontrons dans un article récemment paru dans Journal of Clinical Investigation [12]. Elle se traduit par une augmentation du nombre de nodules tumoraux possédant un fort index prolifératif associée à une prédominance de formes histologiques très indifférenciées. La formation de ces CHC très agressifs corrèle avec le développement de métastases pulmonaires. Par conséquent, l’inflammation et surtout le microenvironnement immunitaire, sont une composante essentielle de la tumorigenèse induite par l’activation aberrante de la β-caténine. Ainsi, en activant à la fois des médiateurs pro- ou anti-inflammatoires, cet oncogène est capable de mettre en place un microenvironnement inflammatoire qui va conditionner l’agressivité de la tumeur [12] (Figure 2). L’ensemble de nos résultats ouvre de nouvelles perspectives thérapeutiques innovantes permettant de réguler l’expression de LECT2 et le fonctionnement des NKT, afin d’améliorer la réponse immunitaire anti-tumorale. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1. El-Serag HB, Rudolph KL. Hepatocellular carcinoma: epidemiology and molecular carcinogenesis . Gastroenterology. 2007; ; 132 : :2557.–2576. 2. Laurent-Puig P, Zucman-Rossi J. Genetics of hepatocellular tumors . Oncogene. 2006; ; 25 : :3778.–3786. 3. De La Coste A, Romagnolo B, Billuart P, et al. Somatic mutations of the beta-catenin gene are frequent in mouse and human hepatocellular carcinomas . Proc Natl Acad Sci USA. 1998; ; 95 : :8847.–8851. 4. Clevers H. Colon cancer: understanding how NSAIDs work . N Engl J Med. 2006; ; 354 : :761.–763. 5. Logan CY, Nusse R. The Wnt signaling pathway in development and disease . Annu Rev Cell Dev Biol. 2004; ; 20 : :781.–810. 6. MacDonald BT, Tamai K, He X. Wnt/beta-catenin signaling: components, mechanisms, and diseases . Dev Cell. 2009; ; 17 : :9.–26. 7. Benhamouche S, Decaens T, Godard C, et al. Apc tumor suppressor gene is the zonation-keeper of mouse liver . Dev Cell. 2006; ; 10 : :759.–770. 8. Colnot S, Decaens T, Niwa-Kawakita M, et al. Liver-targeted disruption of Apc in mice activates beta-catenin signaling and leads to hepatocellular carcinomas . Proc Natl Acad Sci USA. 2004; ; 101 : :17216.–17221. 9. Torre C, Benhamouche S, Mitchell C, et al. The transforming growth factor-alpha and cyclin D1 genes are direct targets of beta-catenin signaling in hepatocyte proliferation . J Hepatol. 2011; ; 55 : :86.–95. 10. Ovejero C, Cavard C, Périanin A, et al. Identification of the leukocyte cell-derived chemotaxin 2 as a direct target gene of beta-catenin in the liver . Hepatology. 2004; ; 40 : :167.–176. 11. Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation . Cell. 2011; ; 144 : :646.–674. 12. Anson M, Crain-Denoyelle AM, Baud V, et al. Oncogenic β-catenin triggers an inflammatory response that determines the aggressiveness of hepatocellular carcinoma in mice . J Clin Invest. 2012; ; 122 : :586.–599. |