| |
| Med Sci (Paris). 2012 May; 28(5): 470–473. Published online 2012 May 30. doi: 10.1051/medsci/2012285009.Comment faire beaucoup avec peu dans le système nerveux Engrailed recrute la mitochondrie Olivier Stettler1* 1UMR CNRS 8192, laboratoire de dynamique membranaire et maladies neurologiques, université Paris Descartes, 45, rue des Saints-Pères, 75005Paris, France MeSH keywords: Animaux, Axones, métabolisme, physiologie, Protéines à homéodomaine, génétique, Humains, Mitochondries, Modèles biologiques, Système nerveux, composition chimique, cytologie, Phénomènes physiologiques du système nerveux, Colliculus supérieurs, Synapses, Facteurs de transcription, Cortex visuel |
Lors du développement cérébral chez l’homme, pas moins de 100 milliards de neurones doivent établir chacun jusqu’à 100 000 connexions synaptiques avec d’autres cellules nerveuses. Le bon fonctionnement du cerveau dépend de la précision avec laquelle les axones, qui vont établir ces connexions, sont préalablement guidés vers leurs territoires cibles. Le guidage axonal est contrôlé par des molécules extracellulaires agissant en général par l’intermédiaire de récepteurs associés à la membrane plasmique du cône de croissance, une structure sensorimotrice située à l’extrémité des axones en élongation [
1]. Ces molécules de guidage exercent des effets attractifs ou répulsifs sur l’axone en modifiant la dynamique du cytosquelette du cône de croissance. Dès les années 1960, Sperry introduit le concept d’une connectivité cérébrale s’établissant sous l’action combinée de molécules de guidage spécifiques. Cependant, le nombre de molécules distinctes nécessaire à l’élaboration d’un réseau synaptique complexe (1015 connexions chez l’homme) semble excéder les capacités codantes du génome (30 000 gènes). Aujourd’hui, le problème ne se pose plus en ces termes : les molécules impliquées dans le guidage se sont avérées être polyvalentes, donc le concept de gènes exclusivement dédiés à une fonction de guidage semble avoir fait long feu. Des protéines d’abord décrites comme facteurs de guidage axonal (éphrines et sémaphorines) ont en effet été impliquées ensuite dans d’autres fonctions, comme l’angiogenèse ou la plasticité synaptique. Inversement, des protéines dont on ne soupçonnait pas initialement le rôle dans le guidage interviennent dans ce processus. C’est le cas de morphogènes (Shh [sonic hedgehog], certaines homéoprotéines, Wnt, FGF [fibroblast growth factor], BMP [bone morphogenic protein]) dont la fonction classique est la mise en place précoce des structures primaires de l’embryon. Utilisées plus tardivement au cours du développement, ces protéines vont en fait participer aussi à l’élaboration de la circuiterie nerveuse. Engrailed, une homéoprotéine qui intervient très tôt dans la spécification du territoire mésencéphalique dans le cerveau embryonnaire, contribue plus tard au guidage et à la stabilisation des axones rétiniens par des mécanismes originaux mis à jour récemment. |
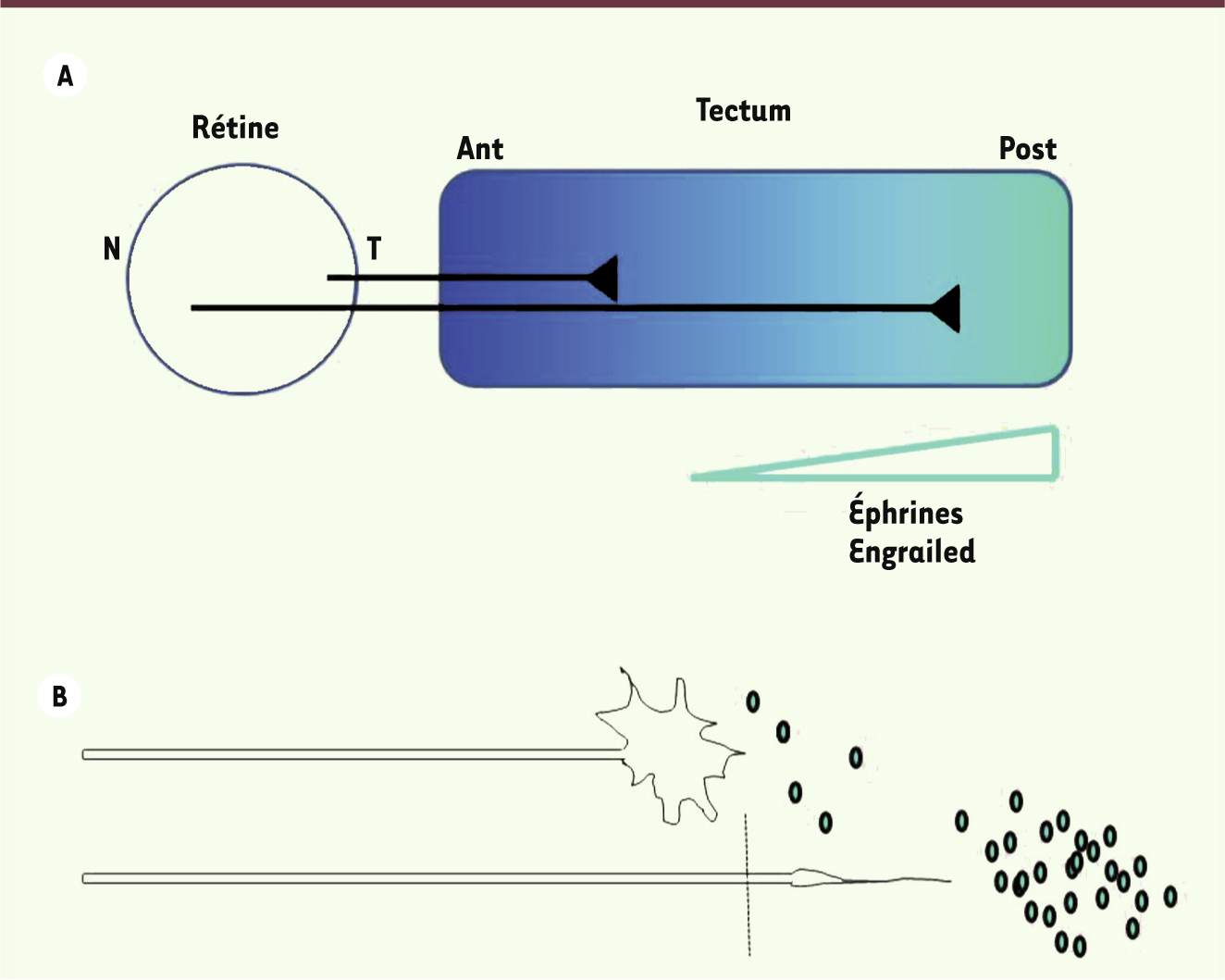
Mise en place des connexions rétino-tectales dans le système visuel Chez les vertébrés, les axones des cellules ganglionnaires rétiniennes (RGC) se projettent de façon ordonnée dans une structure cérébrale nommée colliculus supérieur ou tectum. Les axones dont les corps cellulaires sont situés dans la rétine nasale1 se projettent dans la partie postérieure du tectum et ceux venant de la rétine temporale dans la partie antérieure de cette structure (Figure 1A). On observe également dans le tectum une projection ordonnée des axones rétiniens dorsaux et ventraux. Cette ségrégation des afférences est indispensable à la vision binoculaire et elle dépend de gradients de molécules de guidage de la famille des éphrines. Des gradients croissants antéropostérieurs d’éphrine-A dans le tectum repoussent préférentiellement les cônes de croissance temporaux (Figure 1). Cette sélectivité s’explique en partie par une concentration plus élevée de récepteurs de l’éphrine-A (EphA) dans les cônes de croissance des axones temporaux. D’autres molécules sont exprimées en gradient dans le tectum, dont Engrailed, qui participe à la signalisation des éphrines en augmentant localement la transcription des gènes correspondants [
2]. L’invalidation des principales éphrines chez la souris [
3] perturbe fortement mais pas complètement les projections rétiniennes dans le tectum, ce qui indique que d’autres molécules de guidage sont à l’œuvre. Une série d’études récentes montre qu’une fraction extracellulaire de la protéine Engrailed dans le tectum agit de façon non conventionnelle sur le guidage axonal [
4–
6].
 | Figure 1.
Guidage des axones rétiniens dans le tectum. A. Projection ordonnée des axones rétiniens dans le tectum dans un gradient croissant antéropostérieur d’éphrines et d’Engrailed. B. Collapsus du cône de croissance d’un axone de la rétine temporale au contact de concentrations élevées de signaux répulsifs, et rétraction de l’axone vers une position antérieure où leur concentration est moins élevée. |
|
Rôle non conventionnel de la protéine Engrailed Engrailed, comme d’autres homéoprotéines, agit classiquement comme un facteur de transcription (fonction qui ne dépend que de la cellule ou cell autonomous). Des travaux de A. Prochiantz et al. ont montré que les homéoprotéines agissent également de façon non conventionnelle comme molécules de signalisation intercellulaire (fonction cellulaire qui dépend de facteurs autres que strictement cellulaires ou cell non-autonomous) [4–
9]. Dans le tectum de poulet, une fraction des molécules Engrailed sécrétées participe ainsi au guidage des axones rétiniens en potentialisant les effets répulsifs de l’éphrine-A5 [
5]. Chez l’amphibien, des gradients extracellulaires d’Engrailed repoussent in vitro les cônes de croissance temporaux et attirent les cônes de croissance nasaux. Ces fonctions requièrent un contrôle local de la traduction protéique par Engrailed après son transfert dans le cône de croissance [4]. Les homéoprotéines peuvent en effet réguler la traduction protéique via leur interaction avec le facteur d’initiation de la traduction EiF4E [
7]. Les effets de la fraction extracellulaire d’Engrailed sont significatifs car l’administration in vivo d’anticorps dirigés contre cette protéine perturbe l’organisation des axones rétiniens [5]. |
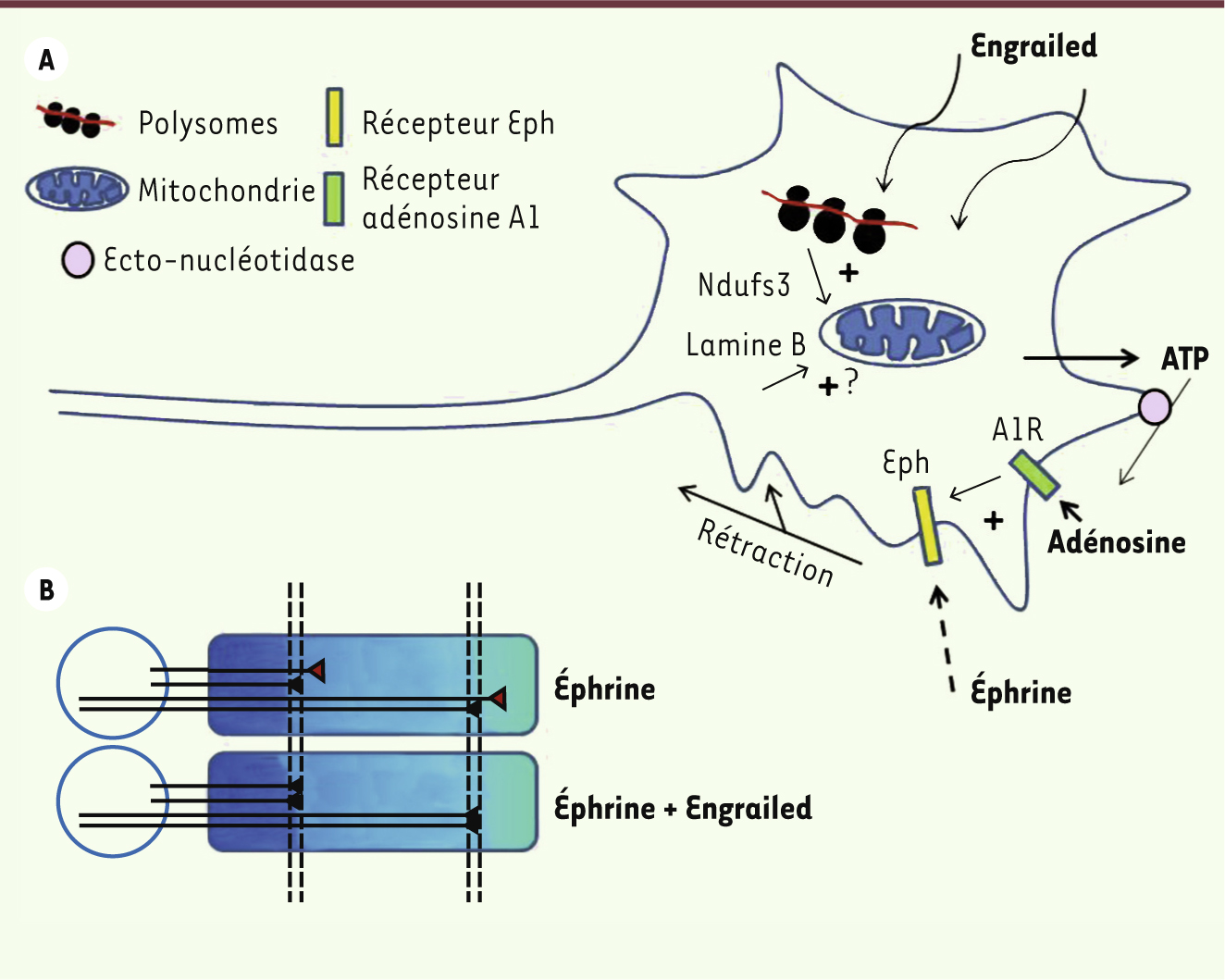
La mitochondrie : un partenaire d’Engrailed dans l’axone Les cibles protéiques permettant à Engrailed de rendre les cônes de croissance plus sensibles à l’éphrine-A5 ont été caractérisées et, de manière inattendue, elles se sont révélées être localisées à la mitochondrie. En effet, Engrailed augmente la traduction de protéines du complexe I mitochondrial (Ndufs1 et Ndufs3 [NADH dehydrogenase ubiquinone Fe-S protein]). Le complexe I de la chaîne respiratoire est l’un des cinq complexes mitochondriaux nécessaires à la production d’ATP via la phosphorylation oxydative. L’augmentation de l’expression des protéines Ndufs semble déterminante, car Engrailed augmente aussi la production mitochondriale d’ATP et sa sécrétion par les cônes de croissance [6]. L’ATP et ses dérivés purinergiques sont des molécules de signalisation importantes du système nerveux et une analyse pharmacologique indique que le composant actif dans la voie de signalisation d’Engrailed est l’adénosine [6]. L’adénosine agit via les récepteurs A1, car un antagoniste A1 bloque la potentialisation d’éphrine-A5 par Engrailed ainsi que le guidage des axones rétiniens in vitro. Pour résumer, une fraction extracellulaire d’Engrailed influence le guidage des axones rétiniens en stimulant la sécrétion d’ATP par le cône de croissance. Ce mécanisme, qui implique la mitochondrie et une traduction protéique locale, conduit à une stimulation autocrine des récepteurs A1 de l’adénosine (Figure 2A). On trouve des équivalents à cette boucle autocrine dans d’autres systèmes. Par exemple, la stimulation autocrine des récepteurs A3 en réponse à la sécrétion d’ATP permet aux polynucléaires neutrophiles de migrer sur un substrat chémoattractif [
8]. D’autres découvertes sont venues renforcer le lien entre Engrailed et la mitochondrie. Dans un modèle murin de la maladie de Parkinson, Engrailed exerce un rôle neuroprotecteur en stimulant la traduction de protéines du complexe I de la chaîne respiratoire [9]. Chez l’amphibien, Engrailed pourrait stimuler les mitochondries des axones rétiniens en croissance en induisant localement la traduction d’une lamine-B [
10] (Figure 2). L’interaction de cette lamine ordinairement nucléaire avec la mitochondrie est manifestement critique, car son élimination du compartiment axonal altère la morphologie des mitochondries et induit une dégénérescence des axones. L’analyse de la voie de signalisation non conventionnelle (ou paracrine) de la protéïne Engrailed dans une autre cellule que celle qui la produit dévoile un rôle inédit des mitochondries dans l’axone et oriente les études à venir sur le rôle des mitochondries dans la formation ou la plasticité de la connectivité cérébrale. Parions qu’Engrailed avec son petit air de couteau suisse moléculaire et son tropisme pour la signalisation mitochondriale saura encore nous surprendre !
 | Figure 2.
Schéma de la signalisation non conventionnelle d’Engrailed au cours du guidage axonal. A. Engrailed internalisée par le cône de croissance stimule la traduction locale de protéines mitochondriales et la sécrétion d’ATP. L’ATP est dégradé en adénosine qui active les récepteurs adénosine A1 A1R, lesquels potentialisent les effets de faibles doses d’éphrine et la rétraction du cône de croissance. B. En potentialisant les effets d’éphrine, Engrailed augmenterait la précision des projections rétino-tectales (voir [ 6]). |
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
L'auteur remercie B. Gasnier pour sa relecture critique du manuscrit. Il remercie tout spécialement A. Prochiantz et F. Darchen pour leur soutien.
|
Footnotes |
1.
Mehlen
P
,
Rama
N
. Nétrine-1 et guidage axonal : signalisation et traduction asymétrique . Med Sci (Paris).
2007; ; 23 : :311.–315. 2.
Logan
C
,
Wizenmann
A
,
Drescher
U
, et al.
Rostral optic tectum acquires caudal characteristics following ectopic engrailed expression . Curr Biol.
1996; ; 6 : :1006.–1014. 3.
Cang
J
,
Wang
L
,
Stryker
MP
,
Feldheim
DA
. Roles of ephrin-as and structured activity in the development of functional maps in the superior colliculus . J Neurosci.
2008; ; 28 : :11015.–11023. 4.
Brunet
I
,
Weinl
C
,
Piper
M
, et al.
The transcription factor Engrailed-2 guides retinal axons . Nature.
2005; ; 438 : :94.–98. 5.
Wizenmann
A
,
Brunet
I
,
Lam
JS
, et al.
Extracellular Engrailed participates in the topographic guidance of retinal axons in vivo
. Neuron.
2009; ; 64 : :355.–366. 6.
Stettler
O
,
Joshi
RL
,
Wizenmann
A
, et al.
Engrailed homeoprotein recruits the adenosine A1 receptor to potentiate ephrin A5 function in retinal growth cones . Development.
2012; ; 139 : :215.–224. 7.
Brunet
I
,
Di Nardo
AA
,
Sonnier
L
, et al.
The topological role of homeoproteins in the developing central nervous system . Trends Neurosci.
2007; ; 30 : :260.–267. 8.
Chen
Y
,
Corriden
R
,
Inoue
Y
, et al.
ATP release guides neutrophil chemotaxis via P2Y2 and A3 receptors . Science.
2006; ; 314 : :1792.–1795. 9.
Alvarez-Fischer
D
,
Fuchs
J
,
Castagner
F
, et al.
Engrailed protects mouse midbrain dopaminergic neurons against mitochondrial complex I insults . Nat Neurosci.
2011; ; 14 : :1260.–1266. 10.
Yoon
BC
,
Jung
H
,
Dwivedy
A
, et al.
Local translation of extranuclear lamin B promotes axon maintenance . Cell.
2012; ; 148 : :752.–764. |