| |
| Med Sci (Paris). 2012 May; 28(5): 456–458. Published online 2012 May 30. doi: 10.1051/medsci/2012285004.JAK/STAT : de l’inflammation à la mémoire Céline S. Nicolas,1 Zsolt Csaba,2 Assia Fafouri,2 Charlotte Javalet,1 Pierre Gressens,2 Pascal Dournaud,2 and Stéphane Peineau1,2* 1Medical research council (MRC) Centre for synaptic plasticity, Dorothy Hodgkin building, Whitson street, BristolBS1 3NY, Royaume-Uni 2Inserm U676, hôpital Robert Debré et université Denis-Diderot, 75019Paris, France MeSH keywords: Humains, Inflammation, étiologie, génétique, métabolisme, psychologie, Janus kinases, physiologie, Dépression synaptique à long terme, Mémoire, Troubles de la mémoire, immunologie, Modèles biologiques, Plasticité neuronale, Facteurs de transcription STAT, Transduction du signal, Synapses |
Synapses et plasticité synaptique Les neurones sont avant tout des cellules de la communication, spécialisées dans l’intégration et la conduction des signaux électriques. Ces signaux passent d’un neurone à l’autre par l’intermédiaire de structures dédiées, les synapses. Le fonctionnement des synapses repose sur la libération par l’axone du neurone afférent (présynaptique) d’un médiateur chimique, le neurotransmetteur. Ce messager est ensuite détecté par des récepteurs situés sur le neurone cible (postsynaptique), qui transforment le signal chimique en courant électrique. L’efficacité avec laquelle la transmission des signaux passe au niveau d’une synapse peut être modulée : cette propriété, appelée la plasticité synaptique, concerne toutes les synapses, quelle que soit la nature de leur neurotransmetteur (glutamate, acide gamma amino-butyrique [GABA], acétylcholine, etc.). Une transmission synaptique facilitée est désignée sous le terme de potentiation, et une transmission réduite sous le terme de dépression. La durée de ces modulations est variable. Elle est qualifiée de court terme si elle n’excède pas quelques minutes et de long terme au-delà de plusieurs heures. Le principal neurotransmetteur excitateur du système nerveux central est le glutamate. Son action physiologique passe par l’activation de trois types de récepteurs ionotropiques dénommés d’après leur agoniste : N-méthyl-D-aspartate (NMDA), acide propionique alpha-amino-3-hydroxy-5-méthyl-4-isoxazole (AMPA) et kaïnate, ainsi que par l’activation de récepteurs couplés à des protéines G, les récepteurs métabotropiques du glutamate (mGluR). Les récepteurs AMPA (AMPAR) sont les principaux récepteurs responsables de la transmission synaptique excitatrice rapide, les autres récepteurs glutamatergiques jouant plutôt un rôle dans la modulation de cette transmission. De nombreuses formes de plasticité synaptique ont été identifiées et sont associées à des modifications au niveau présynaptique, postsynaptique ou aux deux. Depuis quelques années, les formes de plasticité synaptique impliquant une dépression de la transmission synaptique sont au cœur d’intenses recherches, avec la découverte de leur implication dans de nombreuses formes d’apprentissage et de mémorisation, et dans des affections du système nerveux central comme le stress, l’addiction et la neurodégénérescence [1]. |
La dépression à long terme dite NMDAR-LTD L’une des formes les plus étudiées est la dépression à long terme (LTD) du courant associé aux AMPAR déclenchée par l’activation des récepteurs NMDA (NMDAR) : la NMDAR-LTD. Elle a été découverte dans les années 1990, et de nombreuses équipes ont essayé depuis de comprendre comment l’activation transitoire des NMDAR pouvait provoquer une réduction sur le long terme de l’activité des AMPAR. Les chercheurs ont ainsi pu montrer que la diminution de cette activité était liée à une réduction du nombre des AMPAR présents au niveau de la synapse. Les mécanismes permettant d’induire cette réduction et de la maintenir sur le long terme restent en grande partie méconnus [2]. La NMDAR-LTD peut être subdivisée en deux phases principales : l’induction et la maintenance. L’induction correspond aux mécanismes qui permettent de mettre en place la dépression et la maintenance aux mécanismes qui permettent de la conserver au-delà de plusieurs heures. La phase d’induction déclenche au niveau de la synapse un ensemble de cascades de voies de signalisation intracellulaire alors que le passage à la phase de maintenance nécessite la synthèse de nouvelles protéines et donc une action principalement nucléaire. Lors de l’induction, l’activation des NMDAR entraîne une augmentation de la concentration intracellulaire en calcium. Ce calcium va être détecté par des protéines de type « senseur de calcium ». La plupart de ces protéines jouent un rôle dans l’ancrage des AMPAR à l’échafaudage protéique sous membranaire et à la mise en place des structures d’endocytose des AMPAR [3]. Elles permettent ainsi de préparer la synapse à une réduction du nombre d’AMPAR disponibles à la membrane. D’autres protéines de type senseur de calcium, comme la calmoduline, jouent un rôle clé dans l’intervention des voies de signalisation qui déclenchent le processus de réduction de la quantité d’AMPAR et contrôlent la néosynthèse protéique au niveau du noyau [1, 2]. Les voies principales identifiées sont la voie des sérine/thréonine phosphatases PP2B/PP1 [4], celle des lipides kinases et sérine/thréonine kinases PI3K/Akt/GSK3 [5] et celle des caspases 9-3/GSK3 [6] (Figure 1).
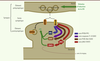 | Figure 1.
Les principales voies de signalisation intracellulaire impliquées dans la dépression à long terme dépendante des récepteurs NMDA. AMPAR : récepteur glutamatergique de type AMPA ; GSK3 : glycogène synthase kinase 3 ; JAK2 : Janus kinase 2 ; LTD : dépression à long terme ; NMDAR : récepteur glutamatergique de type NMDA ; PI3K : phosphoinositide 3-kinase ; PP1 : protéine phosphatase 1 ; PP2B : protéine phosphatase 2B ; STAT3 : signal transducer and activator of transcription 3. Les interactions entre les voies de signalisation ne sont pas représentées. |
|
La voie JAK2/STAT3 : un nouvel acteur dans la NMDAR-LTD Nous avons récemment identifié une nouvelle voie de signalisation intracellulaire impliquée dans la NMDAR-LTD, grâce à l’utilisation de plusieurs techniques complémentaires (biochimique, pharmacologique, électrophysiologique, immunocytochimique et génétique) [7]. Cette voie, qui implique une tyrosine kinase, la Janus kinase 2 (JAK2), et STAT3 (signal transducer and activator of transcription 3), est très étudiée pour son rôle en immunologie, cancérologie et dans la croissance et la survie cellulaires, mais ses fonctions au sein du système nerveux central sont peu documentées. Nous avons montré que JAK2 est présente au niveau postsynaptique et est activée lors de l’induction de la NMDAR-LTD. Elle requiert l’activation des récepteurs NMDA, l’entrée de calcium dans la synapse et l’activation de la voie PP2B/PP1. Son inhibition bloque l’induction de la LTD. Ce mécanisme est spécifique de la NMDAR-LTD, car deux autres formes de LTD, qui dépendent de l’activation soit des mGluR, soit des récepteurs muscariniques de l’acétylcholine, n’activent pas JAK2. De plus, l’activité de JAK2 n’est pas non plus requise pour deux autres formes de plasticité synaptique (la potentialisation à long terme et la dépotentialisation). Nous avons également montré que la principale cible de JAK2 dans la NMDAR-LTD est STAT3. STAT3, une fois activé, se dimérise puis migre dans le noyau du neurone. Cependant, si l’activation et la dimérisation de STAT3 sont bien nécessaires pour la phase d’induction de la LTD des AMPAR, son transfert vers le noyau n’est pas requis. Ainsi, dans une préparation où les synapses sont préservées mais les corps cellulaires/noyaux éliminés, la LTD est induite. De même l’inhibition de la transcription, de la fixation de STAT3 à l’ADN ou de l’export nucléaire est sans effet sur l’induction de la NMDAR-LTD. Ce résultat est surprenant car plus de 3 000 articles ont montré que STAT3 agit via son transfert nucléaire et la modulation de la transcription de ses nombreux gènes cibles [8]. Quelques travaux suggèrent toutefois que STAT3 pourrait avoir également un rôle non nucléaire en régulant la dynamique des microtubules [9]. L’implication de ces derniers vient récemment d’être mise en évidence dans la NMDAR-LTD [10], mais le lien avec la voie JAK2/STAT3 n’a pas été étudié. Une autre hypothèse serait un rôle inhibiteur de STAT3 non activé sur l’induction de la NMDAR-LTD. Le mécanisme clé ne serait donc pas l’action nucléaire en elle-même mais plutôt la capacité de déplacement de STAT3 en dehors de la synapse. Notre étude s’est limitée à la phase d’induction de la NMDAR-LTD. Nous ne pouvons exclure que ce transfert de STAT3 dans le noyau, que nous avons observé, n’a pas un rôle dans la maintenance de la LTD. En effet STAT3 pourrait intervenir rapidement à un stade précoce au niveau de la synapse et, à plus long terme, pour permettre le passage de la phase d’induction à la phase de maintenance de la LTD. |
La voie JAK/STAT : un lien entre LTD et inflammation ? Plus largement, ce travail soulève la question des liens potentiels entre l’inflammation, dont les effets sont fortement associés à la voie JAK/STAT, et la LTD. En effet, dysfonctionnements de la LTD et inflammation ont été impliqués indépendamment dans les mêmes affections du système nerveux central (dépression, troubles de mémorisation, maladie d’Alzheimer, etc.). Même si nos travaux offrent un début de réponse, de nombreuses études complémentaires seront nécessaires pour répondre à cette question. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1. Collingridge GL, Peineau S, Howland JG, Wang YT. Long-term depression in the CNS . Nat Rev Neurosci. 2010; ; 11 : :459.–473. 2. Collingridge GL, Isaac JT, Wang YT. Receptor trafficking and synaptic plasticity . Nat Rev Neurosci. 2004; ; 5 : :952.–962. 3. Amici M, Doherty A, Jo J, et al. Neuronal calcium sensors and synaptic plasticity . Biochem Soc Trans. 2009; ; 37 : :1359.–1363. 4. Mulkey RM, Herron CE, Malenka RC. An essential role for protein phosphatases in hippocampal long-term depression . Science. 1993; ; 261 : :1051.–1055. 5. Peineau S, Taghibiglou C, Bradley C, et al. LTP inhibits LTD in the hippocampus via regulation of GSK3beta . Neuron. 2007; ; 53 : :703.–717. 6. Li Z, Jo J, Jia JM, et al. Caspase-3 activation via mitochondria is required for long-term depression and AMPA receptor internalization . Cell. 2010; ; 141 : :859.–871. 7. Nicolas CS, Peineau S, Amici M, et al. The Jak/STAT pathway is involved in synaptic plasticity . Neuron. 2012; ; 73 : :374.–390. 8. Levy DE, Darnell JE Jr. Stats: transcriptional control and biological impact . Nat Rev Mol Cell Biol. 2002; ; 3 : :651.–662. 9. Gao SP, Bromberg JF. Touched and moved by STAT3 . Sci STKE. 2006 ; pe:30.. 10. Kapitein LC, Yau KW, Gouveia SM, et al. NMDA receptor activation suppresses microtubule growth and spine entry . J Neurosci. 2011; ; 31 : :8194.–8209. |