| |
| Med Sci (Paris). 2012 April; 28(4): 381–387. Published online 2012 April 25. doi: 10.1051/medsci/2012284015.Les deux visages de p63, Janus de la famille p53 Claude Caron de Fromentel,1,2 Édith Aberdam,3,4 and Daniel Aberdam3,4* 1Inserm U1052, France 2CNRS 5286, France 3Inserm U633, université Paris Descartes, Genopole campus 1, 4, rue Pierre Fontaine, 91058 Évry, France 4INSERTECH, stem cell center, Technion, Haïfa, Israël 5Inserm U898, université de Nice-Sophia Antipolis, 28, avenue de Valombrose, 06107Nice, France |
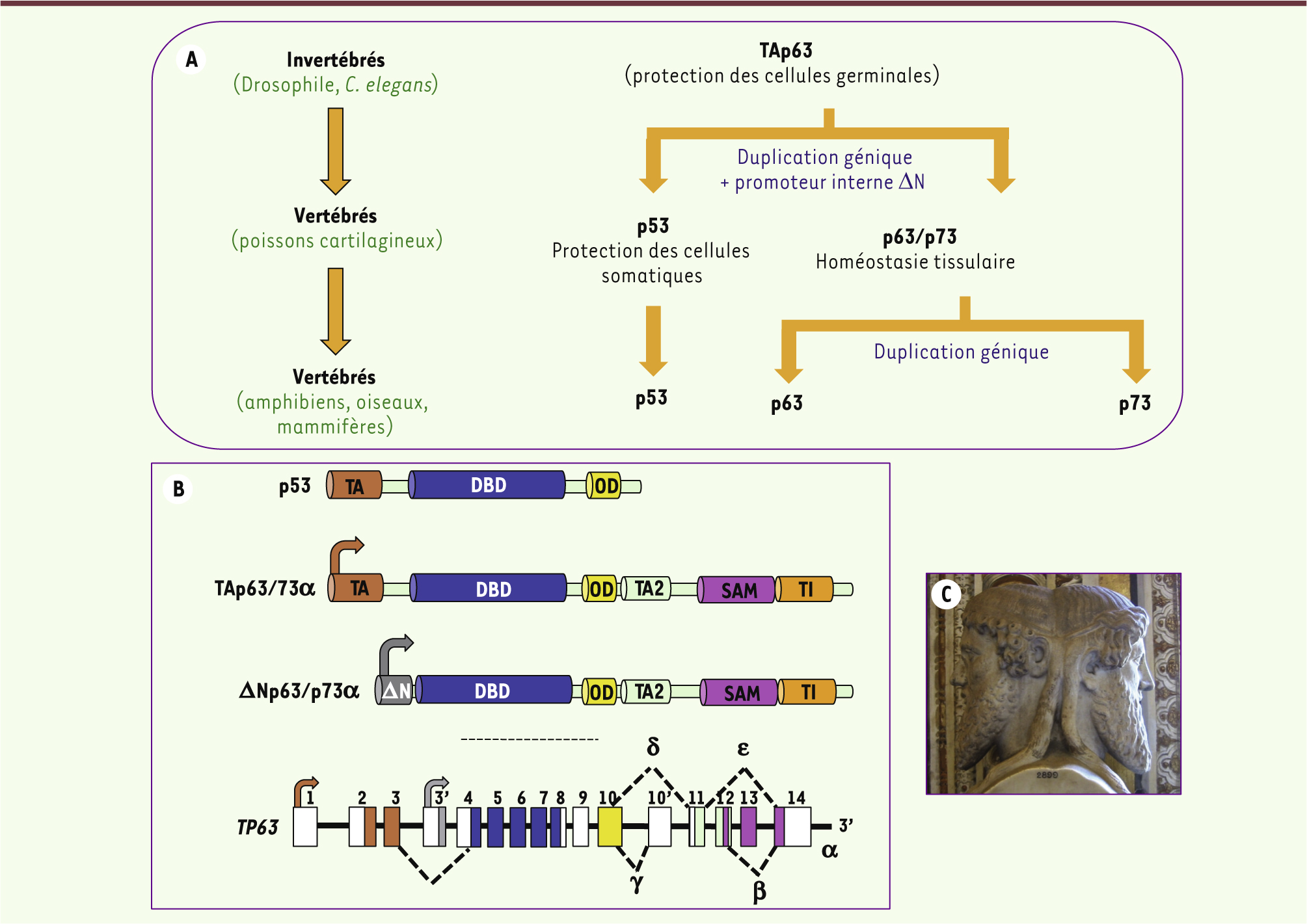
La notion de famille TP53 a été proposée il y a une quinzaine d’année, après la découverte de deux gènes homologues TP63 et TP73 [1]. En effet, les trois gènes TP53, TP63 et TP73 présentent de fortes homologies de séquence et de structure suggérant qu’ils dérivent d’un même gène (Figure 1A). Au cours de l’évolution, ce gène ancestral, dont TP63 est le plus proche, aurait subi deux duplications successives : la première donnant naissance à TP53, la seconde aboutissant à l’apparition de TP73 [2]. Ces événements ont eu lieu assez tard dans l’évolution puisque seuls les vertébrés possèdent les trois gènes (Figure 1A).
 | Figure 1.Les membres de la famille p53. A. Modèle d’évolution des membres de la famille p53. Une première duplication du gène ancêtre ( TAp63), présent chez les invertébrés, aurait engendré chez les mammifères le gène TP53 et les isoformes ΔN chez les vertébrés. Puis, une seconde duplication aurait produit le gène TP73. En termes de fonction, TAp63 serait une sorte de gardien de l’intégrité du génome des cellules germinales, fonction indispensable aux organismes inférieurs. L’apparition des isoformes ΔN et TP73 chez les vertébrés aurait permis de « complexifier » leur développement embryonnaire. Enfin, la longévité accrue des espèces exposant les organismes à l’émergence de tumeurs, a nécessité la création de TP53, gardien de l’intégrité du génome des cellules somatiques et, de ce fait, gène suppresseur de tumeur (adapté de [ 2]) B. Représentation des domaines structuraux des membres de la famille p53 ainsi que la structure du gène TP63. DBD : ΔNA binding domain ; OD : oligomerization domain ; SAM : sterile alpha motif ; TA : transactivation activating domain ; TI : transactivation inhibitory domain. C. Illustrant les fonctions et les régulations antagonistes des isoformes p63, la représentation de Janus, dieu grec aux deux visages. |
TP53 TP53 code pour un facteur de transcription composé d’un domaine de transactivation amino-terminal, d’un domaine central de liaison à l’ADN suivi d’un domaine d’oligomérisation et d’une région régulatrice en carboxy-terminal (Figure 1B) [ 3]. En conditions normales, p53 est sous forme latente. En réponse à un stress, la protéine est stabilisée et activée par des modifications post-traductionnelles et peut alors moduler le taux et l’activité de nombreuses protéines. Cette modulation est essentiellement transcriptionnelle. p53 est ainsi capable d’induire l’arrêt du cycle cellulaire en phases G1 et G2, la réparation de l’ADN et l’apoptose. L’effet suppresseur de tumeur de p53 s’exerce également via l’inhibition de l’angiogenèse et de la formation des métastases ou encore via l’induction de la sénescence. En revanche, p53 est peu impliquée dans la différenciation cellulaire et le développement. Différentes isoformes courtes de p53 ont été identifiées ces dernières années. Elles sont produites à partir de deux promoteurs, d’un codon d’initiation interne, et/ou par épissage alternatif. Ces isoformes ont des profils d’expression et des fonctions différents et peuvent interagir avec les membres p63/p73 de la famille p53, impliquant un degré de complexité dans les fonctions relatives de chaque membre, comme le décrit une excellente revue parue récemment [ 3]. Les isoformes TAp73 et ΔNp73 TP73 est à l’origine de l’expression de plusieurs isoformes dont l’organisation générale est similaire à celle de p53. La présence de deux promoteurs permet la transcription de deux types d’isoformes : TAp73, qui possède un domaine de transactivation complet, et ΔNp73, dont le domaine de transactivation est tronqué (Figure 1B). p73 exerce un rôle majeur au cours du développement des systèmes nerveux et olfactif, et de la différenciation neuronale. De plus, TAp73 est impliquée dans l’arrêt du cycle cellulaire et l’apoptose lors de la réponse à un stress génotoxique [ 4]. Les isoformes TAp63 et ΔNp63 Comme les autres membres de la famille p53, TP63 peut générer les isoformes TAp63 et ΔNp63 à partir de deux promoteurs distincts, et les isoformes α, β, γ, δ et e par épissage alternatif en 3’ de l’ARNm (Figure 1B). Le domaine de transactivation en amino-terminal de TAp63 est absent dans ΔNp63. Cette dernière possède néanmoins une activité transcriptionnelle, conférée par un domaine amino-terminal qui lui est propre. L’activité transactivatrice de TAp63 est modulée de façon complexe par un mécanisme d’oligomérisation. En effet, p63 est active sous forme de tétramère tout comme p53 et p73. Les différentes isoformes peuvent former des hétéro-oligomères entre isoformes de p63 mais aussi avec p73 et certains mutants ponctuels de p53 [ 5]. Comme nous le verrons plus loin, les fonctions des isoformes TAp63 et ΔNp63 sont totalement différentes et souvent antagonistes - comme leurs régulations - ce qu’illustre la statue de Janus, dieu grec aux deux visages qui, d’après Ovide, « observe en même temps l’orient et l’occident et règne sur la Terre et sur le Ciel » (Figure 1C). |
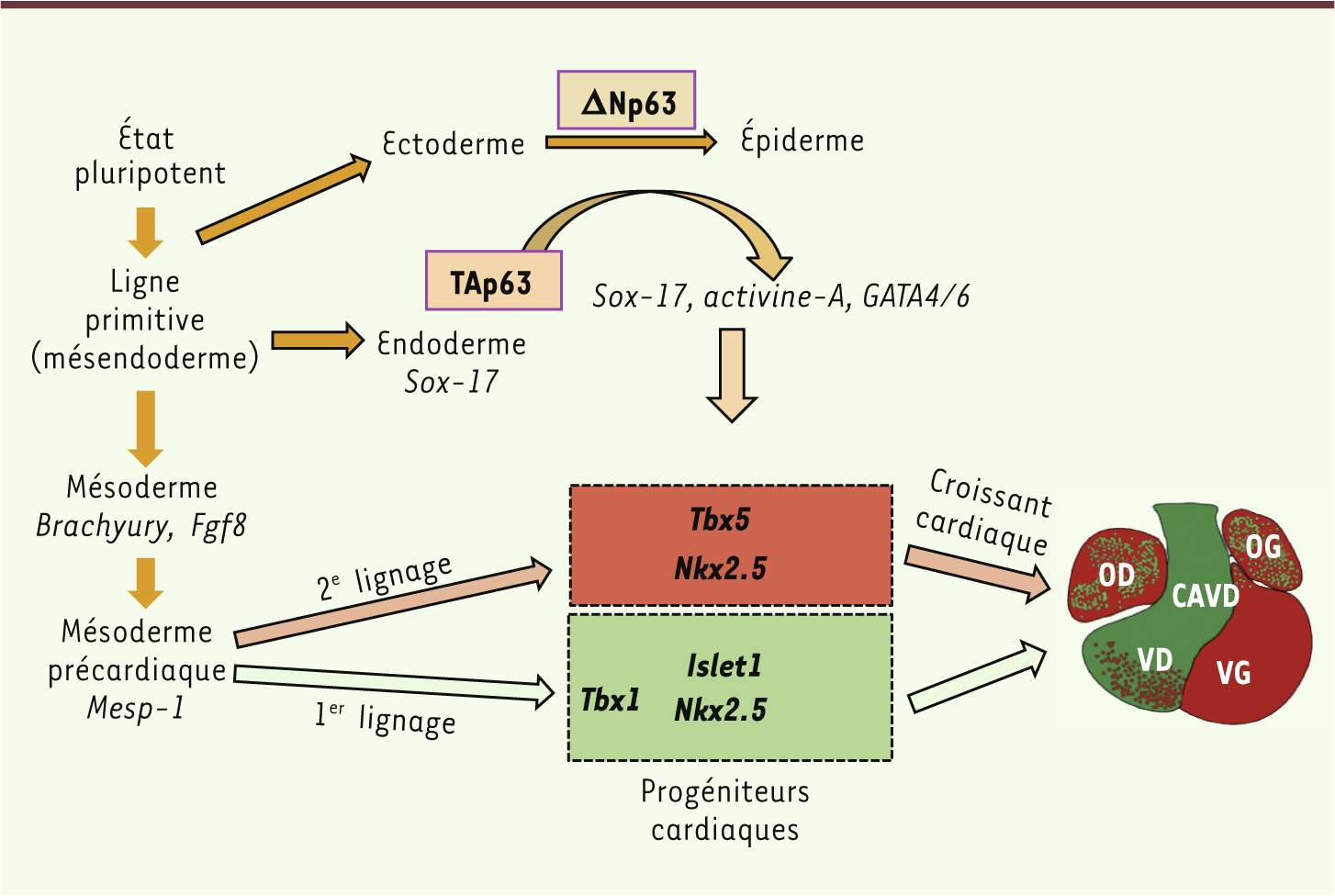
Fonctions de p63 au cours du développement ΔNp63 et développement épidermique TP63 est impliquée dans le développement embryonnaire, comme le démontre la présence de mutations germinales de TP63 chez des patients atteints de dysplasies ectodermiques (DE) sévères [ 6]. Ces syndromes ont un mode de transmission autosomique dominant et se caractérisent par plusieurs anomalies liées au développement des membres, des dérivés de l’ectoderme (poils, peau, dents, ongles, glandes sudoripares et mammaires) et de la face (fente labiopalatine). De manière remarquable, la position de chaque mutation sur le gène TP63 détermine le type de dysplasie ectodermique, et donc de syndrome [ 6]. Ceci est apparemment dû au contrôle, pour chaque mutant, de gènes cibles différents [ 7]. Ce phénotype lié à des défauts de l’ectoderme embryonnaire caractérise les souris invalidées pour TP63. Ces souris sont dépourvues d’épithélium cutané, de membres, d’épithéliums malpighiens et d’appendices épithéliaux dérivés de l’ectoderme. L’absence de membres est due au blocage du développement de la crête apicale ectodermique, bourgeon qui permet la croissance du membre le long de l’axe proximodistal. L’absence de barrière cutanée semble être responsable de la mort des nouveau-nés par déshydratation [8, 9]. Au cours du développement cutané, l’expression de ΔNp63 est activée par le morphogène bone morphogenetic protein 4 (BMP4), facteur essentiel à la spécification épidermique du neuroectoderme [10]. Dès sa production par les progéniteurs ectodermiques, ΔNp63 induit leur engagement épidermique [11,12] tout en réprimant l’engagement mésodermique [13]. Des études récentes montrent que p63 contrôle les gènes du développement DLX5/DLX6, essentiels à la formation des membres et dont l’expression est perturbée chez les patients atteints de dysplasies ectodermiques [14]. TAp63 et développement cardiaque L’utilisation de cellules souches embryonnaires (CSE) comme modèle du développement précoce nous a permis de découvrir une fonction totalement ignorée de TAp63 dans le développement cardiaque. TAp63 est exprimée très tôt par les cellules de l’endoderme primitif. Ces cellules, en contact avec le mésoderme sous-jacent, induisent de manière paracrine la différenciation des progéniteurs du lignage mésocardiaque en sécrétant des facteurs cardiogéniques dont l’expression est contrôlée par TAp63. Les CSE murines tap63-/- ne produisent plus de cardiomyocytes. Cet effet est réversible lorsque les cellules mutées sont cocultivées avec des CSE sauvages, ou que de l’activine-A est ajoutée au milieu [ 15]. Curieusement, les souris tp63-/- ont été étudiées par de nombreux laboratoires, mais aucune pathologie cardiaque n’a été décrite à ce jour. Intrigués, nous avons analysé ces souris et découvert, en total accord avec nos études in vitro, que les embryons tp63-/- souffrent d’une cardiopathie sévère et d’une altération de la contractilité, ce qui peut expliquer la forte létalité prénatale [ 15]. Les défauts morphologiques et moléculaires cardiaques observés sur les embryons précoces et in vitro suggèrent que l’absence de p63 perturbe les deux lignages cardiaques, et notamment la spécification et/ou la prolifération des progéniteurs, avant même la migration de ces derniers au sein de la ligne primitive et la formation du croissant cardiaque (Figure 2). Plus d’un tiers des embryons tap63-/- meurent très tôt au cours du développement, probablement de déficience cardiaque. En modifiant le fond génétique de ces souris, la mortalité disparaît [ 16]. Cela semble indiquer que la fonction de p63 dépend d’autres gènes qui moduleraient son effet. Cette découverte pose la question d’un lien entre p63 et des cardiopathies congénitales. A priori, aucune anomalie cardiaque n’a été décrite chez les patients porteurs de dysplasies ectodermiques, mais des déficiences ont pu passer inaperçues. De même, aucune mutation des exons/introns spécifiques de TAp63 susceptible d’expliquer certaines cardiopathies congénitales d’origine inconnue n’a été identifiée à ce jour [ 17].
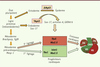 | Figure 2. Représentation schématique du rôle des isoformes p63 au cours du développement embryonnaire. L’isoforme ΔNp63, exprimée par les précurseurs ectodermiques, induit leur différenciation en cellules épidermiques. L’isoforme TAp63, produite par des précurseurs endodermiques sox-17+, contrôle l’expression de facteurs cardiogéniques. À leur tour, ceux-ci modulent l’expression de gènes cardiaques du premier (vert) et second (rouge) lignage, aboutissant à la formation du croissant cardiaque et des différentes portions du cœur embryonnaire. CAVD : chambre artérielle du ventricule droit ; VD et VG : ventricule droit et gauche ; OD et OG : oreillette droite et gauche. |
|
Fonction proapoptotique de TAp63 TAp63 possède une activité proapoptotique similaire à celle qu’exerce p53 et se fixe sur la séquence consensus des gènes cibles de p53. Après un dommage à l’ADN, TAp63 s’accumule dans la cellule et, par exemple, induit l’arrêt du cycle cellulaire via WAF1/CIP1 (codant pour la protéine p21), ou l’apoptose via BAX ou via les récepteurs de mort [5, 18–20]. L’interaction avec ΔNp63 ou d’autres membres de la famille p53 module cette activité proapoptotique [20]. ΔNp63 peut bloquer l’activité transcriptionnelle de TAp63 par compétition sur les mêmes éléments de réponse, ou par séquestration lorsque les deux protéines forment des hétérotétramères inactifs. D’autres gènes cibles de p53 peuvent être réprimés par TAp63 : par exemple certains gènes anti-apoptotiques comme HSP70 (heat shock protein-70) ou pro-prolifératifs comme CDK1 (cyclin dependent kinase-1) ou CCNB1 (cycline B1) [21, 22]. |
Fonction de TAp63 dans la protection des cellules germinales Juste après la naissance, tous les ovocytes primaires sont bloqués dans la prophase de la première division méiotique et ce, jusqu’à la puberté. Au-delà, quelques ovocytes primaires achèvent à chaque cycle leur première division méiotique, mais seuls de rares ovocytes (le plus souvent un seul) atteindront la deuxième division méiotique et seront prêts à être fécondés. Pendant cette longue période de quiescence (qui peut atteindre 50 ans chez la femme), TAp63, exprimée spécifiquement dans l’ovocyte, joue un rôle primordial dans le maintien d’un réservoir d’ovocytes en attente d’ovulation et de fécondation, et dans l’induction de l’apoptose d’ovocytes dont l’ADN a été endommagé [23]. Ce rôle protecteur dans la fonction ovarienne confère à TAp63 une fonction de gardien de la lignée germinale femelle [24]. Une nouvelle isoforme de p63 (GTAp63) vient d’être identifiée et joue le même rôle dans la lignée germinale mâle chez les primates [25]. |
Fonction de ΔNp63 et TAp63 dans l’homéostasie cutanée Alors que TAp63 régule l’apoptose, la sénescence et la stabilité génomique, ΔNp63 est impliquée dans des processus tels que la prolifération, l’adhésion et la différenciation cellulaires. ΔNp63 est nécessaire au maintien du potentiel prolifératif de la couche basale de l’épiderme et des kératinocytes en culture [26, 27]. De plus, elle contrôle le nombre de divisions asymétriques qui sont essentielles à la polarité des cellules épithéliales, à leur prolifération et à leur adhésion à la matrice extracellulaire [28]. Elle permet donc aux kératinocytes basaux d’enclencher un processus de stratification/différenciation concomitant à leur migration vers les couches suprabasales de l’épiderme [26]. ΔNp63 est sous le contrôle du microARN-203. L’équilibre entre les deux crée une balance entre prolifération et différenciation [29, 30]. Il est à noter que même si TAp63 est peu exprimée dans l’épiderme, l’expression relative des deux isoformes semble nécessaire à l’homéostasie cutanée. ΔNp63 contrôle l’adhésion des cellules épithéliales. L’invalidation de TP63 dans ces cellules provoque leur détachement du support et leur mort. Plusieurs gènes cibles de p63 codent pour des protéines impliquées dans l’adhésion cellule-cellule (P-cadhérine, p53 apoptosis effector related to PMP-22 [Perp]), cellule-matrice (intégrines a3, b4, a5 et a6, laminine g2) ou dans la jonction dermo-épidermique (Fraser syndrome 1 [Fras1]). L’expression de protéines directement liées aux kératines (dystonine et cytokératine 14 [ck14]) est également modulée par TAp63 et ΔNp63 [31]. TAp63 est exprimée par les cellules souches de la papille dermique (skin progenitor ou SKP). Elle participe directement à la survie des cellules souches du derme, mais aussi à celle des cellules épidermiques via un effet paracrine, et son absence augmente la prolifération et le vieillissement prématuré des cellules souches dermiques et épidermiques chez la souris [16]. In vitro, TAp63 protège les cellules de la sénescence prématurée [16]. Cet effet à distance de TAp63 est donc commun à ses fonctions dans le développement cardiaque et le maintien des cellules souches cutanées. Il est intéressant de noter que les SKP de la papille dermique sont originaires de la crête neurale, comme les cellules endodermiques cardiogéniques TAp63+ présentes dans l’embryon précoce. Il est vraisemblable que les deux proviennent d’un progéniteur commun et que les SKP puissent avoir conservé une activité cardiogénique. |
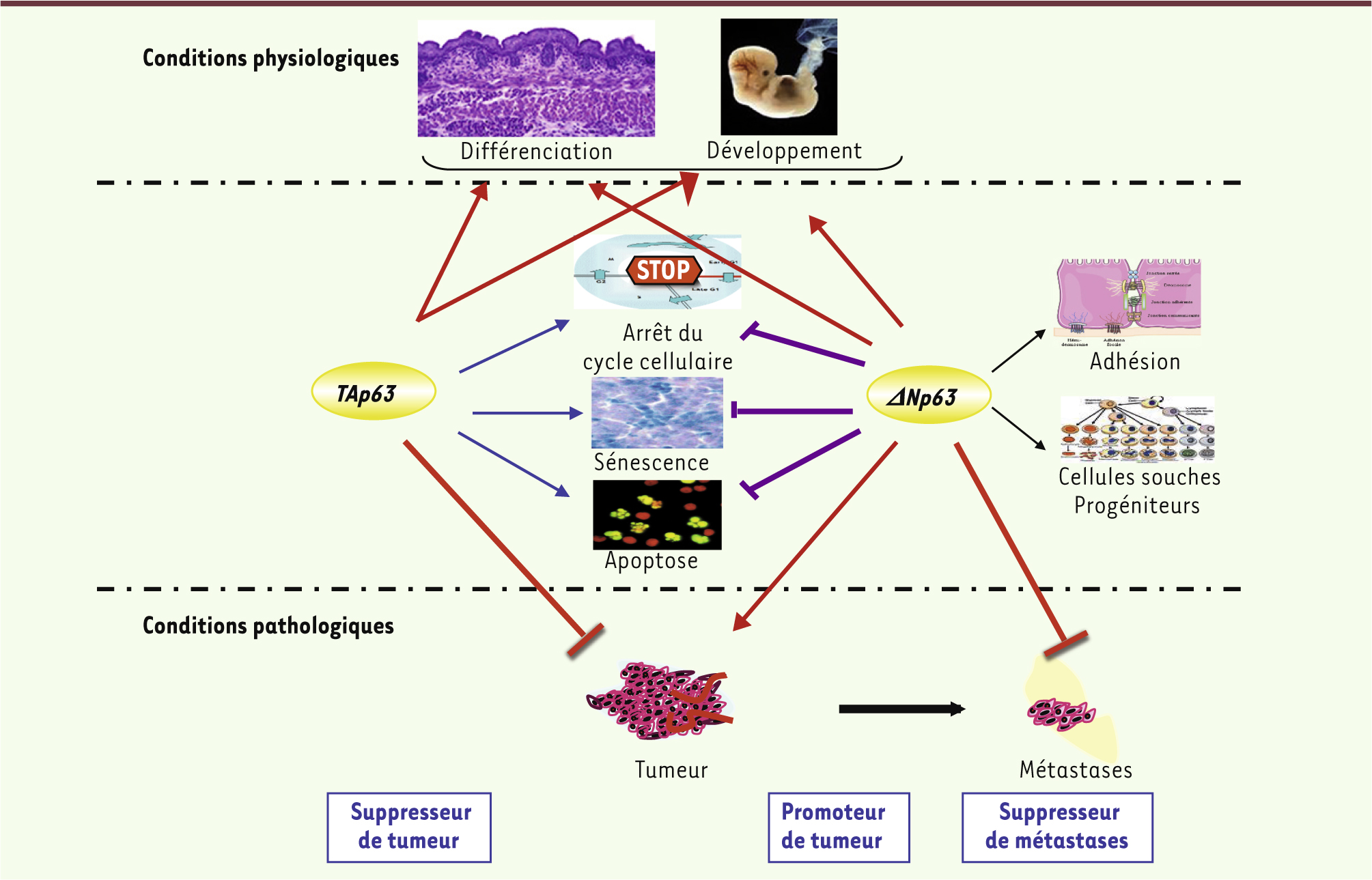
De nombreux articles ont mis en évidence la capacité de p53, TAp63 et TAp73 à induire les systèmes de sauvegarde cellulaire (arrêt du cycle cellulaire, apoptose et sénescence induite par un oncogène - dite prématurée) et celle de ΔNp63 et ΔNp73 à bloquer cette induction (Figure 3). Ces activités permettent de classer TAp63 dans les suppresseurs de tumeur et ΔNp63 dans les oncogènes.
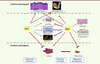 | Figure 3. Principales fonctions de TAp63 et ΔNp63 au cours du développement, chez l’adulte et au cours de la tumorigenèse. |
ΔNp63 et tumorigenèse Contrairement à TP53, le gène TP63 n’est pas muté dans les cancers humains. En revanche, son expression est altérée dans de nombreuses tumeurs dérivées des épithéliums stratifiés (de 50 à 100 % des cas, selon les auteurs), tels que les carcinomes épidermoïdes de la tête et du cou (HNSCC), de l’œsophage et du poumon. Cette surexpression est également observée dans des tumeurs issues d’épithéliums glandulaires, comme les cancers du sein et de la prostate de type basal -like ([ 32] pour revue). L’isoforme surexprimée est majoritairement ΔNp63, peut-être parce que le promoteur à l’origine de cette isoforme est modulé par p53, la b-caténine et STAT3 ( signal transducer and activator of transcription 3), des facteurs souvent altérés dans les tumeurs [ 33]. En revanche, pratiquement aucune étude n’a porté sur l’extrémité carboxy-terminale de ΔNp63. En fait, des différences dans l’isoforme surexprimée (a, b ou g) pourraient expliquer les données contradictoires obtenues dans les études qui visent à déterminer si la surexpression de ΔNp63 influe sur la réponse des cellules tumorales aux traitements. L’expression de ΔNp63 varie au cours de l’évolution des lésions : dans le poumon, elle est faible dans les hyperplasies, elle augmente dans les métaplasies et les dysplasies, pour atteindre une expression maximale dans les dysplasies de grade sévère. En accord avec cette observation, des travaux récents suggèrent que ΔNp63 est impliquée dans l’évolution maligne d’autres lésions précancéreuses, comme la chéilite actinique ou la leucoplasie [34]. En outre, pour cette dernière, l’expression de ΔNp63 semble être un marqueur pronostique, puisque la survie sans cancer des patients porteurs d’une lésion précancéreuse négative pour ΔNp63 est plus longue que celle des patients dont la lésion est positive pour ΔNp63 [35]. L’étude de souris génétiquement modifiées pour les isoformes de TP63 a révélé des résultats souvent contradictoires sur la fonction de p63 dans la progression tumorale. Les souris tp63+/-
produites par l’équipe de Flores sont propices à former des tumeurs agressives [36] alors que celles de Mills et Bradley n’en font pas spontanément, même lorsque le gène tp53 est délété aussi [37]. p63, invasion et métastases Concernant le rôle de TAp63 dans la formation des métastases, les résultats chez la souris sont là aussi contradictoires. En effet, les souris invalidées pour l’isoforme TAp63 développent de nombreuses tumeurs métastatiques dans l’étude de Flores [ 16], mais pas dans celle de McKeon [ 23]. Cette fonction antimétastatique de TAp63 passerait par le contrôle de Dicer - enzyme qui clive les ARN précureurs des microARN - et de microARN [ 38]. Il est probable que les différences entre lignées murines soient dues à des différences de fonds génétiques ou de techniques d’inactivation du gène. TAp63 contrôle également le trafic intracellulaire des intégrines et du récepteur à l’EGF ( epidermal growth factor), et donc l’invasion tumorale. Cet effet est neutralisé par certains mutants de p53 [ 39]. ΔNp63 est, elle aussi, impliquée dans l’invasion, ainsi que dans la prolifération des cellules tumorales. Mais, paradoxalement, plusieurs articles ont montré qu’elle ne facilite pas la formation des métastases. Bien au contraire, dans un certain nombre de cas, la perte de l’expression de ΔNp63 semble être nécessaire à l’apparition de ces dernières. En effet, dans les carcinomes du poumon, de l’œsophage et de la vessie, et les HNSCC, l’expression de TP63 (en général ΔNp63) est associée à une réduction de l’invasion et de la formation de métastases. En revanche, dans le cancer du sein, l’inhibition comme la promotion des métastases ont été décrites [ 5, 32]. L’implication de ΔNp63 dans la formation des métastases fait probablement intervenir son rôle dans l’adhésion cellulaire et sa capacité à s’opposer à la transition épithéliomésenchymateuse (TEM), un processus considéré comme nécessaire au détachement de la cellule tumorale et à sa migration vers d’autres organes [40]. Il a d’ailleurs été montré que Snail, une protéine impliquée dans la TEM, inhibe l’expression de ΔNp63 [41]. Le TGF-β (transforming growth factor-β), qui peut induire une TEM, inhibe l’activité de ΔNp63, mais pas son expression. En effet, en présence de TGF-β, la protéine Smad2 (small mothers against decapentaplegic homolog 2) est phosphorylée et peut former un complexe avec p53 (mutée) et ΔNp63, entraînant l’inactivation fonctionnelle de cette dernière. Les cellules dans lesquelles ΔNp63 est piégée dans ces complexes présentent un potentiel métastatique accru [42]. Ainsi, ΔNp63 semble se comporter comme un promoteur de tumeur, mais aussi comme un suppresseur de métastases. |
Comme nous venons de le voir, la protéine p63 exerce des fonctions primordiales pour le phénotype épithélial des cellules, leur vie, leur mort et leur capacité à interagir entre elles et avec l’environnement. Les fonctions et régulations spécifiques à chaque isoforme restent encore très mal connues et seules des études systématiques in vitro et in vivo permettront notamment de clarifier les bases moléculaires des symptômes dont souffrent les patients atteints de dysplasies ectodermiques et de rechercher des outils thérapeutiques. Il est possible, entre autres, que les résultats contradictoires obtenus chez les souris soient en partie dus à des taux intracellulaires différents de certaines isoformes de p63, mais également de leurs cousines p53 et p73. Quoi qu’il en soit, nos connaissances actuelles résumées dans cette revue indiquent clairement que le gène TP63 contrôle de multiples fonctions, souvent de manière antagoniste, que ce soit à l’état basal ou lors de la transformation cellulaire, un peu comme les deux faces de Janus, dieu du bien et du mal. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Ce travail a été soutenu par l’Union européenne (6e programme, réseau Epistem), l’Agence nationale pour la recherche (ANR blanc 06), l’Institut national de la santé et de la recherche médicale (Inserm) et l’Institut national du cancer (INCa).
|
1. Aylon Y, Oren M. New plays in the p53 theater . Curr Opin Genet Dev. 2011; ; 21 : :86.–92. 2. Belyi VA, Ak P, Markert E, et al. The origins and evolution of the p53 family of genes . Cold Spring Harb Perspect Biol. 2010; ; 2 : :a001198.. 3. Khoury MP, Bourdon JC. p53 Isoforms: an intracellular microprocessor? Genes Cancer. 2011; ; 2 : :453.–465. 4. Meyer G. p73: a complex gene for building a complex brain . Cell Cycle. 2011; ; 10 : :1188.–1189. 5. Melino G. p63 is a suppressor of tumorigenesis and metastasis interacting with mutant p53 . Cell Death Differ. 2011; ; 18 : :1487.–1499. 6. Rinne T, Brunner HG, van Bokhoven H. p63-associated disorders . Cell Cycle. 2007; ; 6 : :262.–268. 7. Rostagno P, Wolchinsky Z, Vigano AM, et al. Embryonic stem cells as an ectodermal cellular model of human p63-related dysplasia syndromes . Biochem Biophys Res Commun. 2010; ; 395 : :131.–135. 8. Mills AA, Zheng B, Wang XJ, et al. p63 is a p53 homologue required for limb and epidermal morphogenesis . Nature. 1999; ; 398 : :708.–713. 9. Yang A, Schweitzer R, Sun D, et al. p63 is essential for regenerative proliferation in limb, craniofacial and epithelial development . Nature. 1999; ; 398 : :714.–718. 10. Gambaro K, Aberdam E, Virolle T, et al. BMP-4 induces a Smad-dependent apoptotic cell death of mouse embryonic stem cell-derived neural precursors . Cell Death Differ. 2006; ; 13 : :1075.–1087. 11. Medawar A, Virolle T, Rostagno P, et al. DeltaNp63 is essential for epidermal commitment of embryonic stem cells . PLoS One. 2008; ; 3 : :e3441.. 12. Aberdam E, Barak E, Rouleau M, et al. A pure population of ectodermal cells derived from human embryonic stem cells . Stem Cells. 2008; ; 26 : :440.–444. 13. Shalom-Feuerstein R, Lena AM, Zhou H, et al. ΔNp63 is an ectodermal gatekeeper of epidermal morphogenesis . Cell Death Differ. 2011; ; 18 : :887.–896. 14. Lo Iacono N, Mantero S, Chiarelli A, et al. Regulation of Dlx5 and Dlx6 gene expression by p63 is involved in EEC and SHFM congenital limb defects . Development. 2008; ; 135 : :1377.–1388. 15. Rouleau M, Medawar A, Hamon A, et al. TAp63 is important for cardiac differentiation of embryonic stem cells and heart development . Stem Cells. 2011; ; 29 : :1672.–1683. 16. Su X, Paris M, Gi YJ, et al. TAp63 prevents premature aging by promoting adult stem cell maintenance . Cell Stem Cell. 2009; ; 5 : :64.–75. 17. Rouleau M, Pucéat M, Aberdam D. Fonction inattendue de p63 dans le développement cardiaque : un phénotype peut en cacher un autre . Med Sci (Paris). 2011; ; 27 : :905.–909. 18. Gressner O, Schilling T, Lorenz K, et al. TAp63 induces apoptosis by activating signaling via death receptors and mitochondria . EMBO J. 2005; ; 24 : :2458.–2471. 19. Petitjean A, Cavard C, Shi H, et al. The expression of TA and DeltaNp63 are regulated by different mechanisms in liver cells . Oncogene. 2005; : 24 : :512.–519. 20. Petitjean A, Ruptier C, Tribollet V, et al. Properties of the six isoforms of p63: p53-like regulation in response to genotoxic stress and cross talk with DeltaNp73 . Carcinogenesis. 2008; ; 29 : :273.–281. 21. Flores ER, Tsai KY, Crowley D, et al. p63 and p73 are required for p53-dependent apoptosis in response to DNA damage . Nature. 2002; ; 416 : :560.–564. 22. Wu G, Osada M, Guo Z, et al. DeltaNp63alpha up-regulates the Hsp70 gene in human cancer . Cancer Res. 2005; ; 65 : :758.–766. 23. Suh EK, Yang A, Kettenbach A, et al. p63 protects the female germ line during meiotic arrest . Nature. 2006; ; 444 : :624.–628. 24. Gonfloni S, Di Tella L, Caldarola S, et al. Inhibition of the c-Abl-TAp63 pathway protects mouse oocytes from chemotherapy-induced death . Nat Med. 2009; ; 15 : :1179.–1185. 25. Beyer U, Moll-Rocek J, Moll UM, Dobbelstein M. Endogenous retrovirus drives unknown proapoptotic p63 isoforms in the male germ line of humans and great apes . Proc Natl Acad Sci USA. 2011; ; 108 : :3624.–3629. 26. Truong AB, Kretz M, Ridky TW, et al. p63 regulates proliferation and differentiation of developmentally mature keratinocytes . Genes Dev. 2006; ; 20 : :3185.–3197. 27. Senoo M, Pinto F, Crum CP, McKeon F. p63 Is essential for the proliferative potential of stem cells in stratified epithelia . Cell. 2007; ; 129 : :523.–536. 28. Lechler T, Fuchs E. Asymmetric cell divisions promote stratification and differentiation of mammalian skin . Nature. 2005; ; 437 : :275.–280. 29. Lena AM, Shalom-Feuerstein R, Rivetti di Val Cervo P, et al. miR-203 represses stemness by repressing DeltaNp63 . Cell Death Differ. 2008; ; 15 : :1187.–1195. 30. Yi R, Poy MN, Stoffel M, Fuchs E. A skin microRNA promotes differentiation by repressing stemness . Nature. 2008; ; 452 : :225.–229. 31. Carroll DK, Brugge JS, Attardi LD. p63, cell adhesion and survival . Cell Cycle. 2007; ; 6 : :255.–261. 32. Graziano V, De Laurenzi V. Role of p63 in cancer development . Biochim Biophys Acta. 2011; : 1816 : :57.–66. 33. Ruptier C, De Gaspéris A, Ansieau S, et al. TP63 P2 promoter functional analysis identifies β-catenin as a key regulator of ΔNp63 expression . Oncogene. 2011; ; 30 : :4656.–4665. 34. Nylander K, Coates PJ, Hall PA. Characterization of the expression pattern of p63 alpha and delta Np63 alpha in benign and malignant oral epithelial lesions . Int J Cancer. 2000; ; 87 : :368.–372. 35. Saintigny P, El-Naggar AK, Papadimitrakopoulou V, et al. DeltaNp63 overexpression, alone and in combination with other biomarkers, predicts the development of oral cancer in patients with leukoplakia . Clin Cancer Res. 2009; ; 15 : :6284.–6291. 36. Flores ER, Sengupta S, Miller JB, et al. Tumor predisposition in mice mutant for p63 and p73: evidence for broader tumor suppressor functions for the p53 family . Cancer Cell. 2005; ; 7 : :363.–373. 37. Keyes WM, Vogel H, Koster MI, et al. p63 heterozygous mutant mice are not prone to spontaneous or chemically induced tumors . Proc Natl Acad Sci USA. 2006; ; 103 : :8435.–8440. 38. Su X, Chakravarti D, Cho MS, et al. TAp63 suppresses metastasis through coordinate regulation of Dicer and miRNAs . Nature. 2010; ; 467 : :986.–990. 39. Caron de Fromentel C, Maguer-Satta V. Quand les mutants de p53 se livrent à des trafics ! Med Sci (Paris). 2010; ; 26 : :814.–816. 40. Ansieau S, Caron de Fromentel C, Bastid J, et al. Role of the epithelial-mesenchymal transition during tumor progression . Bull Cancer. 2010; ; 97 : :7.–15. 41. Herfs M, Hubert P, Suarez-Carmona M, et al. Regulation of p63 isoforms by snail and slug transcription factors in human squamous cell carcinoma . Am J Pathol. 2010; ; 176 : :1941.–1949. 42. Adorno M, Cordenonsi M, Montagner M, et al. A Mutant-p53/Smad complex opposes p63 to empower TGFbeta-induced metastasis . Cell. 2009; ; 137 : :87.–98. |