| |
| Med Sci (Paris). 2012 April; 28(4): 363–365. Published online 2012 April 25. doi: 10.1051/medsci/2012284010.Nectine-4, une protéine clé pour la transmission du virus de la rougeole Mathieu Mateo1* and Marc Lopez2,3** 1Department of molecular medicine, Mayo Clinic, Rochester, Minnesota55902, États-Unis 2Inserm U1068, centre de recherche en cancérologie de Marseille (CRCM), Institut Paoli-Calmettes, 13009Marseille, France 3Université d’Aix-Marseille, 13284Marseille, France MeSH keywords: Animaux, Antigènes CD46, antagonistes et inhibiteurs , génétique, métabolisme, physiologie, Molécules d'adhérence cellulaire, Humains, Rougeole, transmission, Virus de la rougeole, Modèles biologiques, Thérapie moléculaire ciblée, méthodes, Thérapie virale de cancers, Libération de particules virales |
Le virus de la rougeole est un virus hautement contagieux transmis par aérosol. Le récepteur qui permet l’entrée et la propagation du virus dans l’organisme est connu : il s’agit de SLAM (pour signaling lymphocyte-activation molecule), une molécule exclusivement exprimée par les cellules du système immunitaire, expliquant le tropisme du virus de la rougeole. Cependant, aux étapes tardives de l’infection, le virus doit se répliquer dans les cellules épithéliales afin de sortir de l’organisme et d’assurer sa transmission. La nature du récepteur épithélial du virus de la rougeole, longtemps restée inconnue, vient d’être élucidée. Il s’agit de la nectine-4, une protéine qui, physiologiquement, est préférentiellement exprimée au niveau de l’appareil respiratoire, mais l’est aussi à des niveaux élevés dans certains cancers [15]. Cette avancée permet de mieux comprendre la biologie du virus de la rougeole et ouvre aussi de nouvelles perspectives dans le cadre des virothérapies oncolytiques comme deux autres textes le discutent dans ce numéro (→) [16, 17]. (→) Voir l’éditorial de G. Lemay, page 339, et la synthèse de Y. Touchefeu et al., page 388 de ce numéro |
Les récepteurs du virus de la rougeole Le premier récepteur du virus de la rougeole identifié a été la protéine CD46/MCP (membrane cofactor protein) [1, 2]. CD46 est exprimé de façon ubiquitaire sur toutes les cellules humaines (mais pas murines) et constitue un récepteur spécifique des souches vaccinales (→) [17]. Les récepteurs SLAM/CD150 [3] et nectine-4 [4, 5] sont quant à eux utilisés par les souches vaccinales et sauvages. La protéine SLAM est une protéine de la superfamille des immunoglobulines exprimée spécifiquement sur les cellules activées du système immunitaire [6]. La protéine nectine-4 fait aussi partie de la superfamille des immunoglobulines, comme nous l’avons décrit récemment dans ces colonnes [15] (Figure 1A). Elle est principalement exprimée dans la trachée où elle est un composant des jonctions adhérentes entre les cellules épithéliales [7]. Le cycle vital du virus de la rougeole repose sur l’utilisation séquentielle des récepteurs SLAM et nectine-4. (→)Voir la synthèse de Y. Touchefeu et al., page 388 de ce numéro
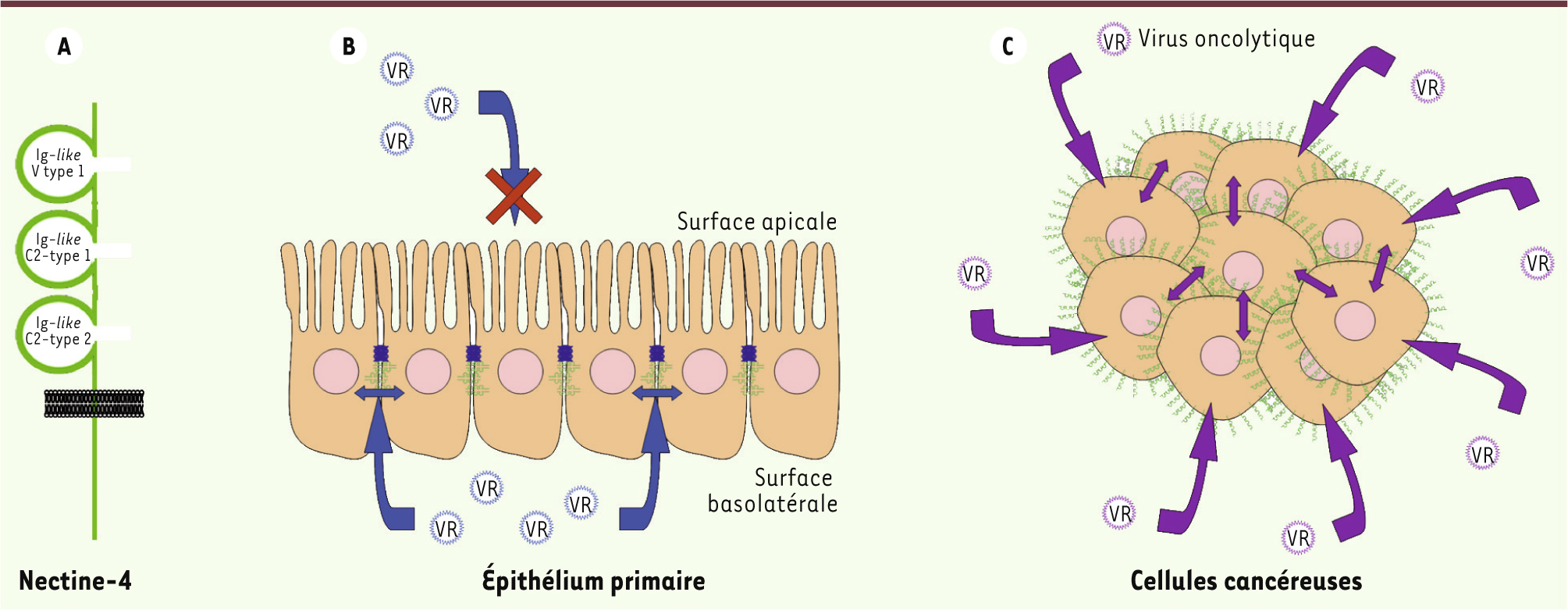
 | Figure 1. La protéine nectine-4 et son interaction avec le virus de la rougeole dans les tissus sains ou cancéreux. A. La protéine nectine-4 est une protéine transmembranaire : son ectodomaine est composé de trois domaines Ig (immunoglobuline)-like. B. Dans l’épithélium des voies respiratoires, la protéine nectine-4 est exprimée à la surface basolatérale des cellules ciliées où elle participe à la formation des jonctions adhérentes situées sous les jonctions serrées (bleu foncé). Les jonctions serrées empêchent l’accès du virus à nectine-4 par la voie apicale. Seule l’infection par la voie basolatérale est donc possible. La propagation du virus dans ces cellules est assurée de façon latérale, vraisemblablement via les jonctions adhérentes. C. Dans les cellules cancéreuses où la polarité épithéliale est altérée, la protéine nectine-4 est exprimée sur toute la surface cellulaire. L’accès d’un virus de la rougeole oncolytique au récepteur est donc facilité, ainsi que sa propagation dans les cellules tumorales. VR : virus de la rougeole. |
|
Le cycle vital du virus de la rougeole revisité Le virus de la rougeole pénètre dans l’organisme au niveau des voies respiratoires. Alors qu’on a longtemps cru que les cellules épithéliales étaient les premières cellules infectées, une étude récente a démontré qu’un virus de la rougeole « aveugle » vis-à-vis de l’épithélium reste pathogénique chez le singe, mais ne peut pas sortir de l’organisme [8]. D’après cette étude, l’infection des cellules épithéliales serait un événement tardif nécessitant l’interaction du virus avec un récepteur exprimé à la surface basolatérale de ces cellules. Il fut par la suite confirmé que les premières cibles de l’infection sont les cellules dendritiques et les macrophages alvéolaires qui « patrouillent » au niveau de l’épithélium et qui s’infectent via le récepteur SLAM [9, 10]. Ces cellules migrent vers les organes lymphoïdes et transmettent l’infection aux lymphocytes exprimant SLAM. Le virus de la rougeole se réplique alors très activement dans les lymphocytes, expliquant l’état d’immunodépression des patients infectés. S’ensuit une virémie qui coïncide avec l’apparition des premiers symptômes. C’est à cette étape du cycle vital que l’on note l’apparition de cellules épithéliales infectées au niveau de la trachée. L’étude publiée par l’équipe du Dr Cattaneo en collaboration avec la nôtre a récemment identifié nectine-4 comme le récepteur du virus de la rougeole au niveau des cellules épithéliales [4]. Comme attendu, ce récepteur est exprimé à la surface basolatérale des cellules épithéliales de l’appareil respiratoire et permet l’émergence du virus dans les voies respiratoires aux étapes tardives de l’infection [4]. Par ailleurs, cette étude montre que le virus de la rougeole possède une forte affinité pour la nectine-4, 4 à 5 fois supérieure à celle du virus pour le récepteur SLAM. Ainsi, le modèle proposé est le suivant : les cellules immunitaires infectées circulant dans l’organisme peuvent entrer en contact, au niveau de leur surface basolatérale, avec les cellules épithéliales respiratoires et leur transmettre le virus. Le virus se réplique alors dans ces cellules d’où il est relâché à la surface apicale, c’est-à-dire dans la lumière des voies respiratoires (Figure 1B). Ainsi, la toux et les éternuements qui apparaissent aux étapes tardives de l’infection favorisent la dissémination du virus dans l’air qui permet, in fine, l’infection d’un nouvel hôte. La protéine nectine-4 est le premier récepteur de virus identifié comme responsable de la dissémination extracorporelle ciblée d’un virus et, donc, du processus de contagion entre individus. |
Nectine-4, une cible pour les virus de la rougeole oncolytiques ? Outre son rôle dans la formation des jonctions adhérentes au sein de l’épithélium respiratoire, la protéine nectine-4 est exprimée à des niveaux anormalement élevés dans certains types de cancer. C’est notamment le cas dans les cancers du sein, de l’ovaire et du poumon [11–13]. Une autre étude ayant identifié la nectine-4 comme récepteur épithélial de la rougeole a également suggéré que cette protéine pourrait en plus être un marqueur du cancer du côlon [5]. Or, la souche vaccinale du virus de la rougeole est actuellement utilisée comme virus oncolytique dans des essais cliniques visant à traiter des cancers de l’ovaire [14, 17]. Les propriétés oncolytiques de ce virus ont été attribuées à sa capacité à infecter les cellules tumorales via CD46. En effet, tout comme la nectine-4, CD46 est exprimée à des niveaux élevés dans les cellules issues d’adénocarcinomes de l’ovaire. Les essais cliniques n’ont toutefois pas démontré de corrélation entre l’effet oncolytique du virus et le niveau d’expression de CD46 dans les tumeurs de patientes. De ce fait, il semble nécessaire de tester a posteriori le rôle de nectine-4 dans l’efficacité oncolytique. Nectine-4 pourrait être le récepteur majeur favorisant la propagation virale dans les tumeurs. De plus, la souche vaccinale du virus de la rougeole pourrait a priori constituer un outil de thérapie efficace pour le traitement d’autres cancers exprimant des niveaux élevés de protéine nectine-4. Dans les cellules épithéliales primaires polarisées, l’expression de nectine-4 est limitée aux jonctions adhérentes situées à la surface basolatérale. Dans les tumeurs d’origine épithéliale, caractérisées par une perte plus ou moins importante de polarité, l’expression de nectine-4 n’est de fait plus restreinte aux jonctions adhérentes, ce qui la rend plus accessible aux virus oncolytiques (Figure 1C). |
1. Dörig RE, Marcil A, Chopra A, Richardson CD. The human CD46 molecule is a receptor for measles virus (Edmonston strain) . Cell. 1993; ; 75 : :295.–305. 2. Naniche D, Varior-Krishnan G, Cervoni F, et al. Human membrane cofactor protein (CD46) acts as a cellular receptor for measles virus . J Virol. 1993; ; 67 : :6025.–6032. 3. Tatsuo H, Ono N, Tanaka K, Yanagi Y. SLAM (CDw150) is a cellular receptor for measles virus . Nature. 2000; ; 406 : :893.–897. 4. Mühlebach MD, Mateo M, Sinn PL, et al. Adherens junction protein nectin-4 is the epithelial receptor for measles virus . Nature. 2011; ; 480 : :530.–533. 5. Noyce RS, Bondre DG, Ha MN, et al. Tumor cell marker PVRL4 (nectin 4) is an epithelial cell receptor for measles virus . PLoS Pathog. 2011; ; 7 : :e1002240.. 6. Cocks BG, Chang CC, Carballido JM, et al. A novel receptor involved in T-cell activation . Nature. 1995; ; 376 : :260.–263. 7. Reymond N, Fabre S, Lecocq E, et al. Nectin4/PRR4, a new afadin-associated member of the nectin family that trans-interacts with nectin1/PRR1 through V domain interaction . J Biol Chem. 2001; ; 276 : :43205.–43215. 8. Leonard VH, Sinn PL, Hodge G, et al. Measles virus blind to its epithelial cell receptor remains virulent in rhesus monkeys but cannot cross the airway epithelium and is not shed . J Clin Invest. 2008; ; 118 : :2448.–2458. 9. Ferreira CS, Frenzke M, Leonard VH, et al. Measles virus infection of alveolar macrophages and dendritic cells precedes spread to lymphatic organs in transgenic mice expressing human signaling lymphocytic activation molecule (SLAM, CD150) . J Virol. 2010; ; 84 : :3033.–3042. 10. Lemon K, de Vries RD, Mesman AW, et al. Early target cells of measles virus after aerosol infection of non-human primates . PLoS Pathog. 2011; ; 7 : :e1001263.. 11. Derycke MS, Pambuccian SE, Gilks CB, et al. Nectin 4 overexpression in ovarian cancer tissues and serum: potential role as a serum biomarker . Am J Clin Pathol. 2010; ; 134 : :835.–845. 12. Fabre-Lafay S, Monville F, Garrido-Urbani S, et al. Nectin-4 is a new histological and serological tumor associated marker for breast cancer . BMC Cancer. 2007; ; 7 : :73.. 13. Takano A, Ishikawa N, Nishino R, et al. Identification of nectin-4 oncoprotein as a diagnostic and therapeutic target for lung cancer . Cancer Res. 2009; ; 69 : :6694.–6703. 14. Galanis E, Hartmann LC, Cliby WA, et al. Phase I trial of intraperitoneal administration of an oncolytic measles virus strain engineered to express carcinoembryonic antigen for recurrent ovarian cancer . Cancer Res. 2010; ; 70 : :875.–882. 15. Fournier G, Garrido-Urbani S, Reymond N, Lopez M. Nectines et nectines-like : marqueurs, acteurs et cibles de l’oncogenèse . Med Sci (Paris). 2010; ; 26 : :273.–279. 16. Lemay G. Apprivoiser nos ennemis pour en faire des alliés : la « virothérapie » anticancéreuse . Med Sci (Paris). 2012; ; 28 : :339.–340. 17. Touchefeu Y, Schick U, Harrington KJ. Le virus de la rougeole : un futur traitement en cancérologie ? Med Sci (Paris). 2012; ; 28 : :388.–394. |