| |
| Med Sci (Paris). 2012 April; 28(4): 360–362. Published online 2012 April 25. doi: 10.1051/medsci/2012284009.Migrations collectives de cellules mésenchymateuses Un facteur du complément à la rescousse Éric Theveneau1* 1University College London, Cell and Developmental Biology Department, London, Royaume-Uni MeSH keywords: Animaux, Adhérence cellulaire, génétique, physiologie, Mouvement cellulaire, Complément C3a, métabolisme, Inhibition de contact, Développement embryonnaire, Humains, Cellules stromales mésenchymateuses, Modèles biologiques, Crête neurale, cytologie |
Les migrations cellulaires sont essentielles au développement embryonnaire, à l’immunité et à la cicatrisation [1], et elles sont au cœur de la dissémination des cellules cancéreuses [2]. Les cellules peuvent s’engager dans des migrations solitaires ou collectives. Ces dernières impliquent une certaine coordination et une coopération des cellules [3, 4]. Jusqu’à présent, les migrations collectives étaient, pensait-on, restreintes aux cellules de type épithélial [4]. Des études récentes, portant sur les cellules de la crête neurale (CCN), remettent en cause ce modèle. En effet, ces études montrent que des cellules mésenchymateuses, qui n’établissent pas de contacts intercellulaires stables, peuvent aussi s’engager dans des migrations collectives [5–7]. |
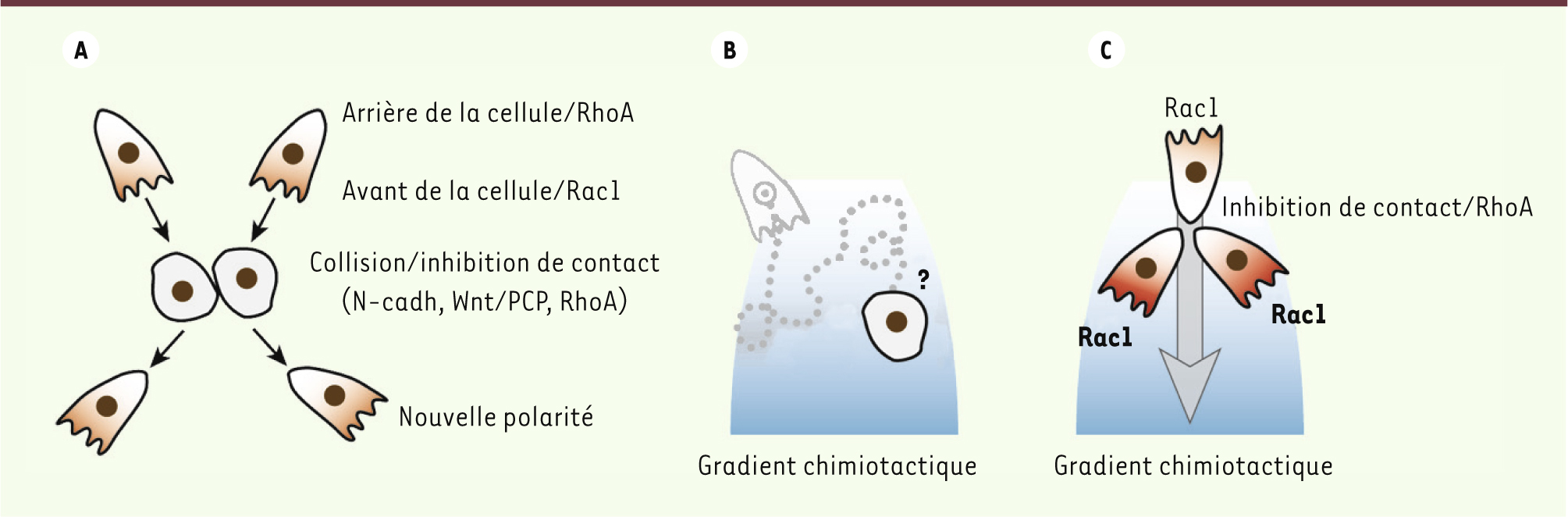
Migration collective des cellules de la crête neurale : l’inhibition de contact induit une polarisation utile au guidage Les CCN sont induites dans la partie dorsale de l’épithélium neural présomptif, à l’interface avec le futur épiderme [8]. Les CCN se séparent du neuroépithélium lors d’une étape de délamination qui implique une transition épithélium-mésenchyme (TEM), et elles entreprennent ensuite une vaste migration colonisant presque tous les tissus de l’embryon [8]. Une fois leur migration terminée, les CCN se différencient en de multiples dérivés : cellules pigmentaires, cellules gliales et neurones du système nerveux périphérique, cellules osseuses et du cartilage de la face, et cellules endocrines [9]. Lorsque ces cellules passent par une étape de TEM, elles perdent les jonctions intercellulaires qui les lient à leurs voisines. Il semblait donc évident que les CCN migraient de façon solitaire, chaque cellule se guidant grâce aux signaux présents le long des voies de migration. Cependant, lorsque deux CCN entrent en contact, elles se polarisent via un processus connu sous le nom d’inhibition de contact de locomotion [10]. Brièvement, lorsque les cellules entrent en collision, l’inhibition de contact entraîne la rétraction des structures motrices de la cellule (filopodes, lamellipodes) et un arrêt de migration suivi d’une repolarisation dans la direction opposée au contact (Figure 1A). Ceci favorise la migration des CCN vers des régions où leur densité est moindre. C’est donc une des forces intrinsèques de la migration des CCN. Plus intéressant encore, l’inhibition de contact et les molécules de guidage n’agissent pas en parallèle. Elles s’intègrent toutes deux dans un même processus de guidage collectif. En présence d’un gradient de chimioattractant, par exemple de Stromal cell-derived factor 1 (SDF1), les CCN isolées peinent à trouver leur chemin alors que les CCN en groupe s’orientent avec succès [5]. Dans ce système, SDF1 est par lui-même incapable de polariser les cellules et n’offre qu’une piètre information de guidage (Figure 1B). Lorsque les CCN sont présentes en forte densité, elles sont polarisées via l’inhibition de contact et les protrusions sont tournées vers l’extérieur (Figure 1C). SDF1 stabilise alors la polarité des cellules en augmentant l’activité de Rac1 (ras-related C3 botulinum toxin substrate 1) [5], une petite GTPase nécessaire à la formation et à la stabilité des lamellipodes [1]. La polarité des cellules proches de la source de l’attractant en est renforcée, ce qui favorise la migration du groupe vers cette source (Figure 1C).
 | Figure 1. La polarité induite par l’inhibition de contact favorise la dispersion et le guidage des cellules de la crête neurale. A. Les collisions entre CCN induisent l’inhibition de contact de locomotion dont l’activité dépend de la N-cadhérine (N-cadh) et de la voie Wnt non canonique PCP (planar cell polarity). Cette cascade active la petite GTPase RhoA (Ras homolog gene family member A) ce qui provoque une rétraction des protrusions et une repolarisation dans la direction opposée. B. Les cellules isolées peinent à s’orienter dans un gradient. C. À forte densité, les CCN présentent une polarité claire avec les protrusions à l’opposé des contacts. L’exposition à un gradient chimiotactique stabilise les protrusions faisant face aux fortes concentrations d’attractant, ce qui induit un mouvement directionnel (flèche). |
|
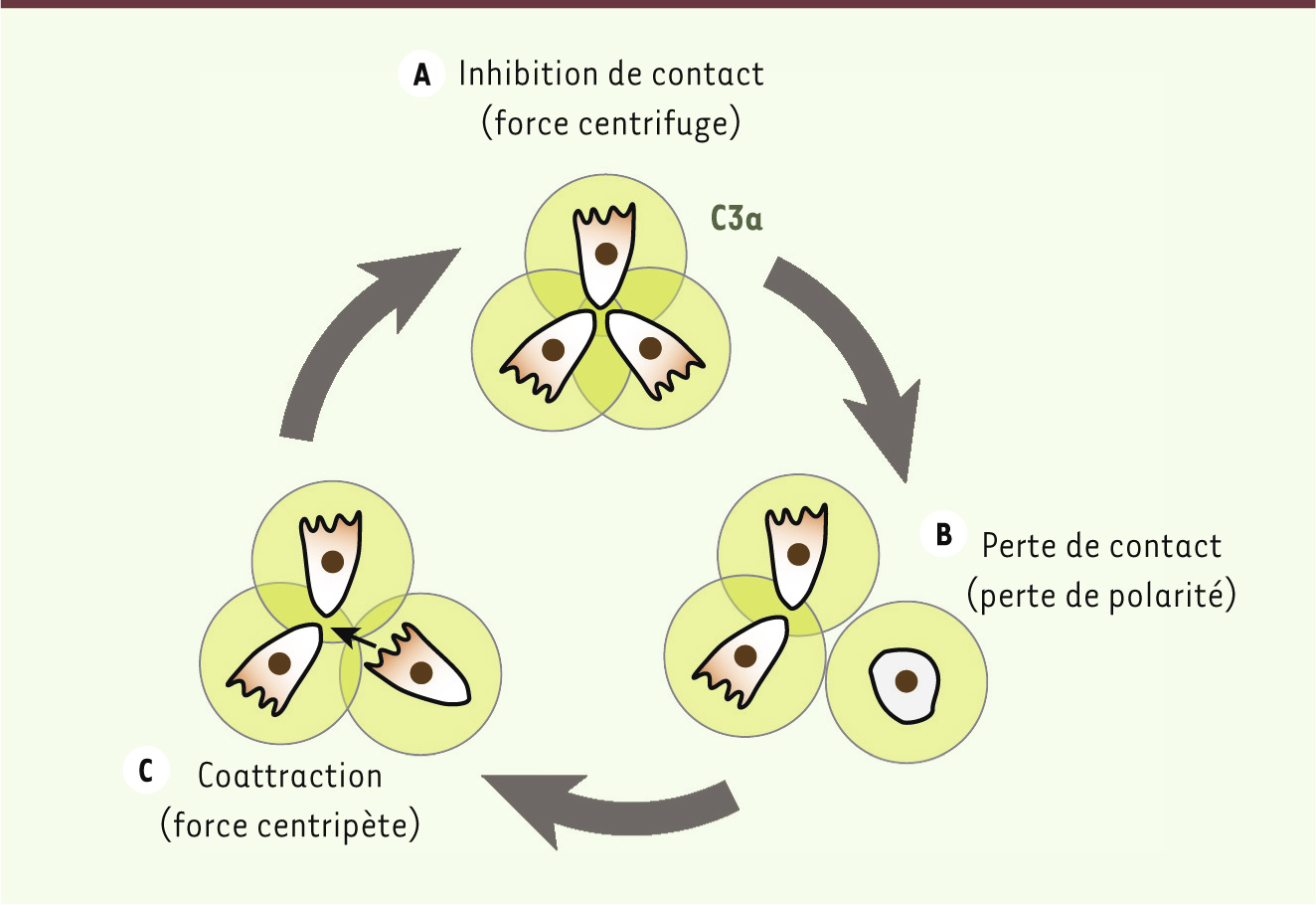
Le facteur du complément C3a intervient dans le comportement grégaire des CCN Un tel système ne fonctionne que si les cellules restent à proximité les unes des autres. Or, après avoir effectué leur TEM, les CCN n’ont plus de jonctions cellulaires stables. De plus, l’inhibition de contact favorise leur dispersion, réduisant ainsi progressivement la probabilité d’interactions transitoires entre CCN. Comment peuvent-elles dans ces conditions maintenir une densité cellulaire élevée au cours du temps ? Deux observations suggèrent que les CCN ont tendance à rester en groupe et donc, potentiellement, à détecter la présence d’autres CCN : chez l’embryon de poulet, on a observé que les CCN qui quittent les flux de migration y reviennent systématiquement [11]. D’autre part, les CCN à l’arrière de la population migratoire continuent de migrer avec le reste du groupe et ce malgré la présence d’un territoire permissif dans la direction opposée. Nous avons analysé récemment les mécanismes potentiels de ce comportement grégaire [6]. Nos travaux montrent que les CCN s’attirent mutuellement et que cet effet est dû au facteur du complément C3a et à son récepteur C3aR, tous deux coexprimés par les CCN. C3a est un élément de la cascade du complément, un acteur clé de la réponse immunitaire et son rôle de chimioattractant dans ce système est bien connu [12]. L’activation de C3a/C3aR dans les CCN favorise la formation de protrusions via l’activation de Rac1 [6]. La concentration locale de C3a est plus importante dans les zones où la densité de CCN est forte que dans les zones pauvres en CCN. Par conséquent, les CCN qui s’éloignent du groupe perdent progressivement la polarité que leur confèrent les interactions cellulaires, et sont repolarisées via l’action de C3a (Figure 2). Ce système de chimiotactisme paracrine, ou coattraction, permet aux CCN de concilier TEM et densité cellulaire élevée. Ceci a un effet double : s’opposer à la dispersion induite par l’inhibition de contact et promouvoir les collisions entre cellules. En effet, les cellules qui s’éloignent du groupe y sont rapatriées via la coattraction. Lorsqu’elles rejoignent le groupe, de nouveaux contacts repolarisent les cellules et le cycle dispersion regroupement se répète (Figure 2). Ceci explique comment des cellules mésenchymateuses peuvent s’engager dans des migrations collectives à long terme.
 | Figure 2. Le facteur du complément C3a favorise l’attraction mutuelle des cellules de la crête neurale. A. Groupes de CCN polarisées en fonction de leurs contacts intercellulaires qui favorisent une dispersion. Chaque cellule sécrète C3a (vert). B. Les cellules qui se détachent perdent leur polarité. C. Les cellules situées à distance se repolarisent vers les fortes concentrations de C3a ce qui provoque un regroupement des cellules. |
|
Les migrations collectives sont connues dans les cancers épithéliaux mais pourraient donc aussi se produire dans des tumeurs où un processus de TEM est fréquent. Par ailleurs, certaines tumeurs, telles que les gliomes, expriment des facteurs de croissance et leurs récepteurs associés [13]. Certaines de ces molécules ayant des effets chimioattractants (PDGF [plateled derived growth factor], VEGF [vascular endothelial growth factor], FGF [fibroblast growth factor]), il est possible que ces tumeurs puissent utiliser ces signaux comme attractants locaux. Ceci favoriserait le maintien d’une densité cellulaire critique qui augmenterait les chances de survie de la tumeur, mais permettrait aussi l’émergence d’un comportement collectif. Enfin, un tel rôle pour un facteur de la cascade du complément à des stades si précoces du développement embryonnaire, avant l’apparition du sang et du système immunitaire, est surprenant. Au-delà de son aspect anecdotique, ce résultat pourrait avoir une conséquence médicale : certains traitements médicaux dont les effets immunosuppresseurs font intervenir la cascade du complément seraient déconseillés chez les femmes enceintes et ce dès les premiers stades de la grossesse, donc bien avant l’apparition du système immunitaire. |
Je remercie Laure Coulombel pour son invitation à rédiger cette Nouvelle.
|
1. Ridley AJ, Schwartz MA, Burridge K, et al. Cell migration: integrating signals from front to back . Science. 2003; ; 302 : :1704.–1709. 2. Nguyen DX, Bos PD, Massague J. Metastasis: from dissemination to organ-specific colonization . Nat Rev Cancer. 2009; ; 9 : :274.–284. 3. Rorth P. Collective cell migration . Annu Rev Cell Dev Biol. 2009; ; 25 : :407.–429. 4. Friedl P, Gilmour D. Collective cell migration in morphogenesis, regeneration and cancer . Nat Rev Mol Cell Biol. 2009; ; 10 : :445.–457. 5. Theveneau E, Marchant L, Kuriyama S, et al. Collective chemotaxis requires contact-dependent cell polarity . Dev Cell. 2010; ; 19 : :39.–53. 6. Carmona-Fontaine C, Theveneau E, Tzekou A, et al. Complement fragment C3a controls mutual cell attraction during collective cell migration . Dev Cell. 2011; ; 21 : :1026.–1037. 7. Theveneau E, Mayor R. Can mesenchymal cells undergo collective cell migration? The case of the neural crest . Cell Adh Migr. 2011; ; 5 : :490.–498. 8. Theveneau E, Mayor R. Neural crest delamination and migration: From epithelium-to-mesenchyme transition to collective cell migration . Dev Biol. 2012 (sous presse).. 9. Le Douarin N, Kalcheim C. The neural crest . New York: : Cambridge University Press; , 1999 : :446. p. 10. Carmona-Fontaine C, Matthews HK, Kuriyama S, et al. Contact inhibition of locomotion in vivo controls neural crest directional migration . Nature. 2008; ; 456 : :957.–961. 11. Teddy JM, Kulesa PM. In vivo evidence for short- and long-range cell communication in cranial neural crest cells . Development. 2004; ; 131 : :6141.–6151. 12. Ricklin D, Hajishengallis G, Yang K, Lambris JD. Complement: a key system for immune surveillance and homeostasis . Nat Immunol. 2010; ; 11 : :785.–797. 13. Hoelzinger DB, Demuth T, Berens ME. Autocrine factors that sustain glioma invasion and paracrine biology in the brain microenvironment . J Natl Cancer Inst. 2007; ; 99 : :1583.–1593. |