| |
| Med Sci (Paris). 2012 March; 28(3): 264–266. Published online 2012 April 6. doi: 10.1051/medsci/2012283012.À l’origine du muscle, une histoire de baiser volé Anne C. Rios1* and Christophe Marcelle1 1Australian regenerative medicine institute, building 75, Monash university, Clayton campus, VIC 3800Clayton, Australie MeSH keywords: Animaux, Communication cellulaire, Embryon de poulet, Régulation de l'expression des gènes au cours du développement, Protéines et peptides de signalisation intracellulaire, physiologie, Protéines membranaires, Modèles biologiques, Cellules musculaires, cytologie, Développement musculaire, Muscles squelettiques, embryologie, Crête neurale, Récepteurs Notch, Transduction du signal, Peau, Somites |
Chez les vertébrés, les somites (structures mésodermiques transitoires) sont à l’origine de tous les muscles squelettiques du corps et des membres. La structure originelle des somites se présente sous la forme d’une sphère épithéliale au centre de laquelle se situe une cavité appelée somitocèle. Quelques heures après sa formation, le somite primitif se compartimentalise selon un axe dorsoventral : les cellules de la partie ventrale du somite subissent alors une transition épithéliomésenchymateuse (TEM). Le mésenchyme qui en résulte est appelé sclérotome. Il se différencie par la suite en cartilage axial et en os (vertèbres et côtes). Les cellules de la partie dorsale du somite, restées épithéliales, forment le dermomyotome. C’est un compartiment transitoire à l’origine des muscles squelettiques et du derme [1]. Le muscle primitif (ou myotome) se forme à partir du dermomyotome en deux étapes. Dans une première étape, les quatres bordures du dermomyotome épithélial génèrent le muscle primitif (appelé myotome primaire), qui est constitué de fibres musculaires mononucléées et postmitotiques appelées myocytes. Cette formation du myotome primaire met en jeu les cellules de la lèvre dorsomédiale du dermomyotome (DML), les plus proches du tube neural, qui migrent sous le dermomyotome où elles débutent un programme de différenciation myogénique et s’allongent selon l’axe antéro-postérieur jusqu’aux bordures de chaque somite [2, 3]. Puis les cellules des bordures caudale, rostrale et latérale accomplissent un processus de délamination similaire et forment à leur tour des myocytes, complétant ainsi la formation du myotome primaire. La génération de myocytes à partir des bordures du dermomyotome est un processus qui se poursuit pendant plusieurs jours, permettant ainsi le développement progressif du myotome. Dans une deuxième étape, qui se déroule environ 36 heures après la formation du somite, la partie centrale du dermomyotome subit une TEM rapide, au cours de laquelle les cellules du dermomyotome sont « parachutées » dans le myotome primaire où elles prolifèrent, ou bien se différencient en myocytes. Nous avons démontré que les cellules du dermomyotome constituent une population de progéniteurs musculaires permettant la croissance massive des muscles de l’embryon. Les cellules souches musculaires de l’adulte, appelées cellules satellites, sont également issues de cette même population de progéniteurs musculaires [4–6]. Nous nous sommes intéressés à la première étape de formation des muscles, qui démarre au niveau de la bordure médiale du dermomyotome (DML). Dans cette région, les cellules de la DML peuvent s’orienter vers deux destins cellulaires distincts : soit elles prolifèrent pour maintenir la structure épithéliale de la DML, soit elles passent dans le myotome pour y suivre un destin myogénique. Nous avons voulu comprendre quels signaux régulent cette balance entre prolifération et différenciation, et identifier les facteurs biologiques permettant ainsi de réguler la formation progressive du myotome primaire. |
Une activation transitoire de la voie de signalisation Notch est nécessaire à l’initiation de la myogenèse L’implication de la voie Notch dans les choix cellulaires associés à de nombreux paradigmes développementaux faisait de cette voie un excellent candidat à étudier. Au cours de notre travail, nous avons démontré que les progéniteurs de la DML activent la voie Notch de manière mosaïque (11 % des cellules activent la voie Notch) et que les cellules qui activent cette voie adoptent un destin myogénique. L’inhibition spécifique de la voie Notch arrête la myogenèse. Ceci constitue la première surprise de cette étude car au regard de la littérature importante, l’activation de la voie Notch est généralement associée à une inhibition de la myogenèse [7–9, 10]. Un autre résultat surprenant est que, pour activer la myogenèse, les cellules de la DML doivent certes activer la voie Notch, mais de manière transitoire. En effet, si l’activation de cette voie se prolonge, la myogenèse est bien induite dans un premier temps, mais ensuite les cellules reviennent « en arrière » à un état indifférencié. Si on sait depuis longtemps que les cellules des tissus reconnaissent l’état activé ou non d’une voie de signalisation, notre résultat démontre pour la première fois qu’en outre, elles peuvent interpréter l’aspect cinétique et en particulier transitoire de l’activation d’une voie de signalisation. Il serait évidemment intéressant d’évaluer si l’activation transitoire d’autres voies de signalisation s’accompagne d’effets nouveaux ou inattendus sur la différenciation cellulaire dans des contextes cellulaires divers. |
Les crêtes neurales régulent la myogenèse dans les somites via la voie de signalisation Notch Afin de remonter à la source de ce signal transitoire, nous nous sommes intéressés aux crêtes neurales. Cette population provient de la partie dorsale du tube neural et, après avoir subi une transition épithéliomésenchymateuse, migre de part et d’autre du tube neural en passant à proximité de la DML (Figure 1). La différenciation des crêtes neurales est le résultat d’une combinatoire de caractéristiques acquises avant leur émigration du tube neural (telle l’identité de position conférée par le code Hox) et des interactions avec leur environnement [10]. Pour la première fois, nous avons identifié les signaux tissulaires requis pour la mise en place des muscles dans le somite. Nous avons montré que la déplétion des crêtes neurales diminuait de manière drastique la myogenèse. Via un mécanisme tout à fait remarquable, les crêtes neurales exprimant la molécule Delta1 (un ligand des récepteurs Notch) interagissent pendant leur migration avec les cellules de la DML (qui expriment le récepteur Notch). Cette interaction entraîne l’activation temporaire de la voie Notch dans les cellules de la DML (Figure 2). Nous avons appelé ce nouveau mécanisme de signalisation dynamique le kiss and run (baiser volé).
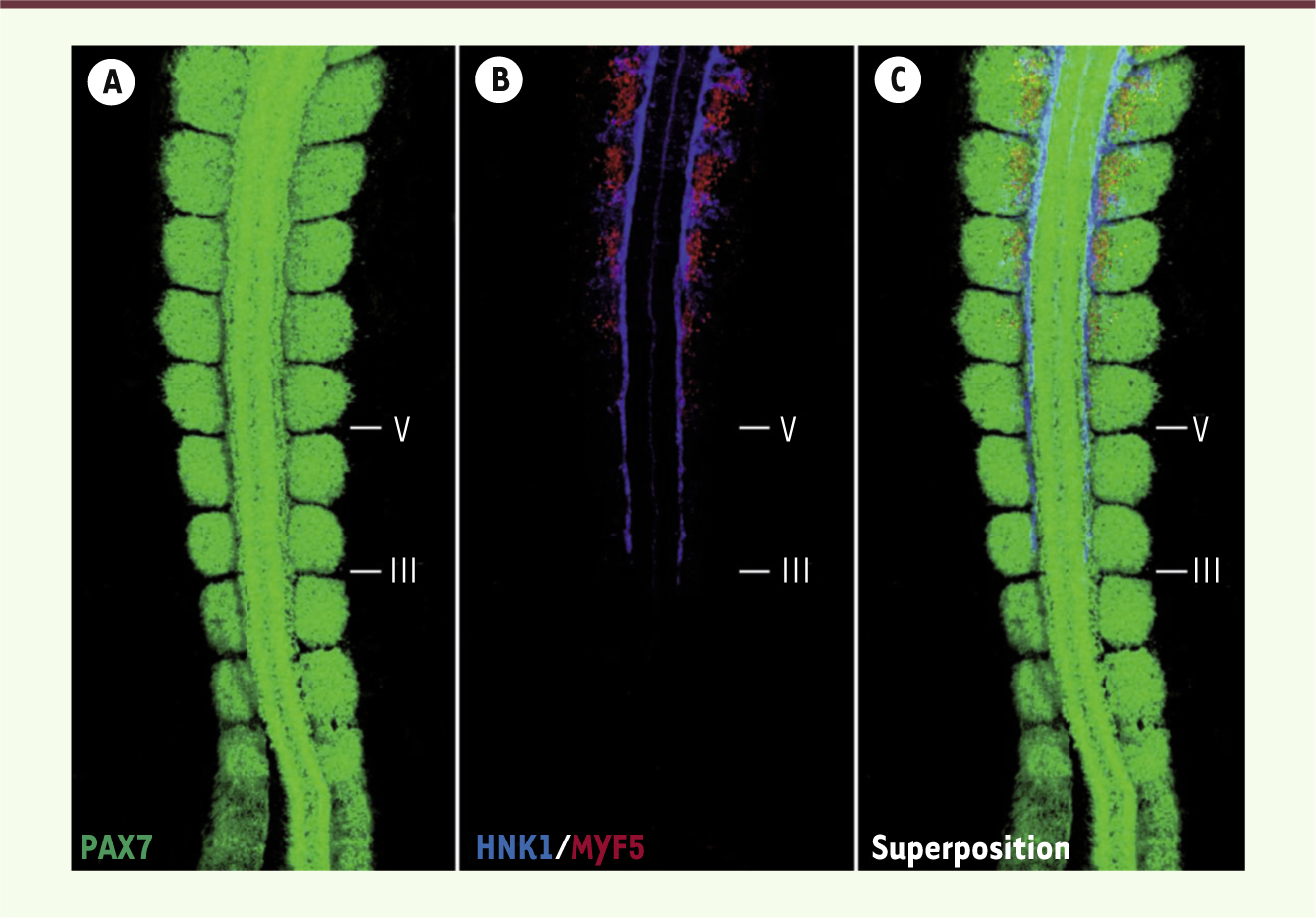
 | Figure 1.
Immunomarquage de la partie postérieure d’un embryon de poulet à 2,5 jours de développement. Immunomarquage du marqueur du dermomyotome Pax7 (en vert, A et C), du marqeur HNK1 des crêtes neurales (en bleu, B et C) and du marqueur de myogenèse précoce MYF5 (en rouge, B et C). Le marquage HNK1 débute au troisième somite formé (somite III), alors que le marquage de MYF5 débute deux somites au-delà, au somite V. Nous pouvons observer en B et C la proximité des crêtes neurales et des somites, ainsi que la formation symétrique des myotomes de part et d’autre du tube neural (marquage MYF5). |
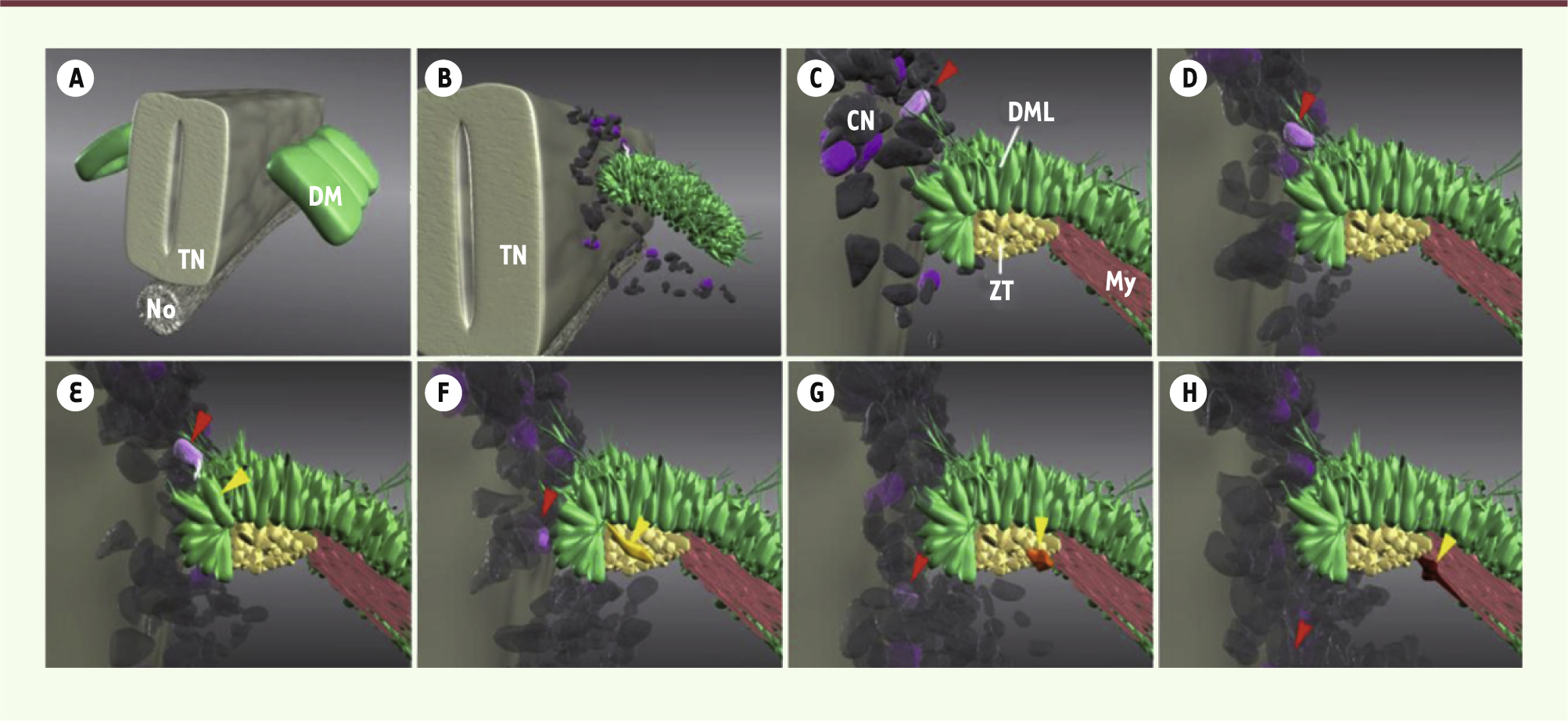
 | Figure 2.
Modèle représentant le mécanisme de kiss and run entre des cellules de crêtes neurales et de la DML. Les cellules des crêtes neurales (en violet) exercent une signalisation Delta1. On observe en C, D et E une cellule des crêtes neurales (flèche rouge) en contact physique avec une cellule épithéliale de la lèvre dorsomédiale du dermomyotome (DML, en vert). Après cette interaction directe, la voie Notch est activée dans la cellule de la DML (de couleur différente et indiquée par la tête de flèche jaune en E, F, G et H) qui déclenche le programme de myogenèse puis change de compartiment cellulaire pour accéder à une zone de transition (ZT) où l’activation de la voie Notch s’arrête et où la cellule s’engage dans la différenciation terminale dans le myotome pour devenir un myocyte (My). |
|
Une des conclusions importantes de notre travail est que les crêtes neurales ne se limitent pas à l’intégration de signaux importants pour leur développement. Elles participent également activement au développement des tissus environnants en leur fournissant des signaux essentiels pour leur différenciation. Une conséquence de l’interaction dynamique entre les crêtes neurales et les somites est le lien entre la migration des crêtes neurales et la formation du myotome. Jusqu’à maintenant, l’observation que le début du développement des crêtes neurales coïncidait avec celui de la formation du myotome n’était qu’une curiosité (Figure 1). Notre étude prouve désormais qu’il y a un lien mécanistique entre ces deux évènements. De plus, puisque le flot des crêtes neurales est symétriquement distribué des deux côtés du tube neural, il est fort probable que la remarquable synchronie de formation et de maturation des myotomes des deux côtés de l’embryon soit une conséquence directe de l’interaction entre les crêtes neurales et les somites. Enfin, la nature de l’interaction entre le récepteur Notch et le ligand Delta1 implique un contact physique entre les cellules donneuses (les crêtes neurales) et les cellules receveuses (les cellules de la DML). Ce mode de communication implique que le comportement migratoire des crêtes neurales portant le signal génère de façon dynamique une signalisation Notch dans le somite. Ce mécanisme est un exemple nouveau de communication dans lequel un signal porté et présenté par des cellules en migration induit un changement dans le destin cellulaire des cellules du tissu receveur. Ce mécanisme de kiss and run souligne l’importance des mouvements morphogénétiques et de la signalisation dynamique au cours de l’embryogenèse. La capacité de certains tissus et cellules à migrer est peut être un principe essentiel pour générer des flux d’activation permettant la différenciation spécifique de progéniteurs au sein de populations données. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1. Brent AE, Tabin CJ. Developmental regulation of somite derivatives: muscle, cartilage and tendon . Curr Opin Genet Dev. 2002; ; 12 : :548.–557. 2. Gros J, Scaal M, Marcelle C, et al. A two step mechanism for myotome formation in chick . Dev Cell. 2004; ; 6 : :875.–882. 3. Gros J, Manceau M, Thomé V, Marcelle C. A common somitic origin for embryonic muscle progenitors and satellite cells . Nature. 2005; ; 435 : :954.–958. 4. Gros J, Serralbo O, Marcelle C. WNT11 acts as a directional cue to organize the elongation of early muscle fibres . Nature. 2009; ; 457 : :589.–593. 5. Relaix F, Rocancourt D, Mansouri A, Buckingham M. A Pax3/Pax7-dependent population of skeletal muscle progenitor cells . Nature. 2005; ; 435 : :948.–953. 6. Kassar-Duchossoy L, Giacone E, Gayraud-Morel B, et al. Pax3/Pax7 mark a novel population of primitive myogenic cells during development . Genes Dev. 2005; ; 19 : :1426.–1431. 7. Vasyutina E, Lenhard DC, Birchmeier C. Notch function in myogenesis . Cell Cycle. 2007; ; 6 : :1450.–1453. 8. Hirsinger E, Malapert P, Dubrulle J, et al. Notch signalling acts in postmitotic avian myogenic cells to control MyoD activation . Development. 2001; ; 128 : :107.–116. 9. Schuster-Gossler K, Cordes R, Gossier A, et al. Premature myogenic differentiation and depletion of progenitor cells cause severe muscle hypotrophy in Delta1 mutants . Proc Natl Acad Sci USA. 2007; ; 104 : :537.–542. 10. Le Douarin NM, Kalcheim C. The neural crest. (2nd ed) , 2nd ed . Cambridge: : Cambridge University Press; , 1990 : 472 p. 11. Mayeuf A, Relaix F. La voie Notch : du développement à la régénération du muscle squelettique . Med Sci (Paris). 2011; ; 27 : :521.–526. |