| |
| Med Sci (Paris). 2012 March; 28(3): 250–254. Published online 2012 April 6. doi: 10.1051/medsci/2012283008.Rôle des facteurs de transcription FoxO dans la maintenance des cellules souches Pauline Rimmelé,1 Xin Zhang,1 and Saghi Ghaffari1,2,3,4* 1Department of developmental and regenerative biology 2Department of medicine division of hematology, oncology 3Black Family Stem Cell Institute 4Tisch Cancer Institute, Mount Sinai School of Medicine, 1425 Madison Avenue, New York, New York10029, États-Unis MeSH keywords: Cellules souches adultes, cytologie, Animaux, Apoptose, Blastocyste, Division cellulaire, Cytokines, physiologie, Altération de l'ADN, Métabolisme énergétique, Protéine O1 à motif en tête de fourche, Protéine O3 à motif en tête de fourche, Facteurs de transcription Forkhead, Régulation de l'expression des gènes au cours du développement, Gènes suppresseurs de tumeur, Cellules souches hématopoïétiques, Insuline, Protéines et peptides de signalisation intercellulaire, Souris, Modèles biologiques, Stress oxydatif, Cellules souches pluripotentes, Transduction du signal, Cellules souches |
Les avancées scientifiques dans le domaine des cellules souches ont favorisé les thérapies cellulaires visant à restaurer les fonctions d’un tissu ou d’un organe altérées par une pathologie ou par le vieillissement. Le remarquable potentiel thérapeutique des cellules souches est attribué à leurs deux propriétés majeures : l’autorenouvellement, qui désigne la capacité à se multiplier en donnant de nouvelles cellules souches, et la pluripotence, qui désigne la capacité à se différencier en tout type cellulaire d’un organisme. Ces dernières années, de nombreux acteurs moléculaires gouvernant la destinée des cellules souches ont été identifiés et nourrissent l’espoir d’une médecine régénérative. Parmi eux, les facteurs de transcription FoxO se sont imposés comme des molécules critiques pour le maintien des propriétés des cellules souches. |
Comprendre la maintenance des cellules souches, clé d’une perspective thérapeutique ? Les cellules souches embryonnaires, dérivées de la masse cellulaire interne d’embryons au stade blastocyste, et les cellules souches adultes, résidant dans la majorité des organes ou tissus adultes, constituent les deux grands types de cellules souches. Les cellules souches embryonnaires, pluripotentes, sont capables de se différencier en trois feuillets embryonnaires : endoderme, mésoderme et ectoderme, et d’engendrer tous les tissus de l’organisme adulte. Pour des raisons scientifiques et éthiques, l’utilisation des cellules souches embryonnaires humaines (CSEh) est limitée. En revanche, les avancées dans l’identification de régulateurs essentiels à leur pluripotence ont été à la base des stratégies de reprogrammation des cellules somatiques en cellules souches pluripotentes (iPS, induced pluripotent stem cells) [1, 2] et ont permis d’approfondir la compréhension de ce processus de reprogrammation, approche qui pourrait révolutionner la thérapie cellulaire. Même si elles n’ont pas un potentiel de différenciation aussi vaste que celui des cellules souches embryonnaires, les cellules souches adultes sont capables de générer un (unipotence) ou plusieurs (multipotence) lignages et de s’autorenouveler. Elles sont spécifiques des organes dans lesquels elles résident, et leur potentiel de différenciation est généralement limité aux cellules qui composent le tissu. Elles sont localisées dans un microenvironnement spécialisé appelé « niche » [20], qui contrôle leur prolifération, leur migration et leur différenciation. La majorité des cellules souches adultes sont maintenues dans un état quiescent que caractérisent une activité métabolique et des besoins en facteurs de croissance réduits. Bien que ce processus ne soit pas clairement compris, il a été postulé que la quiescence protège les cellules souches de potentielles agressions qui les endommageraient et leur permet de remplir leurs fonctions tout au long de la vie. Cependant, cette hypothèse ne semble pas toujours vérifiée. En revanche, il est clairement établi qu’une balance finement régulée entre quiescence et progression dans le cycle cellulaire assure le maintien du pool de cellules souches et une production adéquate des lignages différenciés. Une rupture de cet équilibre peut favoriser l’occurrence de maladies dégénératives et de processus tumoraux, tels qu’on les observe au cours du vieillissement. Ainsi, l’élucidation des mécanismes contrôlant la maintenance des cellules souches constitue t-elle une question fascinante qui ne peut que favoriser l’exploitation de leur potentiel thérapeutique. |
Les multiples fonctions des FoxO dans les cellules souches Remarquablement conservée au cours de l’évolution, la famille FoxO (Forkhead box O protein) qui comprend FoxO1, FoxO3, FoxO4, ubiquitaires, et FoxO6, spécifique des tissus neuronaux, a émergé ces vingt dernières années comme un acteur clé de la régulation de processus biologiques fondamentaux et variés. Les protéines FoxO ont été particulièrement étudiées pour leur rôle pivot dans la signalisation de l’insuline et des facteurs de croissance. Cibles majeures de la voie de signalisation PI3-kinase/AKT impliquée dans la régulation de la longévité (→) [21], elles traduisent la réponse aux stimulus environnementaux, stress oxydatif ou facteurs de croissance par exemple, en programmes d’expression de gènes spécifiques. Elles contrôlent ainsi la durée de vie d’un organisme et exercent un rôle suppresseur de tumeurs. Plus récemment, les FoxO ont été identifiées comme des régulateurs clés de la destinée des cellules souches embryonnaires et adultes. Cette fonction majeure semble liée à leur capacité de contrôler des processus cellulaires divers et opposés : prolifération, différenciation, réparation des dommages de l’ADN, résistance au stress oxydatif, métabolisme énergétique et apoptose [3, 4]. (→) Voir l’article de A. Brunet, page 316 de ce numéro |
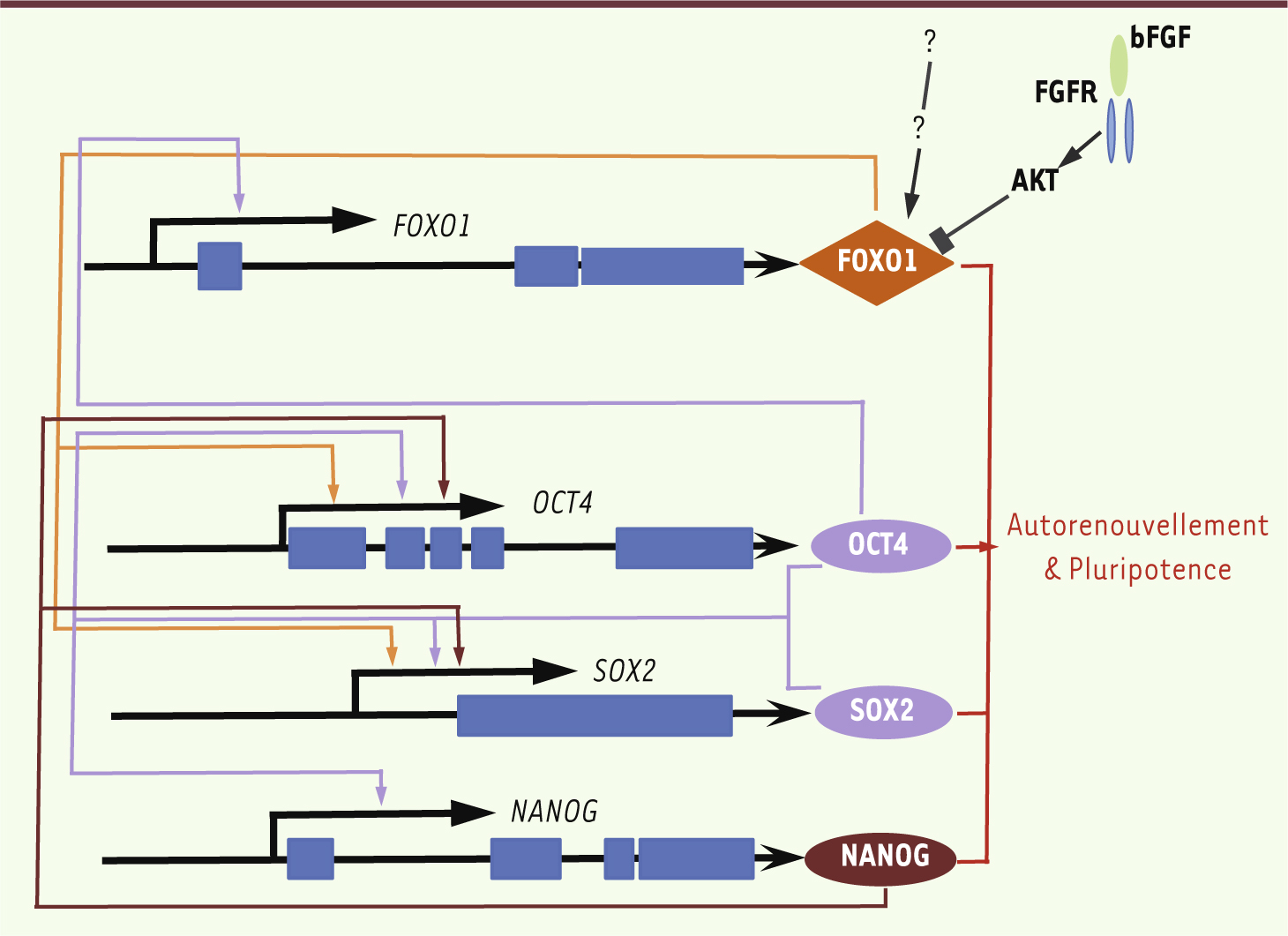
FoxO1, nouvel acteur clé de la pluripotence des cellules souches embryonnaires Le maintien de la pluripotence des CSE est assuré par une boucle régulatrice formée par OCT4, NANOG et SOX2, trois facteurs de transcription qui non seulement contrôlent leur propre expression, mais aussi activent des gènes gouvernant la pluripotence et répriment des gènes requis pour la différenciation cellulaire [5]. Dans ce contexte, nous avons identifié récemment un nouveau composant du réseau transcriptionnel des CSE : FoxO1 [6] (Figure 1). Nous montrons que FoxO1 est fortement exprimée dans les CSEh et dans les cellules ES murines (CSEm) indifférenciées (Figure 2) et que son expression diminue au cours de la différenciation. Afin de déterminer le rôle de FoxO1 dans la pluripotence des CSEh, nous avons invalidé ce facteur dans une lignée de CSEh via des shARN inductibles par la doxycycline. La diminution d’expression de FoxO1 dans les CSEh induit une perte de la morphologie et des marqueurs caractéristiques de cellules pluripotentes et une augmentation de l’expression des marqueurs spécifiques de l’endoderme et du mésoderme. Le phénotype initial pluripotent est restauré par la surexpression immédiate d’une forme de FoxO1 non reconnue par les shARN dans les CSEh préalablement traitées par la doxycycline, démontrant la spécificité des shARN anti-FoxO1 et le rôle majeur de FoxO1 dans la régulation de la pluripotence des CSEh. Compte tenu de la multiplicité fonctionnelle des protéines FoxO, nous avions envisagé qu’une altération des fonctions cellulaires des CSEh (prolifération, cycle cellulaire, apoptose ou statut redox) pouvait être responsable de la différenciation de ces cellules induite en l’absence de FoxO1. Toutefois, aucun de ces processus biologiques n’est modifié dans les CSEh exposées à la doxycycline. En revanche, des expériences d’immunoprécipitation de la chromatine, de gels retard et de tests luciférase ont montré que FoxO1 contrôle directement l’expression des gènes pluripotents OCT4 et SOX2, en occupant et activant leurs promoteurs respectifs (Figure 1). Notre étude met également en évidence quelques différences phénotypiques entre CSEh et CSEm pouvant refléter la différence temporelle entre les stades de développement embryonnaires chez la souris et chez l’homme [7]. Dans les CSEm, FoxO1 et 3 sont toutes deux capables de réguler l’expression de gènes pluripotents tandis que dans les CSEh, la surexpression de FoxO3 n’induit pas l’expression des facteurs de pluripotence. De plus, les gènes du développement, qui sont activés par la diminution d’expression de FoxO1 ou 3, diffèrent entre CSE humaines et murines. Ces observations excluent une redondance des fonctions des FoxO et révèlent le rôle spécifique de FoxO1 dans la régulation de la pluripotence des CSEh. Étant donné que l’expression de FoxO1 semble être régulée par OCT4 [5], ces résultats suggèrent que FoxO1 est un membre à part entière du réseau de pluripotence des cellules ES. De façon intéressante, des données non publiées de notre laboratoire suggèrent que FoxO3 intervient dans la différenciation des CSE (Zhang and Ghaffari, données personnelles). Notre hypothèse de travail stipule qu’une interaction fonctionnelle entre FoxO1 et 3 pourrait assurer l’équilibre entre pluripotence versus différenciation dans les CSEh.
 | Figure 1. FoxO1 et la régulation de la pluripotence. Le trio de facteurs de transcription OCT4, NANOG et SOX2 constitue la base du réseau transcriptionnel qui maintient la pluripotence et l’autorenouvellement des CSE. Ces facteurs forment une boucle régulatrice contrôlant leur propre expression. FoxO1 a été identifié comme un nouveau membre de ce réseau : il contrôle directement l’expression des gènes pluripotents OCT4 et SOX2, occupant et activant leurs promoteurs respectifs. Le mécanisme de régulation de FoxO1 dans les CSE n’est pas clairement défini mais ne semble pas dépendre uniquement de la voie PI3K/AKT. Les exons sont représentés par des rectangles bleus |
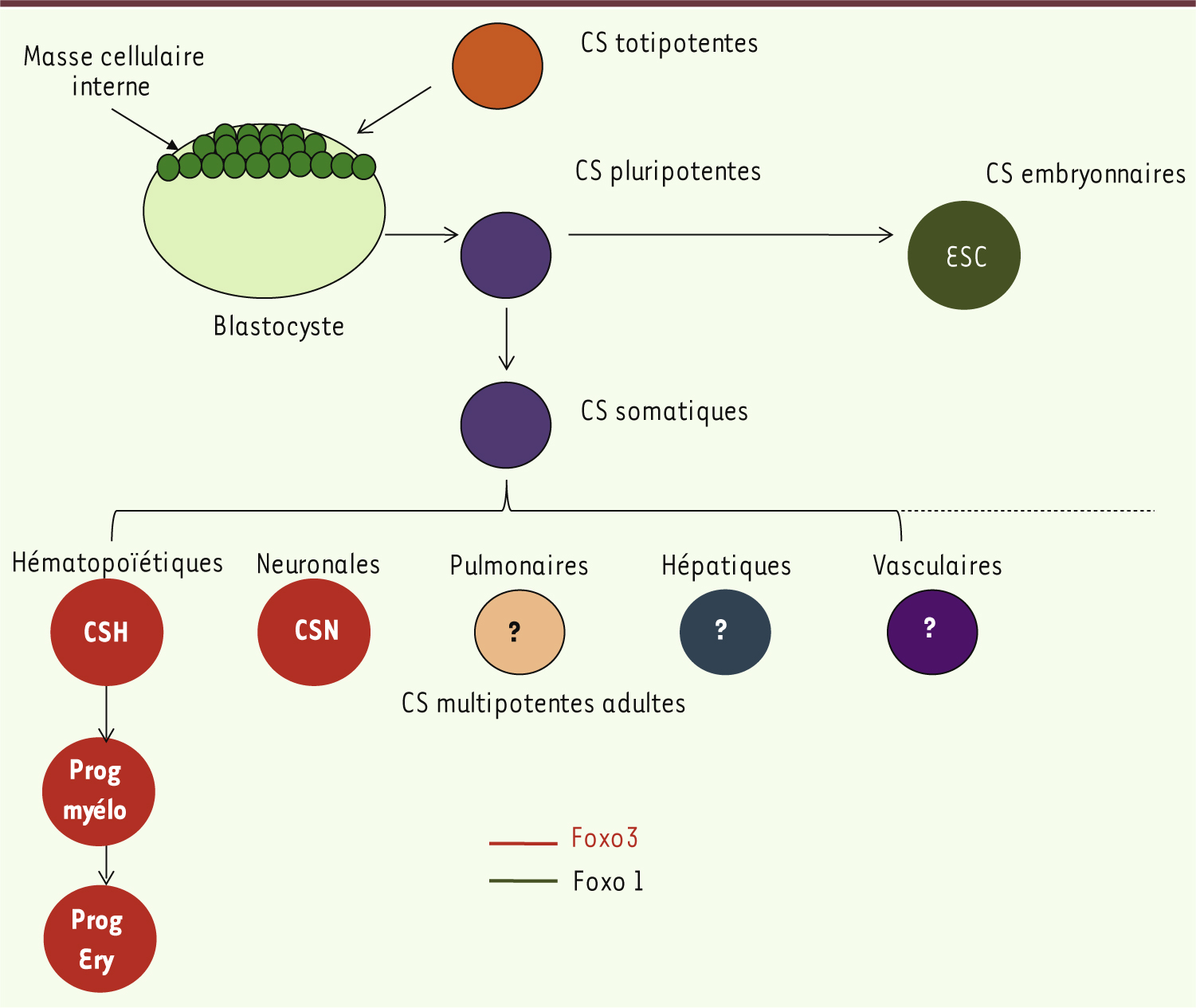
 | Figure 2. Rôle de FoxO1 (vert) et de FoxO3 (rouge) dans la conservation des propriétés des cellules souches embryonnaires et adultes respectivement. CSH : cellules souches hématopoïétiques; CSN : cellules souches neurales. Prog myélo : progéniteurs myélocytaires; Prog Ery : progéniteurs érythrocytaires. |
Cette nouvelle fonction des FoxO ne semble pas limitée à un seul membre de la famille Forkhead. En effet, le rôle de FOXP1 dans l’activation de plusieurs gènes pluripotents dont OCT4 et NANOG, a été caractérisé récemment dans les CSE [8], confortant le rôle fonctionnel essentiel des Forkhead dans la maintenance des CSE. Les CSE sont capables de proliférer in vitro de manière illimitée tout en conservant leur pluripotence, un processus encore mal compris. FoxO1 pourrait coordonner la pluripotence et la régulation du cycle cellulaire des CSE. Nous pouvons également supposer que son rôle dans le métabolisme, la longévité ou la réponse aux dommages de l’ADN, influence la pluripotence des CSE. Ainsi, la fonction de FoxO1 dans la régulation de la pluripotence peut être exploitée pour faciliter ou améliorer la reprogrammation des cellules somatiques en cellules souches embryonnaires. |
FoxO3, régulateur essentiel de la quiescence des cellules souches adultes Les cellules souches hématopoïétiques (CSH) représentent une petite population cellulaire localisée dans la moelle osseuse et responsable de la production de toutes les lignées sanguines. Nos travaux ainsi que ceux d’autres groupes ont démontré un rôle spécifique de FoxO3 dans la régulation du pool des CSH. L’invalidation simple de FoxO3 (FoxO3KO)chez la souris mime quasiment le phénotype observé dans les souris invalidées pour les trois protéines FoxO1, FoxO3 et FoxO4 [9–12]. Chez les souris FoxO3KO, le compartiment des CSH est diminué et la quiescence des CSH abolie. FoxO3 préserve le pool des CSH en contrôlant le cycle cellulaire et le niveau du stress oxydant. De façon intéressante, nous démontrons que FoxO3 régule aussi la voie de réponse au stress oxydant dans les progéniteurs myéloïdes, en empêchant leur expansion via l’inhibition de la voie de signalisation AKT/mTOR (target of rapamycine) [12] (Figure 3). Un rôle de FoxO3 dans la maintenance des progéniteurs érythroïdes a aussi été identifié (Figure 2). Au-delà du système hématopoïétique, FoxO3 intervient dans d’autres populations de cellules souches : l’invalidation de FoxO3 induit un défaut du pool des cellules souches neurales adultes, diminue leur autorenouvellement et leur capacité à se différencier en lignages neuronaux spécifiques [14, 15] (Figure 2).
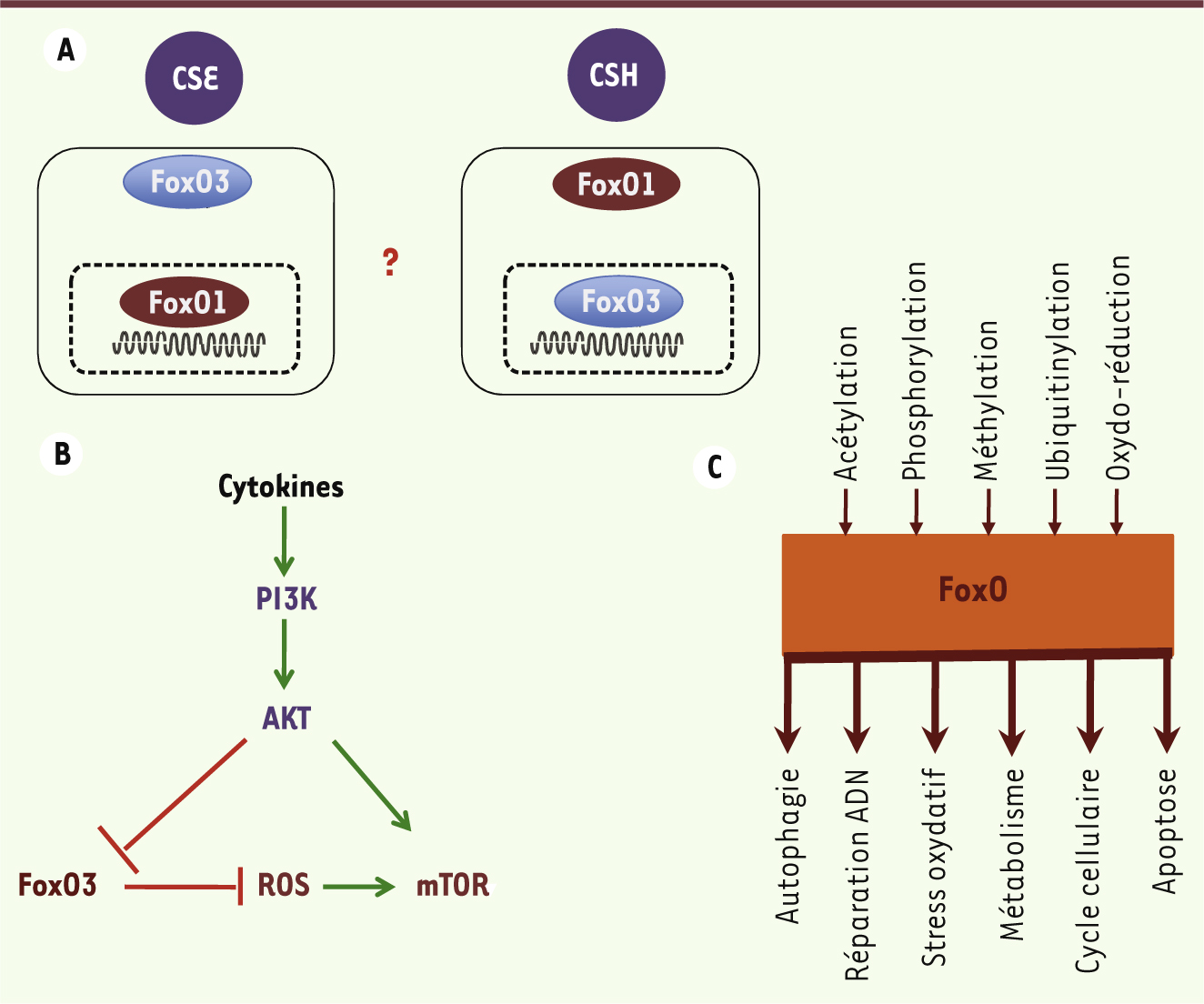
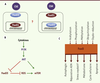 | Figure 3. La diversité des rôles des FoxO. A. Dans les cellules souches embryonnaires (CSE) humaines, l’expression de FoxO1 est nucléaire tandis que celle de FoxO3 est cytoplasmique. Dans les cellules souches hématopoïétiques (CSH), FoxO3 est localisée dans le noyau tandis que FoxO1 est majoritairement cytoplasmique. Ces données suggèrent des mécanismes de régulation distincts parmi les FoxO. B. L’activité transcriptionnelle et la stabilité des FoxO dans les cellules souches sont régulées négativement par la kinase AKT qui, activée, phosphoryle ces facteurs de transcription. Dans les progéniteurs hématopoïétiques, FoxO3 régule le niveau de stress oxydant en inhibant la voie de signalisation AKT/mTOR. C. Schéma des modifications qui contrôlent l’activité de FoxO (en amont) et les fonctions de FoxO (en aval). De façon générale, des mécanismes impliquant des modifications post-traductionnelles telles que la phosphorylation, l’acétylation, l’ubiquitinylation ou des modifications d’oxydoréduction, ont été identifiés. |
|
Régulation des FoxO dans les cellules souches L’action des FoxO est gouvernée à plusieurs niveaux. En réponse à l’insuline ou aux facteurs de croissance, la kinase AKT activée phosphoryle les FoxO nucléaires et relaie leur translocation dans le cytoplasme où elle les séquestre, bloquant leur activité nucléaire. À l’inverse, en conditions de stress, la phosphorylation des protéines FoxO par des kinases autres qu’AKT favorise leur migration dans le noyau où elles exercent leur activité transcriptionnelle. L’activité transcriptionnelle et la stabilité des FoxO sont également finement régulées par d’autres modifications post-traductionnelles telles que acétylation, méthylation, ubiquitination, ou oxydoréductions [3, 4, 16] (Figure 3). En étudiant le contrôle de l’activité des FoxO dans les CSEh, nous montrons que l’expression de FoxO3 est principalement cytoplasmique et celle de FoxO1 nucléaire (Figure 3). Or, dans les CSEh, la voie PI3K/AKT est activée en réponse à une stimulation par le bFGF (basic fibroblast growth factor), ce qui entraîne la phosphorylation de FoxO1 par AKT. Cependant, FoxO1 n’est pas exportée du noyau dans ces conditions, suggérant que dans ces cellules, l’action inhibitrice habituelle de AKT sur FoxO1 est bloquée par d’autres voies de régulation ou des modifications post-traductionnelles (Figures 1 et 3). Dans les cellules souches adultes (CSH et cellules souches neurales), c’est FoxO3 qui est exprimée majoritairement dans le noyau alors que AKT est phosphorylée [10, 17] (Rimmelé and Ghaffari, données personnelles). Il est donc probable que plusieurs niveaux de régulation des FoxO existent et que des mécanismes de régulation distincts pour FoxO1, 3 et 4 existent dans une même cellule [4]. Ainsi, les protéines FoxO ont été identifiées comme des régulateurs clés de la destinée des cellules souches embryonnaires et adultes. Cette dualité de fonction suggère que l’autorenouvellement des CSE et des cellules souches adultes est régulé par certains mécanismes communs, comme cela a été mis en évidence en caractérisant la fonction de ZFX (zinc finger protein, X-linked) [18]. Outre leur capacité à contrôler la maintenance des cellules souches normales, les FoxO (FoxO3) influenceraient aussi celle des cellules souches leucémiques. La complexité fonctionnelle des FoxO est finement orchestrée via la régulation de l’activité des différents membres de la famille. Les enjeux actuels sont de comprendre les mécanismes de régulation des FoxO afin d’approfondir notre compréhension du comportement des cellules souches et d’envisager de nouvelles thérapies basées sur la modulation de l’activité des FoxO dans des modèles pathologiques [19]. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Nous remercions les National Institutes of Health RO1 DK077174, American Cancer Society Research Scholarship (RSG LIB-110480), Career Enhancement Award (K18 HL76510-01), Black Family Stem Cell Institute Exploratory Research Award, New York State Stem Cell Science (NYSTEM) award (CO24408), Irma Hirschl/Weill-Caulier Trust Research Award, Roche Foundation for Anemia Research (RoFAR) Award, et NIH P20 GM75019 (Gordon Keller PI, SG CoPI), pour leur soutien financier à notre travail.
|
1. Takahashi K, Tanabe K, Ohnuki M, et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors . Cell. 2007; ; 131 : :861.–872. 2. Takahashi K, Yamanaka S.. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors . Cell. 2006; ; 126 : :663.–676. 3. van den Berg MC, Burgering BM. Integrating opposing signals towards Forkhead box O . Antioxid Redox Signal. 2011; ; 14 : :1093.–1106. 4. Zhang X, Rielland M, Yalcin S, Ghaffari S. Regulation and function of FoxO transcription factors in normal and cancer stem cells: what have we learned? Curr Drug Targets. 2011; ; 12 : :1267.–1283. 5. Boyer LA, Lee TI, Cole MF, et al. Core transcriptional regulatory circuitry in human embryonic stem cells . Cell. 2005; ; 122 : :947.–956. 6. Zhang X, Yalcin S, Lee DF, et al. FOXO1 is an essential regulator of pluripotency in human embryonic stem cells . Nat Cell Biol. 2011; ; 13 : :1092.–1099. 7. Nichols J, Smith A. Naive and primed pluripotent states . Cell Stem Cell. 2009; ; 4 : :487.–492. 8. Gabut M, Samavarchi-Tehrani P, Wang X, et al. An alternative splicing switch regulates embryonic stem cell pluripotency and reprogramming . Cell. 2011; ; 147 : :132.–146. 9. Tothova Z, Kollipara R, Huntly BJ, et al. FoxOs are critical mediators of hematopoietic stem cell resistance to physiologic oxidative stress . Cell. 2007; ; 128 : :325.–339. 10. Yalcin S, Zhang X, Luciano JP, et al. Foxo3 is essential for the regulation of ataxia telangiectasia mutated and oxidative stress-mediated homeostasis of hematopoietic stem cells . J Biol Chem. 2008; ; 283 : :25692.–25705. 11. Miyamoto K, Araki KY, Naka K, et al. Foxo3a is essential for maintenance of the hematopoietic stem cell pool . Cell Stem Cell. 2007; ; 1 : :101.–112. 12. Yalcin S, Marinkovic D, Mungamuri SK, et al. ROS-mediated amplification of AKT/mTOR signalling pathway leads to myeloproliferative syndrome in Foxo3(-/-) mice . EMBO J. 2010; ; 29 : :4118.–4131. 13. Marinkovic D, Zhang X, Yalcin S, et al. Foxo3 is required for the regulation of oxidative stress in erythropoiesis . J Clin Invest. 2007; ; 117 : :2133.–2144. 14. Paik JH, Ding Z, Narurkar R, et al. FoxOs cooperatively regulate diverse pathways governing neural stem cell homeostasis . Cell Stem Cell. 2009; ; 5 : :540.–553. 15. Renault VM, Rafalski VA, Morgan AA, et al. FoxO3 regulates neural stem cell homeostasis . Cell Stem Cell. 2009; ; 5 : :527.–539. 16. Burgering BMT. A brief introduction to FOXOlogy . Oncogene. 2008; ; 27 : :2258.–2262. 17. Lee JY, Nakada D, Yilmaz OH, et al. mTOR activation induces tumor suppressors that inhibit leukemogenesis and deplete hematopoietic stem cells after Pten deletion . Cell Stem Cell. 2010; ; 7 : :593.–605. 18. Galan-Caridad JM, Harel S, Arenzana TL, et al. Zfx controls the self-renewal of embryonic and hematopoietic stem cells . Cell. 2007; ; 129 : :345.–357. 19. Gonzales KA, Ng HH. FoxO : a new addition to the ESC cartel . Cell Stem Cell. 2011; ; 9 : :181.–183. 20. Lataillade JJ, Brunet de la Grange P, Uzan , Le Bousse-Kerdilès MC. Les cellules souches ont-elles l’âge de leur niche ? À la recherche d’un sérum de jouvence . Med Sci (Paris). 2010; ; 26 : :582.–585. 21. Brunet A. Bien vieillir : la voie de signalisation insuline-FOXO et la longévité . Med Sci. 2012; ; 28 : :316.–320. |