| |
| Med Sci (Paris). 2012 February; 28(2): 172–178. Published online 2012 February 27. doi: 10.1051/medsci/2012282015.Les patients HIV controllers
Olivier Lambotte1,2,3* 1AP-HP, service de médecine interne et maladies infectieuses, CHU de Bicêtre, Le Kremlin-Bicêtre, 78, rue du Général Leclerc, 94275Le Kremlin Bicêtre, France 2Université Paris-Sud, Le Kremlin-Bicêtre, France 3Inserm, U1012, Le Kremlin-Bicêtre, France |
L’infection par le VIH (virus de l’immunodéficience humaine) est caractérisée par une réplication virale permanente et une déplétion progressive des lymphocytes T CD4+ (LTCD4), ce qui conduit au stade sida (syndrome d’immunodéficience acquise) en l’absence de traitement antirétroviral (TARV) efficace. Les patients appelés HIV controllers (littéralement : qui contrôlent le virus HIV) sont caractérisés par l’absence de réplication virale détectable pendant une période très prolongée en l’absence de tout TARV. L’état de ces patients pourrait représenter une « guérison fonctionnelle » de l’infection par le VIH. La connaissance des mécanismes qui permettent le contrôle prolongé de la réplication du VIH est un enjeu majeur dans le développement des stratégies vaccinales. |
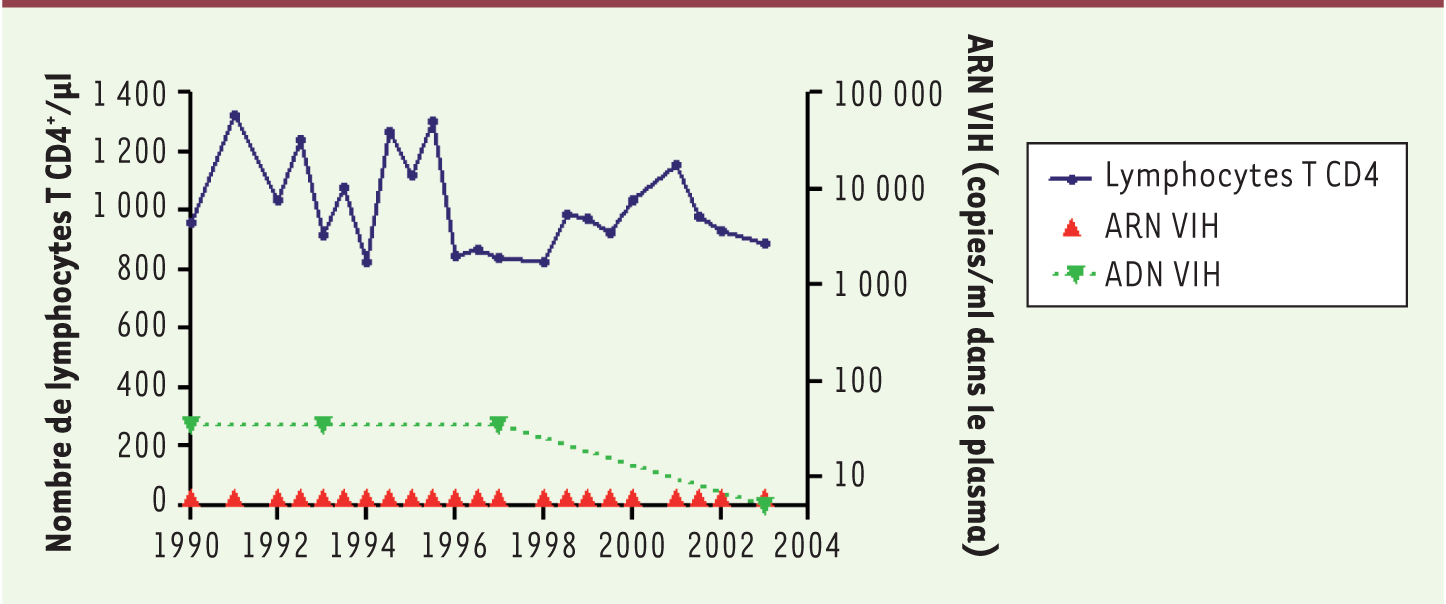
Identification des patients HIV controllersDès les années 1990, des patients, qualifiés d’asymptomatiques à long terme (ALT) ou long-term non progressors, ont été identifiés : leur caractéristique était le maintien d’un taux de LTCD4 élevé pendant plusieurs années [1–3]. Ces patients représentent entre 2 et 15 % des individus infectés par le VIH. Mais à l’époque, les définitions de cet état de ALT étaient variables selon les cohortes et ce groupe de patients était hétérogène. En effet, chez la majorité d’entre eux, la réplication virale était détectable à des niveaux très variables. Au fil du temps, une majorité de ces patients ALT a progressé vers le sida [4]. En 2004, nous avons identifié un groupe encore plus restreint de patients infectés par le VIH, chez lesquels il n’y a pas de virus détectable dans le sang. Ces patients, que nous avons définis comme HIV controllers (HIC), sont caractérisés par : une infection par le VIH connue depuis plus de dix ans, une mesure de la charge virale < 400 copies/ml dans 90 % des mesures, et l’absence de traitement antirétroviral [5] (Figure 1). Ces patients sont rares : moins de 1 % des patients VIH+ [5, 6].
 | Figure 1. Profil immunovirologique d’un patient HIV controller. |
Les patients HIV controllers sont donc définis sur un critère strictement virologique, à la différence des patients asymptomatiques à long terme (ALT) [7]. Néanmoins, un certain nombre de patients répondent aux deux définitions : 12 % dans la base française de données hospitalières [8]. |
Définition des patients HIV controllersComme cela a été mentionné plus haut, les patients HIV controllers sont définis par le contrôle prolongé de la réplication virale, que traduisent des charges virales indétectables au cours du temps. Néanmoins, les définitions varient légèrement selon les pays. Aux États-Unis, la définition des patients HIV controllers de l’International HIV controller consortium distingue deux groupes chez ces patients [9]. D’une part, des patients elite controllers chez lesquels au moins trois charges virales doivent être inférieures à 50 copies d’ARN/ml pendant au moins un an en l’absence de traitement antirétroviral. D’autre part, des patients viremic controllers, chez lesquels au moins trois charges virales doivent être comprises entre 50 et 2 000 copies pendant au moins un an en l’absence de traitement antirétroviral. La définition française actuelle de la cohorte ANRS CO18 HIV controllers a été élargie depuis 2005. Les patients HIV controllers inclus dans la cohorte sont des patients infectés par le VIH depuis plus de cinq ans, chez qui les cinq dernières mesures de charge virale doivent être < 400 copies en l’absence de traitement antirétroviral. Les seuils de détection de charge virale varient donc selon les cohortes ainsi que les durées pendant lesquelles le virus était indétectable, ce qui parfois pourrait expliquer certaines différences de résultats. |
Caractéristiques cliniques et démographiques des patients HIV controllersNous prendrons comme exemple les données de la cohorte française ANRS CO18 HIV controllers. La cohorte a inclus 160 patients HIV controllers depuis 2009 en France. L’âge médian de découverte de l’infection par le VIH est de 29 ans, celui de l’inclusion dans la cohorte est de 46 ans, avec des extrêmes allant de 23 à 78 ans. L’infection par le VIH a été diagnostiquée avant 1994 chez 50 % des patients de la cohorte : la durée d’infection est donc d’au moins 18 ans avec un virus indétectable et sans traitement antirétroviral. Deux tiers des patients de la cohorte sont caucasiens, et la moitié (51 %) sont des femmes. Tous les modes de contamination sont représentés mais les patients homosexuels ne représentent que 26 % des patients de la cohorte. Cette sous-représentation des patients homosexuels est un peu étonnante, car avant 1994, l’épidémie touchait principalement la communauté homosexuelle et les patients toxicomanes. À l’inclusion, la médiane des LTCD4 est de 716/mm3 mais 23 % des patients ont des lymphocytes CD4 < 500/mm3, ce qui illustre bien la différence entre les patients asymptomatiques à long terme et HIV controllers. Depuis leur inclusion dans la cohorte, six patients ont reçu des antirétroviraux dont quatre en raison d’une diminution du taux de leurs LTCD4 sans rebond associé de la réplication virale. Ces observations, très exceptionnelles, soulignent que l’équilibre immunovirologique des patients HIV controllers n’est pas immuable. Ainsi, nous avons pu montrer [10] que chez tous les patients pour lesquels une charge virale détectable avait été mesurée au moins une fois dans leur histoire, la cinétique d’évolution du taux de LTCD4 présentait une pente négative. En revanche, ce taux de LTCD4 restait parfaitement stable et constant dans le temps dans le sous-groupe de patients HIV controllers chez lesquels aucune charge virale n’avait jamais été détectable. Ce rôle des blips (sursauts) de charge virale dans la baisse des LTCD4 a été observé dans d’autres cohortes [11]. L’évolution immunovirologique à long terme des patients HIV controllers reste donc incertaine et constitue l’objectif principal de l’étude de la cohorte française. |
Physiopathologie du contrôle de l’infection par le VIH Le contrôle de la réplication virale chez ces patients peut s’expliquer par trois mécanismes qui ne sont pas exclusifs : il peut s’agir d’un virus atténué, qui se répliquerait mal ; il peut exister une prédisposition génétique particulière des patients HIV controllers qui leur permet de résister au virus ; enfin, le système immunitaire de ces patients peut bloquer la réplication virale de façon particulièrement efficace. Nous allons voir que les deux derniers mécanismes sont impliqués chez les patients HIV controllers de manière préférentielle. Caractéristiques virologiques des patients HIV controllers Dès 2007, nous avons montré que les patients HIV controllers étaient infectés par des virus compétents pour la réplication [ 12]. L’activation des LTCD4 des patients HIV controllers conduisait à la production de virus capables d’infecter des LTCD4 hétérologues. Une étude extensive de ces virus [ 13] n’a pas retrouvé de mutation dans les principaux gènes du VIH qui conduise à des virus défectifs. Les patients HIV controllers sont par ailleurs les patients chez qui la taille du réservoir du VIH (quantité d’ADN VIH dans les LTCD4) est la plus faible [ 5]. La compréhension de la dynamique de ces réservoirs chez ces patients est un enjeu actuel majeur. Il faut néanmoins noter deux points importants :
-
Il persiste une réplication virale résiduelle à bas bruit chez les patients HIV controllers. Plusieurs études ont mis en évidence, en utilisant des techniques ultrasensibles de quantification de la charge virale plasmatique (seuil de l’ordre d’une copie de virus/ml), une réplication virale chez les patients HIV controllers. Ainsi, une étude longitudinale [14] a mis en évidence chez 45 des 46 patients elite controllers étudiés la persistance d’une virémie détectable par des techniques ultrasensibles. Cette donnée est importante, car elle indique que le virus continue de se multiplier à bas bruit même chez ces patients. Cette réplication pourrait être le stimulus nécessaire au maintien de la réponse immunitaire anti-VIH puissante que nous décrivons ci-dessous.
-
Il existe une pression de sélection très forte de la réponse immunitaire sur les virus des patients HIV controllers [15]. En effet, de nombreuses mutations d’échappement ont été détectées, en particulier dans le gène viral codant pour la protéine Gag. Le virus est obligé de muter régulièrement pour pouvoir continuer à se répliquer, mais le prix à payer est une diminution de sa capacité réplicative (fitness).
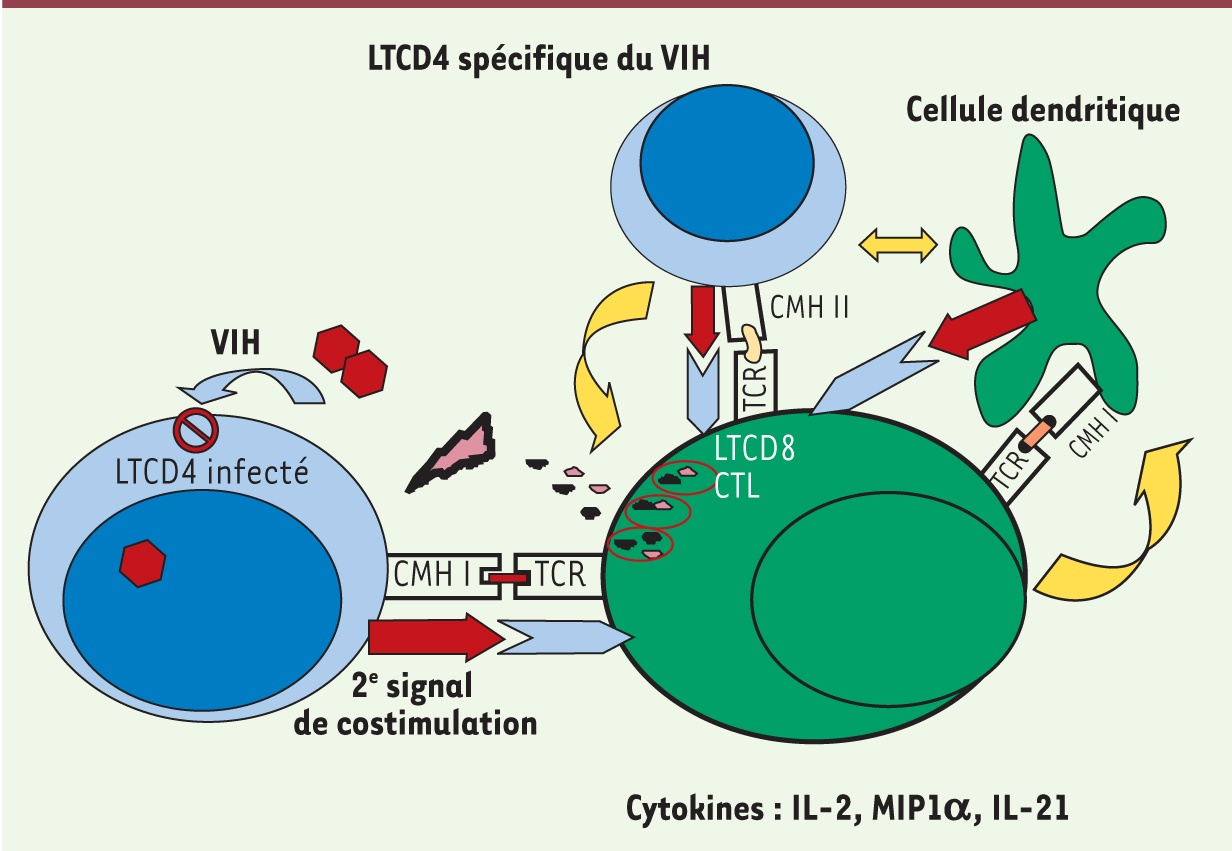
Caractéristiques génétiques des patients HIV controllers Il existe chez les patients HIV controllers une surreprésentation des allèles protecteurs HLAB57 et B27 qui contiennent le motif Bw4. HLAB57-01 est enrichi chez les patients européens et américains du nord alors que HLAB57-03 est enrichi dans les populations d’origine africaine. Les patients B57 + représentent de 45 % des patients de la cohorte française à 86 % de la cohorte du NIH [ 16]. Le rôle majeur de l’allèle HLAB57 a été souligné par plusieurs études génomiques [ 17, 18]. Des analyses transcriptomiques ont également été réalisées chez les patients HIV controllers et ont identifié le rôle de plusieurs voies de signalisation intracellulaire, en particulier la voie FoxO3 [ 19]. L’analyse des profils transcriptomiques a permis dans une étude d’identifier deux groupes de patients HIV controllers : l’un avait un transcriptome très proche de celui de patients traités depuis plusieurs années par antirétroviraux de façon efficace, le profil transcriptomique de l’autre était superposable à celui de donneurs sains [ 20]. Au plan de la susceptibilité génétique, il n’y a pas de surreprésentation de la mutation Delta 32 du corécepteur d’entrée CCR51,. Plusieurs groupes ont recherché sans succès des anomalies des facteurs de restriction TRIM5a2, (tripartite motif protein 5a) ou Apobec3G3. Récemment, l’équipe de Saez Cirion [21] a mis en évidence une restriction de l’infection des LTCD4 et des macrophages des patients HIV controllers. Une étude parallèle américaine retrouve des résultats très proches qui suggèrent clairement qu’il existe des mécanismes de restriction du VIH dans les cellules de ces patients [22]. Caractéristiques immunologiques des patients HIV controllers Immunité innée Il faut noter la présence d’une inflammation chronique chez les patients HIV controllers, plus faible que chez des patients virémiques, mais significative si on la compare à des sujets sains ou des patients sous traitement antirétroviral efficace. Cette inflammation - qui semble présente chez tous les patients HIV controllers - a pour conséquence une activation lymphocytaire que nous décrivons ci-dessous. Elle est liée au moins en partie à la réplication virale résiduelle et à une perméabilité accrue de la barrière intestinale épithéliale et donc à des translocations de produits bactériens comme le LPS (lipopolysaccharide) [ 23]. Il existe une corrélation entre l’activation du système immunitaire et les taux de LPS sanguins [ 23, 24], ainsi qu’entre la perte des LTCD4 et les taux de LPS [ 24]. Cette activation immunitaire a un impact clinique probable puisqu’une augmentation de l’épaisseur intima-média carotidienne 4 a été retrouvée chez les patients HIV controllers [ 25] ; ce risque vasculaire est corrélé au niveau d’activation du système immunitaire. Immunité adaptative Les caractéristiques les plus spécifiques des patients HIV controllers ont été mises en évidence lors de l’analyse de l’immunité adaptative. • Réponse des lymphocytes T CD8+ (LTCD8) Les patients HIV controllers ont une réponse immunitaire anti-VIH tout à fait unique. Le contrôle du VIH ne semble pas lié à un nombre élevé de lymphocytes T CD8 + (LTCD8). En effet, le nombre de LTCD8 spécifiques du VIH n’est pas significativement différent chez les patients HIV controllers et les patients virémiques [ 26]. La différence est avant tout qualitative. Les LTCD8 des patients HIV controllers sont capables d’une prolifération importante en présence de peptides du VIH [ 26, 27], ils sont « polyfonctionnels », c’est-à-dire capables de produire simultanément plusieurs cytokines et chimiokines comme l’IL(interleukine)-2, le TNFα ( tumor necrosis factor alpha), MIP1α ( migration inhibitory protein) [ 28], mais surtout, ils sont capables de tuer les LTCD4 infectés par le VIH [ 26, 29, 30]. Cette capacité de cytotoxicité ex vivo semble propre aux LTCD8 des patients HIV controllers. Le contrôle de la réplication virale n’est pas lié à la production de facteurs solubles mais requiert un contact cellulaire entre le LTCD8 et le LTCD4 infecté. Nous avons montré que cette cytotoxicité n’était détectable que dans une situation autologue, ce qui souligne l’importance du système HLA [ 26]. Cette cytotoxicité est liée à une production très rapide de perforine et de granzyme [ 29, 30] (Figure 2).
 | Figure 2. Mode d’action de la réponse cellulaire anti-VIH chez une grande partie des patients HIV controllers. Les lymphocytes TCD8+ (LTCD8) sont cytotoxiques, produisent rapidement de la perforine et du granzyme qu’ils relâchent au contact d’un lymphocyte T CD4+ infecté. Les LTCD8 sont polyfonctionnels car ils produisent de nombreuses cytokines et chimiokines (flèches jaunes). La coopération LTCD8 - cellule dendritique - LTCD4 spécifique du VIH se fait facilement du fait d’une avidité importante des TCR (T cell receptor) des LT pour des peptides du VIH et pour la protéine Gag en particulier. Les LTCD4 produisent de l’IL-2 favorisant le rôle helper CD4. L’infection des LTCD4 par le VIH est réduite du fait de l’action probable de facteurs de restriction. |
Outre sa qualité, une autre caractéristique de la réponse TCD8 est sa cible. La réponse TCD8 des patients VIH est dirigée préférentiellement contre la protéine virale Gag [9, 31]. Cette protéine est produite précocement au cours du cycle viral. Cibler cette protéine permet donc le développement très rapide d’une réponse TCD8. Ce point est important car il montre que Gag doit être une cible majeure pour les stratégies vaccinales. Les nombreuses mutations d’échappement identifiées dans les séquences codant pour la protéine Gag des virus des patients HIV controllers, en particulier les patients B57+, soulignent la pression de sélection imposée par la réponse TCD8 sur le virus [15, 32]. Cette réponse spécifique TCD8 n’est pas associée à un profil particulier de différenciation des LTCD8 mais s’accompagne d’une activation lymphocytaire. En effet, le pourcentage de LTCD8 CD38+ DR+ est significativement plus élevé chez les patients HIV controllers que chez les sujets sains [24]. Nous avons par ailleurs montré la présence chez ces patients d’une sous-population TCD8 CD38lowDRhigh qui leur semble spécifique mais dont l’origine reste incertaine [26]. • Réponse des lymphocytes T CD4+ (LTCD4) Cette réponse TCD8 ne pourrait se mettre en place et persister sans réponse TCD4 spécifique du VIH. Cette réponse existe chez les patients HIV controllers. Elle se caractérise par la persistance de LTCD4 centraux mémoires qui habituellement disparaissent au cours de l’infection par le VIH [ 33]. Ces LTCD4 sont polyfonctionnels et capables de synthétiser de l’IL-2 [ 33]. Ils ont une avidité très élevée pour un peptide de Gag, ce qui indique que ces cellules sont capables de s’activer en présence de quantités très faibles de virus et donc de déclencher la réponse TCD8 [ 34]. La préservation de la population centrale mémoire est probablement liée à l’expression de certains facteurs de transcription comme FoxO3 [ 19]. Les LTCD4 des patients HIV controllers sont en revanche aussi activés de manière chronique, comme les LTCD8. •Réponses natural killer (NK) et lymphocytaire B Les cellules NK ne semblent pas jouer de rôle essentiel dans le contrôle de la réplication virale chez les patients HIV controllers [ 35], mais elles auraient un profil d’activation spécifique [ 36]. Concernant la réponse humorale, les taux d’anticorps neutralisants sont un peu plus faibles chez les patients HIV controllers que chez les patients asymptomatiques à long terme ou virémiques [37]. Ceci s’explique par le fait que la production de ces anticorps est dépendante de la virémie. En revanche, nous avons montré que les patients HIV controllers avaient une activité ADCC (antibody dependent cell cytotoxicity) significative [37]. Ce point est important, car l’ADCC pourrait contribuer à un contrôle précoce de la réplication du VIH chez les HIV controllers. Néanmoins, un élément important doit être souligné avant de clore cette section. Les patients HIV controllers forment un groupe hétérogène, car les niveaux de réponses spécifiques anti-VIH des LTCD8 et LTCD4 sont variables [9, 31, 38]. Nous avons ainsi défini deux types de patients HIV controllers [31]. Les patients forts répondeurs (strong responders) ont toutes les caractéristiques décrites ci-dessus. Ces patients représentent 60 % des HIV controllers de la cohorte française. Ils semblent avoir aussi une médiane de charge virale plasmatique (détectée par des techniques ultrasensibles) un peu plus élevée que le second groupe, ce qui suggère un lien entre persistance d’une forte réponse TCD8 spécifique du VIH et réplication virale résiduelle. Le second groupe, des faibles répondeurs (weak responders), est caractérisé par des réponses TCD8 spécifiques quantitativement faibles avec une capacité de blocage de la réplication virale par les LTCD8 réduite. Les mécanismes de contrôle du VIH chez ces patients sont en cours d’étude. |
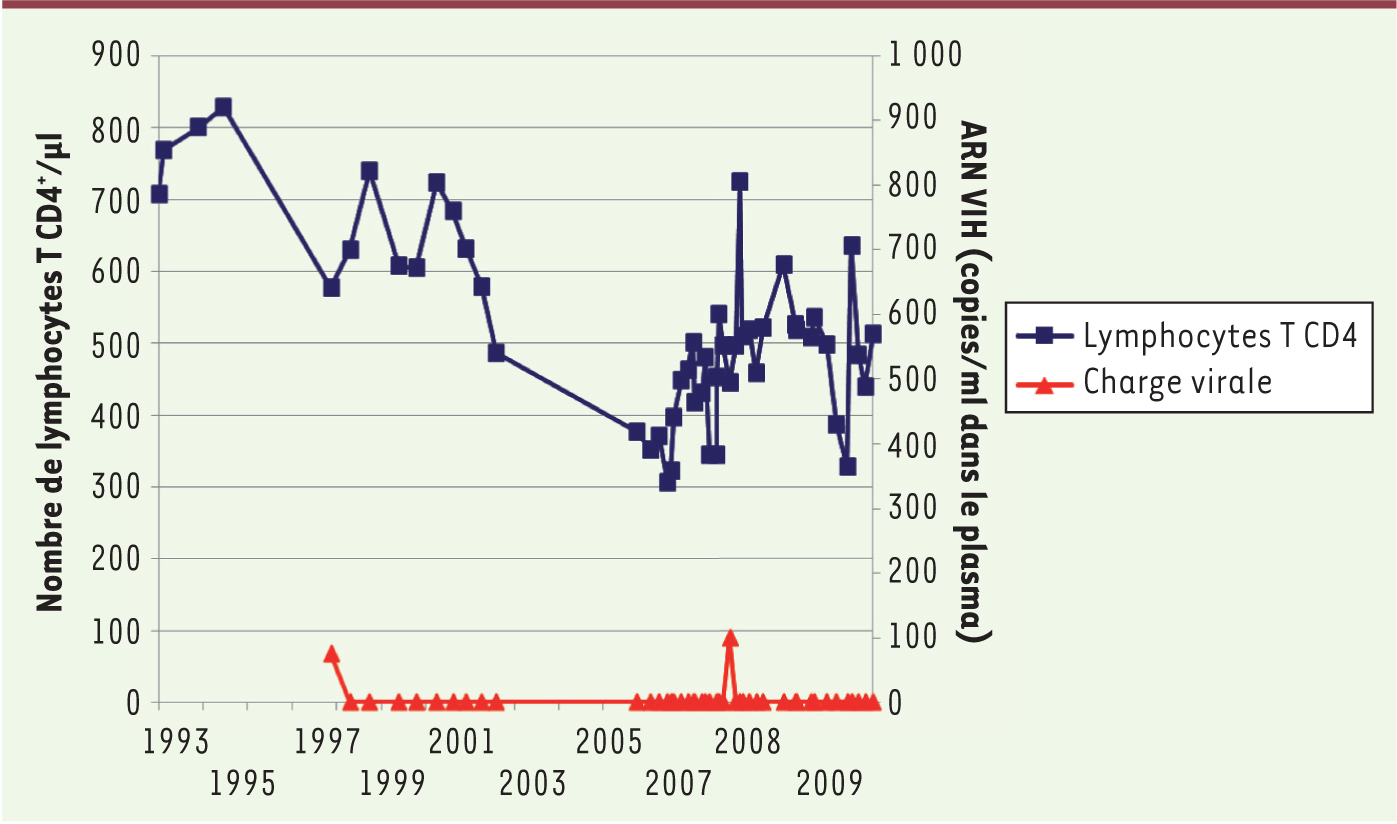
Perspectives et questions De nombreuses questions persistent. Nous en détaillerons quatre. La mise en place de la réponse TCD8 anti-VIH Nous avons montré que près de 60 % des patients HIV controllers ont une forte réponse TCD8 spécifique du VIH, capable de bloquer la réplication virale. Le mode d’établissement de cette réponse reste méconnu. En effet, quand le VIH infecte son hôte, cette réponse spécifique met deux à trois semaines à apparaître [ 39]. Or, dès la primo-infection, plusieurs observations montrent qu’un contrôle précoce de la réplication virale est possible [ 40]. Ceci suggère le rôle de mécanismes de l’immunité innée qui, très précocement, limiteraient la réplication du VIH et permettraient à la réponse TCD8 spécifique de se développer et de contrôler la réplication virale. L’étude d’un modèle macaque de contrôle du SIV ( simian immunodeficiency virus) devrait permettre d’apporter des réponses sur ces phases précoces. L’hétérogénéité de la réponse TCD8 anti-VIH Néanmoins, chez près de 50 % des patients HIV controllers de la cohorte, la réponse TCD8 spécifique anti-VIH est faible, voire indétectable chez certains patients. Comment ces patients contrôlent-ils le virus ? Plusieurs hypothèses sont actuellement testées. La réponse TCD8 pourrait siéger dans les tissus ; en effet une discordance des taux de LTCD8 et CD4 spécifiques du VIH entre le sang et la muqueuse digestive a été décrite [ 41]. Les LTCD8 spécifiques du VIH pourraient être dans un état « mémoire » quiescent qui les rendrait indétectables par les techniques actuelles. Le contrôle du virus pourrait faire intervenir d’autres mécanismes, en particulier, une immunité humorale de type ADCC ou des facteurs de restriction. Les caractéristiques immunologiques des patients HIV controllers : cause ou conséquence de l’absence de réplication virale ? De nombreuses caractéristiques immunologiques des patients HIV controllers peuvent être considérées comme étant la conséquence, et non la cause, d’une charge virale indétectable. Ainsi, le caractère polyfonctionnel des LTCD8 spécifiques a été décrit chez certains patients recevant un traitement antirétroviral efficace très prolongé [ 42]. Néanmoins, plusieurs arguments sont en faveur du rôle actif du système immunitaire dans le contrôle du virus chez une majorité de patients HIV controllers. Ce sont principalement : l’impact des LTCD8 spécifiques du VIH sur le virus, dont témoignent la détection de nombreuses mutations d’échappement, la capacité de suppression de la réplication virale par les LTCD8 qui est propre aux patients HIV controllers, et l’avidité élevée des LTCD4 et des LTCD8 spécifiques de Gag pour cette protéine, qui semble aussi être une caractéristique de ces patients. Le devenir clinique des patients HIV controllers Comme nous l’avons mentionné au début de cette revue, un certain nombre de patients HIV controllers ont un taux de LTCD4 < 500/mm 3. Quelques patients ont été traités par antirétroviraux au vu de ce résultat alors même que la réplication virale restait indétectable. Il faut néanmoins être très prudent avant de conclure à une progression de la maladie chez un patient HIV controller : plusieurs observations montrent des fluctuations importantes des taux de LTCD4 au cours des années (Figure 3). Le devenir des patients HIV controllers dans 10 ou 20 ans reste difficile à prévoir ; le déterminer représente l’objectif principal de la cohorte.
 | Figure 3. Évolution fluctuante du taux de lymphocytes T CD4+ chez un patient HIV controller pendant 18 ans. Le diagnostic de l’infection VIH a été porté en 1992, le dernier point de suivi mesuré en 2010 ; entre 2003 et 2006, de manière transitoire, le taux de lymphocytes T CD4+ (carrés bleus) est inférieur à 500/mm3 alors que les charges virales (losanges rouges) sont indétectables, puis, spontanément, le taux de LTCD4 remonte et dépasse le nombre de 500/mm3. |
|
Les patients HIV controllers représentent un groupe unique de patients qui contrôlent de manière prolongée une infection virale fatale. C’est la combinaison de plusieurs mécanismes, génétiques et immunologiques, qui conduit à un tel contrôle. Si le phénotype de ces patients est unique, les mécanismes sont divers ce qui explique l’hétérogénéité des patients. L’identification des facteurs liés au contrôle du VIH est un enjeu majeur pour développer un vaccin prophylactique ou thérapeutique. Une autre question importante est de savoir si une intervention thérapeutique, qui réduirait la taille des réservoirs du VIH d’un patient infecté au niveau de celle d’un patient HIV controller, pourrait permettre l’arrêt du traitement antirétroviral sans reprise de la réplication virale. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. Barker E, Mackewicz CE, Reyes-Teran G, et al. Virological and immunological features of long-term human immunodeficiency virus-infected individuals who have remained asymptomatic compared with those who have progressed to acquired immunodeficiency syndrome . Blood. 1998; ; 92 : :3105.–3114. 2. Cao Y, Qin L, Zhang L, et al. Virologic and immunologic characterization of long-term survivors of human immunodeficiency virus type 1 infection . N Engl J Med. 1995; ; 332 : :201.–208. 3. Martinez V. Combination of HIV-1-specific CD4 Th1 cell responses and IgG2 antibodies is the best predictor for persistence of long-term nonprogression . J Infect Dis. 2005; ; 191 : :2053.–2063. 4. Lefrere JJ, Morand-Joubert L, Mariotti M, et al. Even individuals considered as long-term nonprogressors show biological signs of progression after 10 years of human immunodeficiency virus infection . Blood. 1997; ; 90 : :1133.–1140. 5. Lambotte O, Boufassa F, Madec Y, et al. HIV controllers: a homogeneous group of HIV-1-infected patients with spontaneous control of viral replication . Clin Infect Dis. 2005; ; 41 : :1053.–1056. 6. Okulicz JF, Marconi VC, Landrum ML, et al. Clinical outcomes of elite controllers, viremic controllers, and long-term nonprogressors in the US Department of Defense HIV natural history study . J Infect Dis. 2009; ; 200 : :1714.–1723. 7. Martinez V, Autran B. Les HIV controllers : une nouvelle entité évolutive de l’infection par le VIH ? Med Sci (Paris). 2008; ; 24 : :7.–9. 8. Grabar S, Selinger-Leneman H, Abgrall S, et al. Prevalence and comparative characteristics of long-term nonprogressors and HIV controller patients in the French Hospital Database on HIV . Aids. 2009; ; 23 : :1163.–1169. 9. Pereyra F, Addo MM, Kaufmann DE, et al. Genetic and immunologic heterogeneity among persons who control HIV infection in the absence of therapy . J Infect Dis. 2008; ; 197 : :563.–571. 10. Boufassa F, Saez-Cirion A, Lechenadec J, et al. CD4 dynamics over a 15 year-period among HIV controllers enrolled in the ANRS French observatory . PloS One. 2011; ; 6 : :e18726.. 11. Pereyra F, Palmer S, Miura T, et al. Persistent low-level viremia in HIV-1 elite controllers and relationship to immunologic parameters . J Infect Dis. 2009; ; 200 : :984.–290. 12. Lamine A, Caumont-Sarcos A, Chaix ML, et al. Replication-competent HIV strains infect HIV controllers despite undetectable viremia (ANRS EP36 study) . Aids. 2007; ; 21 : :1043.–1045. 13. Miura T, Brockman MA, Brumme CJ, et al. Genetic characterization of human immunodeficiency virus type 1 in elite controllers: lack of gross genetic defects or common amino acid changes . J Virol. 2008; ; 82 : :8422.–8430. 14. Hatano H, Delwart EL, Norris PJ, et al. Evidence for persistent low-level viremia in individuals who control human immunodeficiency virus in the absence of antiretroviral therapy . J Virol. 2009; ; 83 : :329.–335. 15. Miura T, Brockman MA, Brumme ZL, et al. HLA-associated alterations in replication capacity of chimeric NL4–3 viruses carrying gag-protease from elite controllers of human immunodeficiency virus type 1 . J Virol. 2009; ; 83 : :140.–149. 16. Okulicz JF, Lambotte O. Epidemiology and clinical characteristics of elite controllers . Curr Opin HIV AIDS. 2011; ; 6 : :163.–168. 17. Dalmasso C, Carpentier W, Meyer L, et al. Distinct genetic loci control plasma HIV-RNA, cellular HIV-DNA levels in HIV-1 infection: the ANRS Genome wide association 01 study . PloS One. 2008; ; 3 : :e3907.. 18. Fellay J, Shianna KV, Ge D, et al. A whole-genome association study of major determinants for host control of HIV-1 . Science. 2007; ; 317 : :944.–947. 19. Van Grevenynghe J, Procopio FA, He Z, et al. Transcription factor FOXO3a controls the persistence of memory CD4+ T cells during HIV infection . Nat Med. 2008; ; 14 : :266.–274. 20. Vigneault F, Woods M, Buzon MJ, et al. Transcriptional profiling of CD4 T cells identifies distinct subgroups of HIV-1 elite controllers . J Virol. 2011; ; 85 : :3015.–3019. 21. Saez-Cirion A, Hamimi C, Bergamaschi A, et al. Restriction of HIV-1 replication in macrophages and CD4+ T cells from HIV controllers . Blood. 2011; ; 118 : :955.–964. 22. Chen H, Li C, Huang J, et al. CD4+ T cells from elite controllers resist HIV-1 infection by selective upregulation of p21 . J Clin Invest. 2011; ; 121 : :1549.–1560. 23. Brenchley JM, Price DA, Schacker TW, et al. Microbial translocation is a cause of systemic immune activation in chronic HIV infection . Nat Med. 2006; ; 12 : :1365.–1371. 24. Hunt PW, Brenchley J, Sinclair E, et al. Relationship between T cell activation and CD4+ T cell count in HIV-seropositive individuals with undetectable plasma HIV RNA levels in the absence of therapy . J Infect Dis. 2008; ; 197 : :126.–133. 25. Hsue PY, Hunt PW, Sinclair E, et al. Increased carotid intima-media thickness in HIV patients is associated with increased cytomegalovirus-specific T-cell responses . Aids. 2006; ; 20 : :2275.–2283. 26. Saez-Cirion A, Lacabaratz C, Lambotte O, et al. HIV controllers exhibit potent CD8 T cell capacity to suppress HIV infection ex vivo and peculiar cytotoxic T lymphocyte activation phenotype. Proc Natl Acad Sci USA. 2007; ; 104 : :6776.–6781. 27. Saez-Cirion A, Pancino G, Sinet M, et al. HIV controllers: how do they tame the virus? . Trends Immunol. 2007; ; 28 : :532.–540. 28. Betts MR, Nason MC, West SM, et al. HIV nonprogressors preferentially maintain highly functional HIV-specific CD8+ T cells . Blood. 2006; ; 107 : :4781.–4789. 29. Hersperger AR, Pereyra F, Nason M, et al. Perforin expression directly ex vivo by HIV-specific CD8 T-cells is a correlate of HIV elite control . PLoS Pathog. 2010; ; 6 : :e1000917.. 30. Migueles SA, Laborico AC, Shupert WL, et al. HIV-specific CD8+ T cell proliferation is coupled to perforin expression and is maintained in nonprogressors . Nat Immunol. 2002; ; 3 : :1061.–1068. 31. Saez-Cirion A, Sinet M, Shin SY, et al. Heterogeneity in HIV suppression by CD8 T cells from HIV controllers: association with Gag-specific CD8 T cell responses . J Immunol. 2009; ; 182 : :7828.–7837. 32. Miura T, Brockman MA, Schneidewind A, et al. HLA-B57/B*5801 human immunodeficiency virus type 1 elite controllers select for rare gag variants associated with reduced viral replication capacity and strong cytotoxic T-lymphocyte (corrected) recognition . J Virol. 2009; ; 83 : :2743.–2755. 33. Potter SJ, Lacabaratz C, Lambotte O, et al. Preserved central memory and activated effector memory CD4+ T-cell subsets in human immunodeficiency virus controllers: an ANRS EP36 study . J Virol. 2007; ; 81 : :13904.–13915. 34. Vingert B, Perez-Patrigeon S, Jeannin P, et al. HIV controller CD4+ T cells respond to minimal amounts of Gag antigen due to high TCR avidity . PLoS Pathog. 2011; ; 6 : :e1000780.. 35. O’Connell KA, Han Y, Williams TM, et al. Role of natural killer cells in a cohort of elite suppressors: low frequency of the protective KIR3DS1 allele and limited inhibition of human immunodeficiency virus type 1 replication in vitro . J Virol. 2009; ; 83 : :5028.–5034. 36. Vieillard V, Fausther-Bovendo H, Samri A, Debre P. Specific phenotypic and functional features of natural killer cells from HIV-infected long-term nonprogressors and HIV controllers . J Acquir Immune Defic Syndr. 2011; ; 53 : :564.–573. 37. Lambotte O, Ferrari G, Moog C, et al. Heterogeneous neutralizing antibody and antibody-dependent cell cytotoxicity responses in HIV-1 elite controllers . Aids. 2009; ; 23 : :897.–906. 38. Emu B, Sinclair E, Favre D, et al. Phenotypic, functional, and kinetic parameters associated with apparent T-cell control of human immunodeficiency virus replication in individuals with and without antiretroviral treatment . J Virol. 2005; ; 79 : :14169.–14178. 39. McMichael AJ, Rowland-Jones SL. Cellular immune responses to HIV . Nature. 2001; ; 410 : :980.–987. 40. Goujard C, Chaix ML, Lambotte O, et al. Spontaneous control of viral replication during primary HIV infection: when is “IV controller” status established? Clin Infect Dis. 2009; ; 49 : :982.–986. 41. Ferre AL, Hunt PW, Critchfield JW, et al. Mucosal immune responses to HIV-1 in elite controllers: a potential correlate of immune control . Blood. 2009; ; 113 : :3978.–3989. 42. Cellerai C, Harari A, Stauss H, et al. Early, prolonged antiretroviral therapy is associated with an HIV-1-specific T-cell profile comparable to that of long-term non-progressors . PLoS One. 2011; ; 6 : :e18164.. |