| |
| Med Sci (Paris). 2012 February; 28(2): 154–156. Published online 2012 February 27. doi: 10.1051/medsci/2012282013.Les plasmas non thermiques Nouvelle stratégie thérapeutique en cancérologie ? Marc Vandamme,1,2,3* Éric Robert,3 Stéphanie Lerondel,2 Jean-Michel Pouvesle,3 and Alain Le Pape2,4 1Germitec SAS, 30, rue Mozart, 92110Clichy, France 2CIPA TAAM (Transgenèse et archivage d’animaux modèles) UPS 44 CNRS, 3, rue de la Férollerie, 45071Orléans Cedex, France 3GREMI (Groupe de recherches sur l’énergétique des milieux ionisés) UMR-6606 CNRS, université d’Orléans, 14, rue d’Issoudun – BP 6744, 45067Orléans Cedex 2, France 4Inserm U618, université François Rabelais, Tours, France MeSH keywords: Humains, Coagulation par laser, effets indésirables, instrumentation, méthodes, tendances, Oncologie médicale, Modèles biologiques, Tumeurs, anatomopathologie, chirurgie, Gaz plasmas, usage thérapeutique, Complications postopératoires, prévention et contrôle, Résultat thérapeutique, Charge tumorale |
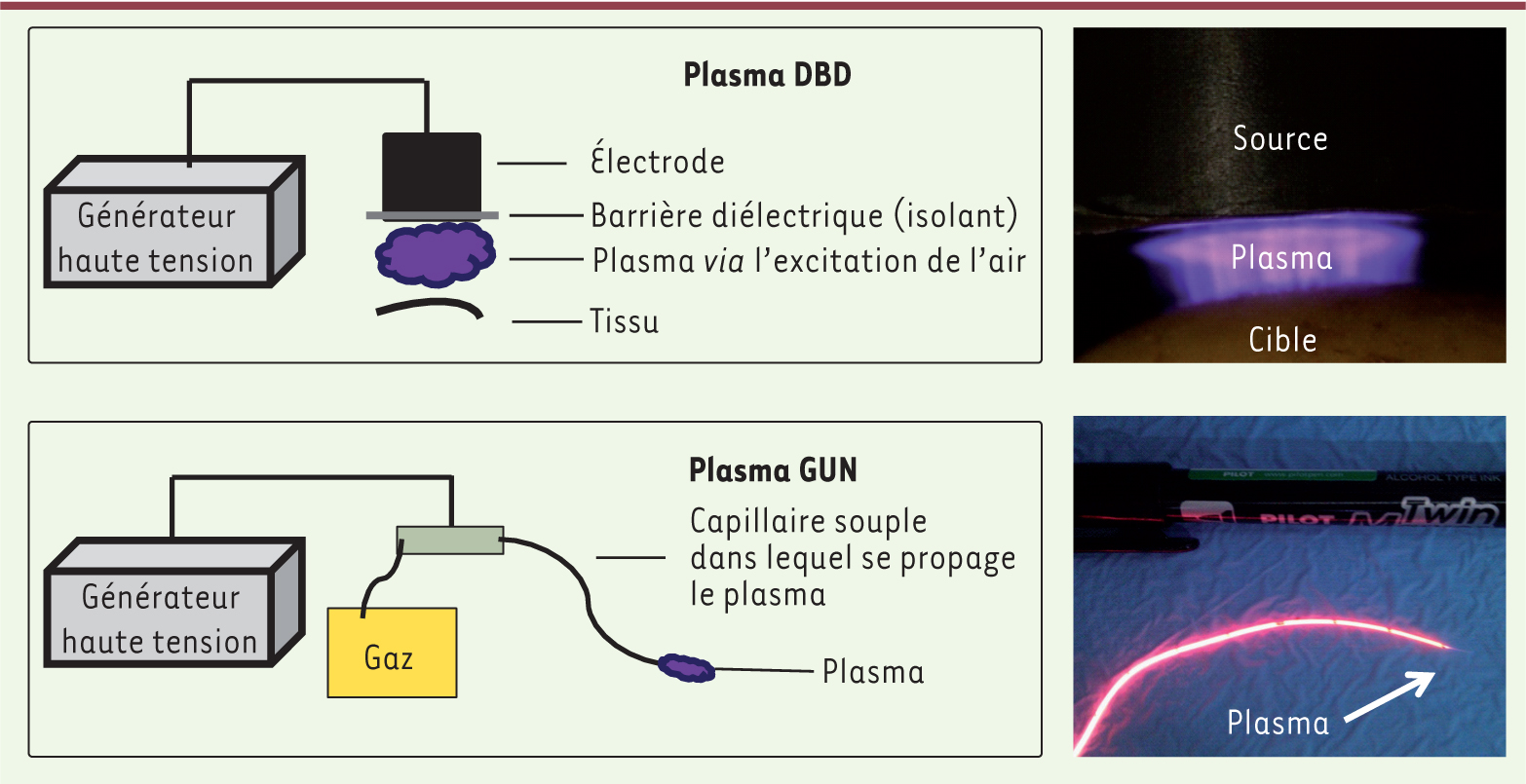
Un plasma, en physique, est un gaz ionisé obtenu par l’excitation de ce gaz via un apport d’énergie sous forme thermique, radiative ou électrique. À ce titre, il est considéré comme le 4e état de la matière. Ce milieu présente, en général, une grande réactivité. En effet, les électrons générés entrent en collision avec les atomes et les molécules de gaz et les activent. Il se produit alors une ionisation. Le plasma contient de nombreuses charges, des radicaux, des molécules excitées, et il génère des rayonnements ultraviolets ainsi qu’un champ électrique transitoire. Les avancées récentes réalisées dans le développement des plasmas ont conduit à la production de plasmas non thermiques, générés à pression atmosphérique et à température ambiante, au contraire des plasmas thermiques qui sont employés dans l’électrocautérisation, l’hémostase ou la section de tissus dont le fonctionnement repose sur l’utilisation de la chaleur. Dans le plasma non thermique, les espèces moléculaires en présence seraient à l’origine de l’activité thérapeutique et la tolérance des tissus traités serait meilleure [1]. Ainsi, le développement des plasmas froids a conduit à l’émergence d’un nouveau champ d’application, appelé « plasma médecine ». Pour obtenir des plasmas froids, on utilise un courant électrique produit par un générateur haute tension ; celui-ci excite le gaz sélectionné et le fait passer de l’état gazeux à l’état de plasma. Cet état excité du gaz disparaît dès l’arrêt de l’apport de courant. Différentes sources peuvent être utilisées pour générer un plasma froid atmosphérique et permettre une application in situ. La plus courante est la décharge à barrière diélectrique (DBD) qui permet d’exciter le gaz se situant entre le tissu à traiter et la sonde d’application (Figure 1). D’autres types de source tels que le plasma gun permettent la production de plasma dans des tubes capillaires par excitation d’un gaz rare (hélium ou néon) via un courant électrique. Le plasma chemine sur une distance plus ou moins longue jusqu’à la zone à traiter (Figure 1) [2]. L’ensemble du dispositif est présenté sur la Figure 2. La nature du gaz excité varie : il s’agit soit de l’air ambiant dans le cas de la DBD, soit de gaz noble (argon, hélium, néon) pour le plasma gun. Il est aussi possible d’utiliser des mélanges de gaz (par exemple argon avec 5 % d’oxygène), qui permettent d’adapter aux besoins les espèces excitées qui seront formées dans le plasma.
 | Figure 1. Les deux dispositifs de plasmas froids. En haut, un plasma froid généré par DBD (décharge à barrière diélectrique), la surface de traitement peut être adaptée en fonction de la cible. En bas, le plasma gun permet de générer un plasma froid à la sortie de capillaires de différents diamètres permettant d’envisager le traitement de tumeurs difficiles d’accès comme des dysplasies pulmonaires par voie endoscopique. |
 | Figure 2. Photo de l’ensemble du dispositif plasma gun. |
|
Applications des « plasmas médecine » en cancérologie Actuellement, le principal champ d’application du plasma froid est la décontamination : le plasma a en effet une activité sur de nombreuses variétés de souches bactériennes et de virus [3]. La facilité d’utilisation des plasmas froids à pression atmosphérique permet d’envisager leur utilisation pour la décontamination d’instruments médicaux fragiles, mais aussi de tissus vivants1. Des études de tolérance ont montré qu’à faibles doses (temps de traitement d’environ 1 min), le plasma ne présente aucun danger et peut être appliqué sur la peau sans induire de dommages [4]. Le pouvoir décontaminant du plasma pourrait, entre autres, être utilisé pour la décontamination des mains du personnel médical en milieu hospitalier2 [5]. D’autres champs d’application sont explorés comme l’hémostase, ou encore l’amélioration de la cicatrisation. Le plasma, s’il est délivré à forte dose (temps de traitement d’environ 5 à 6 min), est capable d’induire l’apoptose (mort cellulaire programmée) de cellules cancéreuses in vitro [6] et des études aux résultats prometteurs dans le domaine de la cancérologie laissent présager de l’intérêt du plasma comme nouvelle stratégie thérapeutique. Dans un article récemment publié [7], nous avons observé une activité antitumorale significative du plasma froid in vitro vis-à-vis de différentes lignées cellulaires cancéreuses et en particulier d’une lignée de cellules de glioblastome humain (U87-MG), très résistantes aux chimiothérapies classiques ainsi qu’à la radiothérapie. L’étude mécanistique de cet effet antitumoral montre que le principal promoteur est la génération d’espèces actives de l’oxygène (EAO) - principalement le H2O2 ou encore le O2- - dans la zone traitée. En effet, l’utilisation d’inhibiteurs de ces espèces montre une annulation des effets antitumoraux. Le plasma agit principalement sur les cellules cancéreuses en induisant des cassures dans l’ADN par l’intermédiaire de ces EAO. Comme dans le cas d’autres traitements anticancéreux tels que la radiothérapie, la formation de ces dommages à l’ADN induit l’arrêt de la prolifération des cellules, le cycle cellulaire étant bloqué pendant la tentative de réparation de l’ADN. Dans la plupart des cas, ces cassures sont létales pour les cellules et conduisent à une apoptose massive ; un tel phénomène a été observé après traitement au plasma. Ces données in vitro ont conduit à l’évaluation de l’effet antitumoral du plasma in vivo, dans un modèle de greffe sous cutanée de cellules cancéreuses humaines chez la souris nude. Préalablement, des études de tolérance ont montré que l’exposition au plasma n’engendrait aucun effet secondaire chez la souris, ni cardiorespiratoire ni cutané [8]. Nous avons confirmé l’effet antitumoral in vivo, puisque le traitement quotidien des tumeurs par plasma pendant cinq jours consécutifs permet d’en réduire significativement le volume par rapport aux tumeurs non traitées. Cet effet, observable dès la fin du cycle de traitement, aboutit à une augmentation significative (environ 60 %) de la survie des animaux [9]. Cette réponse résulte en partie d’un arrêt du cycle cellulaire in vivo mais également d’une induction d’apoptose dans l’ensemble de la tumeur. Cette étude démontre pour la première fois le potentiel antitumoral in vivo des plasmas froids, même si de nombreuses questions restent à élucider : mécanismes d’action, pénétration du plasma, diffusion des EAO dans la zone traitée. Ces résultats très encourageants permettent d’envisager le traitement de tumeurs en utilisant un plasma « fibré ». Il est en effet possible de générer des plasmas froids à la sortie d’un tube capillaire de n’importe quel diamètre, et ainsi de pouvoir envisager une application locale, au contact direct de tumeurs particulièrement difficiles d’accès. Cette approche thérapeutique semble d’autant plus intéressante qu’elle pourra être couplée à la mise en œuvre simultanée de l’imagerie par fluorescence dans le proche infrarouge qui va être exploitable à court terme en imagerie per-opératoire à champ ouvert, ou par fibroscopie ou cœlioscopie [10]. Elle requiert l’utilisation de « sondes intelligentes » couplées à un agent de contraste fluorescent dans le proche infrarouge, et devrait permettre de localiser des biomarqueurs tumoraux (protéase du type cathepsine3, intégrines ou antigène tumoral) et donc améliorer la sensibilité et la spécificité de la détection des foyers tumoraux en guidant dans le même temps une application du plasma fibré. Le champ d’application envisagé concerne plus particulièrement les récidives colorectales, les tumeurs intracanalaires papillaires du pancréas, les plages de dysplasie oropharyngée ou pulmonaire. Si ce plasma fibré présente effectivement un potentiel antitumoral important, il constituera peut-être dans les années à venir une nouvelle alternative dans la prise en charge de ces pathologies. |
M. Vandamme déclare avoir des liens durables ou permanents avec l’entreprise Germitec SAS. E. Robert, S. Lerondel, J.M. Pouvesle, A. Le Pape déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Footnotes |
1. Fridman G, Friedman G, Gutsol A, et al. Applied plasma medicine . Plasma Process Polym. 2008; ; 5 : :503.–533. 2. Robert E, Barbosa E, Dozias S, et al. Experimental study of a compact nanosecond plasma gun . Plasma Process Polym. 2009; ; 6 : :795.–802. 3. Laroussi M. Low temperature plasma-based sterilization: overview and state-of-the-art . Plasma Process Polym. 2005; ; 2 : :391.–400. 4. Dobrynin D, Wu A, Kalghatgi S, et al. Live pig skin tissue and wound toxicity of cold plasma treatment . Plasma Medicine. 2011; ; 1 : :93.–108. 5. Morfill GE, Shimizu T, Steffes B, Schmidt HU. Nosocomial infections-a new approach towards preventive medicine using plasmas . New J Phys. 2009; ; 11 : :115019.–115029. 6. Fridman G, Shereshevsky A, Jost MM, et al. Floating electrode dielectric barrier discharge plasma in air promoting apoptotic behavior in melanoma skin cancer cell lines . Plasma Chem Plasma Process. 2007; ; 27 : :163.–176. 7. Vandamme M, Robert E, Lerondel S, et al. ROS implication in a new antitumor strategy based on non-thermal plasma . Int J Cancer. 2011, 23 juin (online).. 8. Vandamme M, Robert E, Pesnel S, et al. Antitumor effect of plasma treatment on U87 glioma xenografts: preliminary results . Plasma Process Polym. 2010; ; 7 : :264.–273. 9. Vandamme M, Robert E, Dozias S, et al. Response of human glioma U87 xenografted on mice to non thermal plasma treatment . Plasma Medicine. 2011; ; 1 : :27.–43. 10. Frangioni JV. In vivo near-infrared fluorescence imaging . Curr Opin Chem Biol. 2003; ; 7 : :626.–634. |