| |
| Med Sci (Paris). 2012 February; 28(2): 146–149. Published online 2012 February 27. doi: 10.1051/medsci/2012282010.Cellules épithéliales médullaires thymiques exprimant Aire Acteurs clés dans l’induction de la tolérance des cellules T Magali Irla1*** 1Département de pathologie et immunologie, centre médical universitaire de Genève, 1, rue Michel Servet, 1211Genève, Suisse MeSH keywords: Animaux, Différenciation cellulaire, génétique, immunologie, Microenvironnement cellulaire, Expression des gènes, Humains, Tolérance immunitaire, Souris, Modèles biologiques, Lymphocytes T, métabolisme, physiologie, Thymus (glande), cytologie, Facteurs de transcription |
Le thymus, organe lymphoïde primaire, est le site majeur de la production des lymphocytes T dont le rôle est essentiel dans la réponse immunitaire aux agents pathogènes et aux cellules tumorales. Cet organe coordonne les événements de sélection conduisant au développement d’un répertoire de lymphocytes T fonctionnels non réactifs vis-à-vis du soi. Ces événements de sélection sont essentiels pour éviter la génération de cellules T autoréactives, responsables du développement de maladies auto-immunes. Lors de leur différenciation dans le thymus, les cellules T dont le TCR (T cell receptor) réagit avec les antigènes (Ag) du soi (cellules autoréactives) sont éliminées dans une région anatomique spécifique, appelée médulla. Les cellules épithéliales médullaires thymiques (mTEC) jouent un rôle clé dans l’élimination des cellules T autoréactives grâce à leur propriété unique d’exprimer une grande diversité d’Ag spécifiques de tissus périphériques [1]. Les thymocytes dont le TCR a une forte affinité pour ces Ag sont éliminés par apoptose. Des études récentes ont permis d’appréhender les mécanismes moléculaires et cellulaires contrôlant l’homéostasie et l’état de différenciation des mTEC nécessaires à l’induction de la tolérance au soi des cellules T. |
La médulla thymique : un microenvironnement spécialisé dans l’élimination des cellules T autoréactives Les thymocytes CD4+ ou CD8+ (dits simple positifs [SP]) qui ont été sélectionnés positivement dans le cortex thymique sont capables de reconnaître, via leur TCR, un complexe CMH (complexe majeur d’histocompatiblité)/peptide présenté par les cellules thymiques présentatrices de l’Ag. Ces thymocytes SP migrent ensuite dans la médulla où ceux dont le TCR a une forte affinité pour des Ag du soi sont éliminés par sélection négative. La médulla est composée d’un dense réseau de cellules dendritiques (DC) et de mTEC (Figure 1A). Ces dernières jouent un rôle essentiel dans l’élimination des cellules T autoréactives grâce à leur propriété unique d’exprimer une grande diversité d’Ag spécifiques de tissus périphériques [1]. Les mTEC sont hétérogènes et seule une fraction d’entre elles (environ 25 %), dites matures, expriment le facteur de transcription AIRE (autoimmune regulator element), responsable de l’expression de plusieurs centaines d’Ag du soi1 (Figure 1B) (→). Ces Ag exprimés par les mTEC sont soit directement présentés par les mTEC, soit cross-présentés par les cellules dendritiques aux thymocytes SP [2]. La médulla constitue donc un microenvironnement spécialisé dans l’élimination des cellules T autoréactives via une collaboration étroite entre les mTEC et les cellules dendritiques.
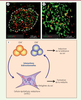 | Figure 1. Composition et contrôle de l’épithélium médullaire thymique. A. Aspect en microscopie confocale d’une préparation de coupe de thymus d’une souris C57BL/6 sauvage, marquée avec des anticorps anti-kératine 14 qui détectent les mTEC (vert) et des anticorps anti-CD11c détectant les cellules dendritiques (rouge). B. Aspect en microscopie confocale d’une préparation de coupe de thymus de souris C57BL/6 sauvage, marquée avec des anticorps anti-kératine 14 détectant les mTEC (vert) et des anticorps anti-AIRE détectant le facteur de transcription AIRE (rouge). C. Les thymocytes CD4+ et CD8+ agissent sur le développement et l’organisation des mTEC, permettant ainsi la formation de la médulla thymique. En retour, les mTEC, par leur expression de nombreux antigènes du soi, jouent un rôle essentiel dans l’induction de la tolérance au soi des thymocytes CD4+ et CD8+. m, médulla. |
(→) Voir la Brève de Magali Irla, page 160 de ce numéro |
Les interactions entre les thymocytes SP et les mTEC contrôlent le développement de la médulla La sélection des thymocytes SP, et donc l’induction de la tolérance au soi, sont étroitement contrôlées par les mTEC grâce à la capacité de ces dernières à exprimer de nombreux Ag du soi. Ces interactions sont bidirectionnelles car le développement et l’organisation des mTEC sont à leur tour contrôlés par la présence des thymocytes SP [3] (Figure 1C). Les souris présentant une absence totale de thymocytes SP, par exemple les souris déficientes pour la protéine tyrosine kinase Zap70 ou pour la chaîne α du TCR, ont une altération du développement médullaire. Les médullas sont désorganisées et leur cellularité en mTEC est réduite [4]. La réintroduction de cellules T matures chez les souris SCID (severe combined immunodeficient), présentant le même défaut médullaire que les souris mutantes Zap70−/− ou Tcrα−/−, permet la reconstitution des régions médullaires [3]. Par conséquent le développement des mTEC, et donc de la médulla, requiert la présence de thymocytes SP. |
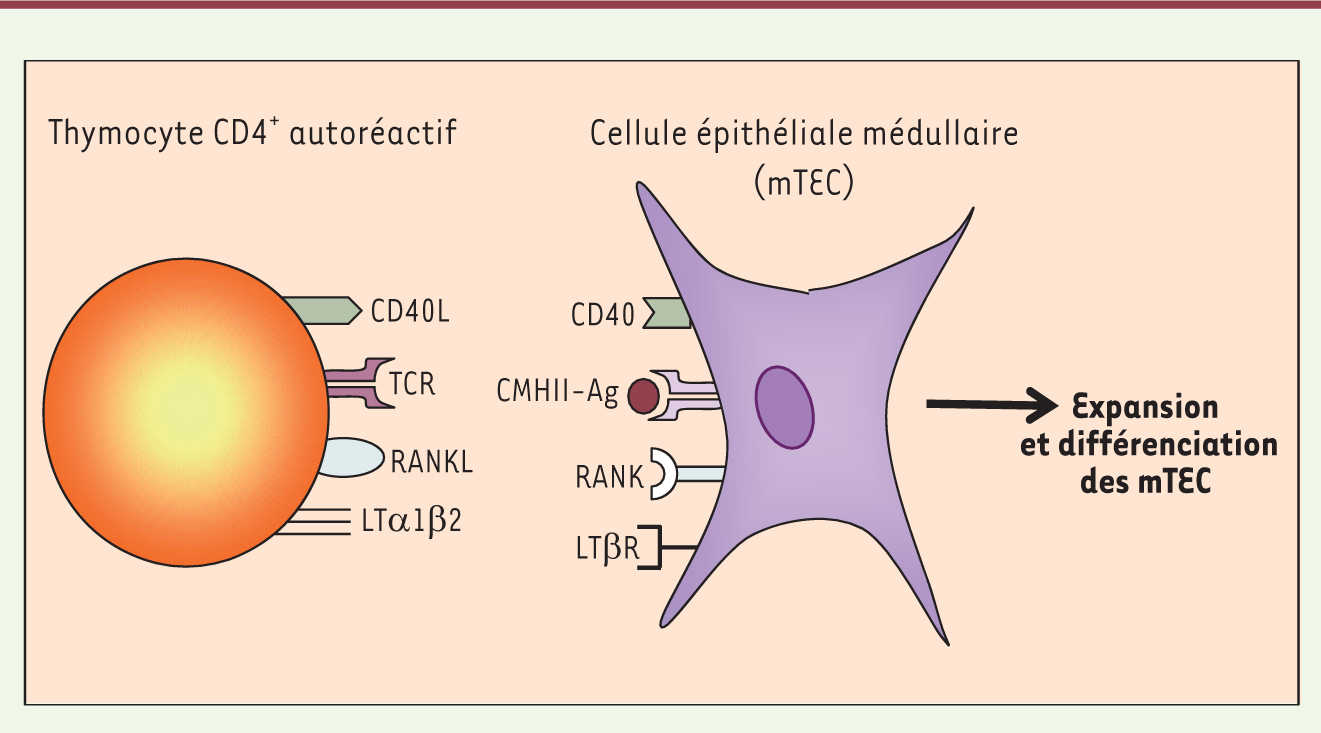
Les thymocytes CD4 + autoréactifs contrôlent l’homéostasie et la différenciation des mTEC Bien que le rôle critique des mTEC exprimant le facteur de transcription AIRE dans l’élimination des thymocytes autoréactifs soit démontré, l’identification du sous-type de thymocytes SP et des acteurs moléculaires régulant la différenciation et la richesse en mTEC n’a été appréhendée que récemment. Le développement des mTEC AIRE+ requiert la présence des thymocytes CD4+ et non des thymocytes CD8+. Notre laboratoire a en effet démontré l’absence quasi-totale des mTEC AIRE+ chez les souris dépourvues de thymocytes CD4+, tandis que chez les souris dépourvues de thymocytes CD8+, leur nombre est similaire à celui qui est observé chez des souris sauvages [5]. De plus, seuls les thymocytes CD4+ autoréactifs sont capables de contrôler le développement des mTEC AIRE+ [5]. En effet, comme c’était le cas chez les souris dépourvues de thymocytes CD4+, si on abolit sélectivement chez des souris l’expression des molécules de CMH de classe II (CMHII) à la surface des mTEC, le nombre des mTEC AIRE+ est fortement réduit. Cela démontre qu’une interaction entre le TCR des thymocytes CD4+ et le CMH de classe II des mTEC est nécessaire au développement des mTEC AIRE+. Par ailleurs, le développement des mTEC AIRE+ nécessite des interactions spécifiques de l’Ag qu’elles présentent [5]. Le nombre de mTEC AIRE+ est ainsi fortement réduit chez les souris transgéniques OT-II:Rag2−/−, qui possèdent uniquement des thymocytes CD4+ exprimant un TCR reconnaissant un peptide dérivé de l’ovalbumine qui n’est pas exprimé par les mTEC. En revanche, le phénotype normal est restauré chez les souris transgéniques Rip-mOVA:OT-II:Rag2−/−, qui possèdent comme précédemment uniquement des thymocytes CD4+ exprimant un TCR reconnaissant un peptide dérivé de l’ovalbumine. Cependant, chez ces souris, cet antigène est spécifiquement exprimé par les mTEC. Par conséquent, pour assurer un développement normal des mTEC exprimant le facteur de transcription AIRE, il faut qu’il y ait une interaction spécifique de l’Ag avec les thymocytes CD4+via leur TCR et les molécules de CMHII exprimées par les mTEC [6] (Figure 2).
 | Figure 2. Signaux moléculaires intervenant dans l’interaction entre les thymocytes CD4+ autoréactifs et les mTEC. Les signaux de la superfamille TNF, LTβR-LTα1β2, RANK-RANKL et CD40-CD40L, responsables de l’expansion et de la différenciation des cellules épithéliales médullaires thymiques (mTEC) sont délivrés lors d’interactions cellulaires spécifiques de l’antigène entre les mTEC et les thymocytes CD4+ autoréactifs. Les thymocytes CD4+ expriment les ligands LTα1β2, RANKL et CD40L dont les récepteurs respectifs, LTβR, RANK et CD40 sont exprimés par les mTEC. Ces signaux cellulaires sont délivrés lors d’interactions cellulaires spécifiques de l’Ag entre les thymocytes CD4+, via leur TCR, et les mTEC, via leurs molécules de CMHII. Ag : antigène ; CMHII : complexe majeur d’histocompatiblité de classe II; TCR : T cell receptor. |
Des études récentes ont identifié les acteurs moléculaires impliqués lors de ces interactions spécifiques de l’Ag entre les thymocytes CD4+ autoréactifs et les mTEC. Trois couples ligand-récepteur membres de la superfamille TNFR/TNF (tumor necrosis factor receptor/tumor necrosis factor), LTβR (lymphotoxin β receptor)-LTα1β2, RANK-RANKL (receptor activator of nuclear factor κB et son ligand) et CD40-CD40L, ont été impliqués dans l’organisation et la différenciation des mTEC [4, 5, 7-9]. Les récepteurs RANK, CD40 et LTβR sont exprimés à la surface des mTEC alors que leurs ligands respectifs RANKL, CD40L et LTα1β2 sont exprimés à la surface des thymocytes CD4+(Figure 2). L’absence de chacun de ces récepteurs et ligands entraîne, chez les souris déficientes, des défauts d’organisation et de différenciation des mTEC à des degrés divers. Les signaux RANK-RANKL et CD40-CD40L agissent en synergie pour contrôler le nombre des mTEC AIRE+ tandis que le signal LTβR-LTα1β2 est impliqué préférentiellement dans l’organisation et la richesse globale en mTEC [7, 8]. Enfin, la combinaison de ces trois signaux LTβR-LTα1β2, RANK-RANKL et CD40-CD40L, déclenchés uniquement dans le contexte d’une interaction spécifique de l’Ag entre les mTEC et les thymocytes CD4+, est nécessaire à l’organisation et à la différenciation correctes des mTEC (Figure 2). |
Les mTEC exprimant AIRE sont nécessaires à l’induction de la tolérance au soi des cellules T. Leur différenciation est contrôlée en retour par les thymocytes autoréactifs CD4+ via l’expression spécifique de CD40L et RANKL. Ces interactions bidirectionnelles constituent un mécanisme de régulation qui permet au thymus d’adapter sa capacité à éliminer de façon optimale les cellules T autoréactives. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Je remercie le Pr W. Reith (université de Genève) pour m’avoir donné l’opportunité de développer cette thématique. Je remercie les Pr S. Hugues, Dr A. Sergé et Dr Y. Emre (université de Genève) pour la relecture de cette Nouvelle. Ce travail a été financé par un subside Ambizione (grant PZ00P3-131945) du Fonds national suisse.
|
Footnotes |
1. Derbinski J, Schulte A, Kyewski B, Klein L. Promiscuous gene expression in medullary thymic epithelial cells mirrors the peripheral self . Nat Immunol. 2001; ; 2 : :1032.–1039. 2. Klein L, Hinterberger M, von Rohrscheidt J, Aichinger M. Autonomous versus dendritic cell-dependent contributions of medullary thymic epithelial cells to central tolerance . Trends Immunol. 2011; ; 32 : :188.–193. 3. Surh CD, Ernst B, Sprent J. Growth of epithelial cells in the thymic medulla is under the control of mature T cells . J Exp Med. 1992; ; 176 : :611.–616. 4. Hikosaka Y, Nitta T, Ohigashi I, et al. The cytokine RANKL produced by positively selected thymocytes fosters medullary thymic epithelial cells that express autoimmune regulator . Immunity. 2008; ; 29 : :438.–450. 5. Irla M, Hugues S, Gill J, et al. Autoantigen-specific interactions with CD4+ thymocytes control mature medullary thymic epithelial cell cellularity . Immunity. 2008; ; 29 : :451.–463. 6. Irla M, Hollander G, Reith W. Control of central self-tolerance induction by autoreactive CD4+ thymocytes . Trends Immunol. 2010; ; 31 : :71.–79. 7. Boehm T, Scheu S, Pfeffer K, Bleul CC. Thymic medullary epithelial cell differentiation, thymocyte emigration, and the control of autoimmunity require lympho-epithelial cross talk via LTbetaR . J Exp Med. 2003; ; 198 : :757.–769. 8. Akiyama T, Shimo Y, Yanai H, et al. The tumor necrosis factor family receptors RANK and CD40 cooperatively establish the thymic medullary microenvironment and self-tolerance . Immunity. 2008; ; 29 : :423.–437. 9. Rossi SW, Kim MY, Leibbrandt A, et al. RANK signals from CD4+3− inducer cells regulate development of aire-expressing epithelial cells in the thymic medulla . J Exp Med. 2007; ; 204 : :1267.–1272. |