| |
| Med Sci (Paris). 2012 March; 28: 19–23. Published online 2012 April 9. doi: 10.1051/medsci/2012281s106.Tests diagnostiques et thérapies ciblées en cancérologie Enjeux économiques Patricia Marino,1,2,3* François Bertucci,1,3,4 Anthony Gonçalves,1,3,4 and Valérie Seror 2,3 1Institut Paoli-Calmettes, Marseille, France 2Inserm, UMR 912, sciences économiques et sociales, systèmes de santé, sociétés, IRD, F-13000, Marseille, France 3université Aix-Marseille, F-13000Marseille, France 4centre de recherche en cancérologie de Marseille, UMR891-Inserm - Institut Paoli-Calmettes, Marseille, France |
Le développement considérable des thérapies ciblées associées à un test moléculaire de diagnostic dit « test compagnon » (companion diagnostic) a profondément modifié la prise en charge du cancer au cours de ces dix dernières années. Les traitements « one size fits all » (un même médicament pour tous les patients présentant un même tableau clinique) sont ainsi de plus en plus souvent remplacés par des traitements ciblés, administrés à des sous-groupes de patients en fonction des caractéristiques biologiques de leur tumeur révélées par un biomarqueur. Une telle approche, qui couple le médicament à un biomarqueur compagnon, vise à améliorer la prise en charge des patients tout en en maîtrisant les coûts : (1) en évitant la prescription de médicaments inutiles, car inefficaces, potentiellement toxiques et coûteux (l’objectif est alors d’éviter des effets indésirables sans bénéfice thérapeutique) ; (2) en augmentant la réponse aux traitements grâce à la prescription d’un traitement mieux adapté aux caractéristiques de la tumeur. Toutefois, ces traitements ciblés sont très onéreux. Dans un contexte de rareté des ressources, donc d’arbitrages et de choix nécessaires, savoir si le bénéfice qu’en retirent les patients, qui peut s’exprimer en gain de durée et/ou de qualité de vie, justifie le coût supporté par la collectivité, est une préoccupation essentielle. Cet article a pour objectif de dresser l’état des lieux des dépenses liées à l’utilisation des traitements innovants associés ou non à un test diagnostique « compagnon ». Puis, à partir de l’exemple d’un test d’identification de type signature d’expression génomique, nous présenterons certaines des conditions assurant l’efficience économique d’une diffusion de ces tests, et nous illustrerons l’importance des mécanismes de régulation en termes de décision de prise en charge et de remboursement des couples biomarqueurs/médicaments pouvant influencer les stratégies des acteurs industriels. |
Innovation et croissance des dépenses de santé Traditionnellement, l’innovation en santé est présentée au plan macroéconomique comme un des principaux facteurs de la croissance des dépenses de santé [1]. En effet, le plus souvent, les progrès thérapeutiques s’accomplissent au prix de rendements décroissants : les coûts marginaux par année de vie gagnée tendent à augmenter de plus en plus rapidement au fur et à mesure que les innovations médicamenteuses mobilisent des ressources croissantes (liées notamment au prix élevé des molécules innovantes, prix en partie justifié par les coûts croissants d’amortissement des efforts de recherche et développement) pour des gains, certes statistiquement significatifs dans les essais cliniques, mais limités en termes de survie additionnelle. Une des raisons principales de ces rendements décroissants est que les gains d’efficacité de l’innovation concernent « en moyenne » l’ensemble des patients traités, agrégeant ainsi des patients « bons répondeurs » à tel ou tel traitement nouveau avec des patients pour lesquels ces mêmes traitements sont inadaptés ou inutiles, alors même que les effets secondaires peuvent affecter de manière très importante leur qualité de vie. Dans un contexte où les contraintes économiques auxquelles les systèmes de santé doivent faire face sont de plus en plus fortes, la question se pose de fixer des limites aux interventions médicales et aux investissements qu’il est souhaitable que la collectivité leur consacre. |
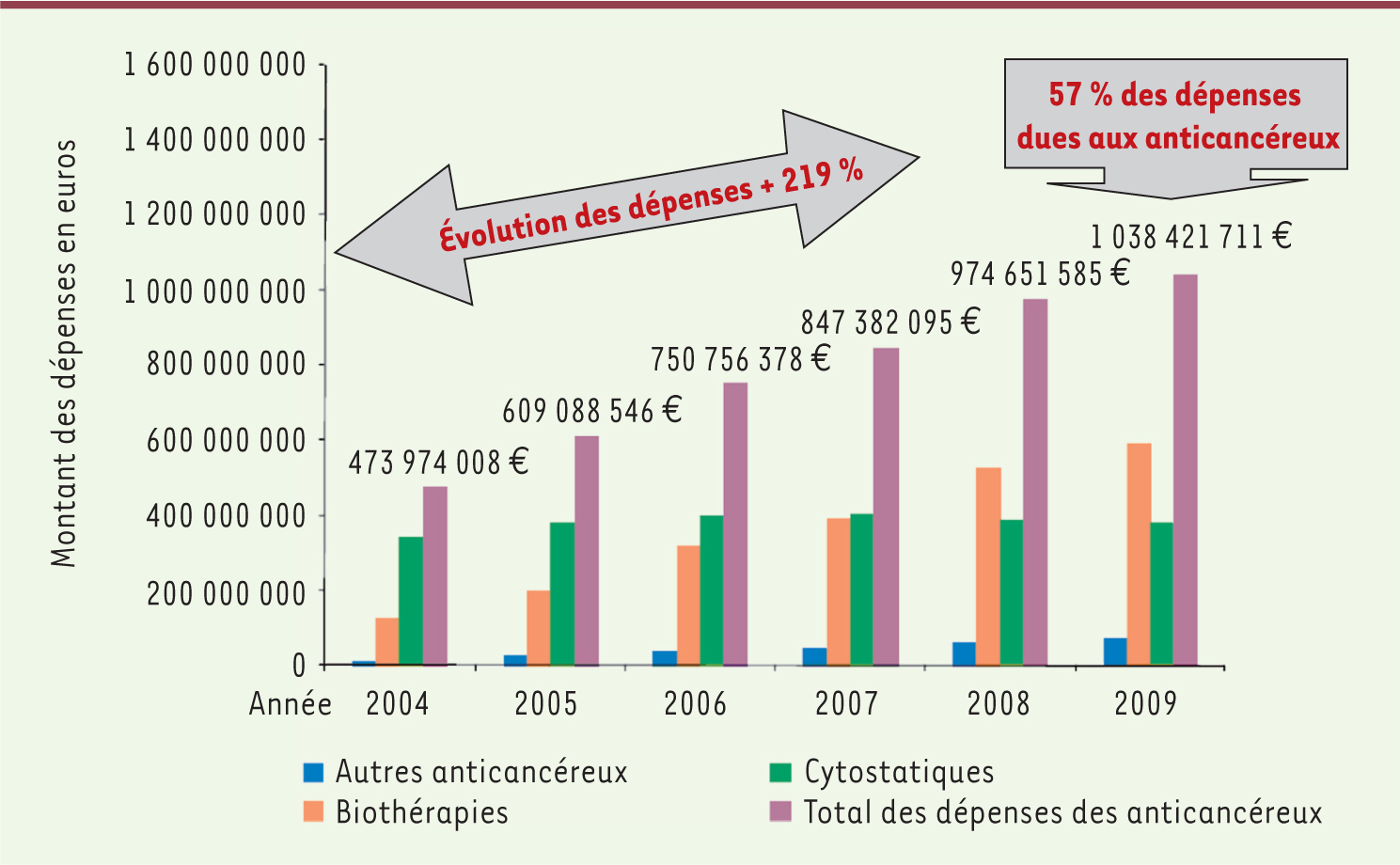
Une forte augmentation des ventes de médicaments anticancéreux, en particulier de médicaments innovants En cancérologie, les innovations thérapeutiques coûteuses appartiennent pour la plupart au domaine du médicament. Les avancées récentes de la biologie moléculaire ont conduit à la mise à disposition de nouvelles drogues très onéreuses - les thérapies moléculaires ciblées -, générant des coûts de prise en charge de plus en plus élevés. Une étude américaine a récemment estimé que le montant annuel des dépenses liées au traitement du cancer aux États-Unis devrait atteindre 158 milliards de dollars en 2020, sur la base du seul effet du vieillissement de la population, soit une augmentation de 27 % par rapport à 2010. En intégrant l’effet de l’augmentation du coût des innovations diagnostiques et thérapeutiques, cette augmentation pourrait atteindre 39 % [2]. En France, les données les plus récentes publiées par l’Institut national du cancer (INCa) [3] confirment cette tendance générale : la croissance des dépenses en médicaments anticancéreux est forte et continue. Leur coût représente 57 % du coût total des médicaments innovants pris en charge en sus des forfaits de la tarification à l’activité (T2A)1,. Cette forte croissance est liée à deux phénomènes concomitants. Tout d’abord un usage croissant des « anciennes » molécules (utilisées chez plus de malades, dans de nouvelles indications, pour des durées prolongées), qui conduit à un accroissement global des dépenses médicamenteuses dans le temps. Mais surtout, cette très forte progression résulte d’une accélération très importante de l’usage de médicaments dits « de biothérapie » ou « innovants » (Figure 1) qui constituent aujourd’hui une part croissante des dépenses globales d’anticancéreux. On observe ainsi une augmentation de plus de 200 % des dépenses de thérapies moléculaires ciblées entre 2004 et 2007, et, en 2009, ces médicaments représentent plus de la moitié des dépenses, pour la deuxième année consécutive. En 2010, cette part s’élève à plus de 61 % des dépenses globales d’anticancéreux ! Parmi les cinq molécules anticancéreuses les plus prescrites en 2010, quatre sont des thérapies ciblées : bévacizumab, rituximab, trastuzumab et cétuximab qui concentrent 60 % des dépenses concernant les médicaments anticancéreux [3].
 | Figure 1. Dépenses (€) dues au coût des médicaments de la liste et des prestations d’hospitalisations, par catégorie d’anticancéreux. Source : © situation de la chimiothérapie des cancers en 2010 (INCa 2010). |
|
Molécules innovantes, mais de plus en plus onéreuses Une caractéristique essentielle de ces médicaments innovants est leur prix très élevé. Si certains d’entre eux ont permis des avancées considérables en modifiant radicalement le pronostic de la maladie (Imatinib dans les leucémies myéloïdes chroniques et dans les tumeurs stromales gastro-intestinales par exemple), leur bénéfice reste beaucoup plus modeste dans de nombreuses autres indications [4]. Les exemples de médicaments améliorant de façon très marginale la survie pour des prix très élevés sont nombreux. La combinaison de coûts très élevés avec des bénéfices faibles pose légitimement la question de l’efficience économique, et même sociale de ces molécules. Le rapport coût-efficacité de certaines molécules comme le cétuximab ou le bévacizumab est alarmant. Par exemple, le rapport coût-efficacité incrémental d’une stratégie incluant le bévacizumab dans le traitement du cancer de l’ovaire a été évalué à 401 000 $ par année de vie sans progression gagnée [5] ! Il « suffirait » toutefois d’une baisse du prix de la molécule de 25 % pour que le rapport s’approche des valeurs plus communément acceptées, de l’ordre de 100 000 $ par année de vie sans progression gagnée. Au-delà des préoccupations grandissantes sur les possibilités de financement de ces thérapies ciblées, c’est également leur légitimité et les implications pour les autres bénéficiaires du système de santé qui sont posées [6–8]. Peut-on en effet considérer qu’il est socialement acceptable de diffuser un traitement à 80 000 $ pour améliorer l’espérance de vie de 1,2 mois en moyenne [9] ? L’ASCO (American society of clinical oncology) a d’ailleurs affiché clairement dans ses recommandations de 2009 une volonté de prise en compte du coût de la prise en charge du cancer [10]. Fait nouveau, la question des coûts de prise en charge trouve également un écho dans la presse « grand public », suite notamment au rapport de l’Académie de médecine2 mettant en garde contre une mauvaise utilisation des ressources. Au-delà des instances réglementaires, c’est le monde de l’oncologie qui place désormais cette question au cœur des débats sur le développement et les possibilités de diffusion des nouveaux traitements du cancer. |
Une prescription de « tests compagnons » en plein essor : quel impact sur les coûts ? La mise à disposition des tests diagnostiques moléculaires qui permettent d’identifier les patients candidats à un traitement donné pourrait permettre de ralentir la hausse des coûts de prise en charge du cancer. Pour assurer un accès équitable aux tests moléculaires innovants et aux thérapies ciblées (mesure 21 du plan Cancer : Garantir un accès égal aux traitements et aux innovations), 28 plates-formes de génétique moléculaire des cancers ont été mises en place à l’initiative de l’INCa. Ainsi, selon les données de l’INCa [11] en 2009, neuf biomarqueurs conditionnent l’accès à huit thérapies ciblées (Tableau I). L’obligation d’utiliser un biomarqueur préalablement à la prescription d’un médicament est un facteur évidemment favorable à la croissance du marché des tests compagnons. Ainsi, le nombre de tests réalisé en France est en forte augmentation : en 2010, 7 633 tests HER2 précédant la prescription de l’Herceptin®, avec une extension récente au cancer de l’estomac ; 16 581 tests KRAS dans le cas de la prescription d’Erbitux®, avec un nombre de tests multiplié par 16 en 2 ans ; 16 834 tests pour la prescription de Iressa® ou Tarceva® dans le cancer du poumon ; plus de 20 000 tests pour la prescription du Glivec® (Imatinib) (Tableau I). D’un point de vue économique, le surcoût initial lié à la réalisation systématique d’un test (pour tous les patients) préalablement à la prescription d’un médicament pourrait être plus que compensé par une baisse des coûts de prise en charge si ce test aboutit à un meilleur ciblage thérapeutique. Ceci suppose bien entendu que le coût du test soit faible comparativement à celui qu’induit le traitement. En garantissant une nette amélioration de l’efficacité chez les patients ciblés, ces tests permettraient par ailleurs d’optimiser les rapports coût-efficacité, assurant ainsi la pertinence économique de leur diffusion. C’est ce qu’ont montré différents travaux évaluant l’impact économique de l’utilisation de tests diagnostiques compagnons [11–13]. Par exemple, la stratification des patients selon le statut KRAS permettrait d’économiser 604 millions de dollars par an aux États-Unis, uniquement en coûts directs de médicaments, alors que le test représenterait en lui-même une dépense totale de 13 millions de dollars [14].
Tableau I.
| Biomarqueur |
Pathologie |
Molécule prescrite |
Nombre de tests effectués en 2010 |
| Translocation BCR/ABL |
|
Imatinib (Glivec®) |
|
| 1- Détection de BCR/ABL |
|
1- Prescription de l’imatinib (Glivec®) |
1- 6 569 |
| 2- Quantification de BCR/ABL |
|
2- Suivi de la maladie résiduelle |
2- 23 849 |
|
Leucémie aiguë lymphoblastique |
|
|
| 3- Mutation d’ABL |
Leucémie myéloïde chronique |
3- Résistance à l’imatinib et prescription d’un traitement de seconde ligne : dasatinib ou nilotinib |
3- 950 |
|
| 1- Mutations de KIT |
|
|
1- 982 |
|
Tumeurs stromales gastro-intestinales |
Imatinib (Glivec®) |
|
| 2 -Mutations de PDGFRA |
|
|
2- 891 |
|
| Amplification de HER2 |
Cancer du sein |
Trastuzumab (Herceptin®) |
7 633 |
|
|
Lapatinib (Tyverb®) |
|
| Amplification de HER2 |
Cancer de l’estomac |
Trastuzumab (Herceptin®) |
330 |
| Mutation de KRAS |
Cancer colorectal |
Panitumumab (Vectibix®) |
16 581 |
|
|
Cétuximab (Erbitux®) |
|
| Mutation d’EGFR |
Adénocarcinome du poumon |
Gefitinib (Iressa®) |
16 834 |
|
|
Erlotinib (Tarceva®) |
|
Tests effectués par les plates-formes de génétique moléculaire en 2010 pour la prescription des thérapies ciblées. |
|
Exemple d’un profil d’expression génomique déterminant le type de chimiothérapie dans le traitement du cancer du sein L’utilisation de signatures d’expression génomique permettant de quantifier le risque de récidive et d’évaluer le bénéfice potentiel d’un traitement adjuvant est une autre forme de ciblage thérapeutique. Dans le cancer du sein au stade précoce, plusieurs tests commercialisés basés sur ces signatures génomiques peuvent être proposés [15–17] : les tests MammaPrint (Agendia) ou encore Oncotype DX (Genomic Health)3. Ces tests, disponibles sur le marché européen à un prix avoisinant les 4 000 $, ne sont pas remboursés actuellement. Deux larges essais randomisés dont les inclusions viennent de s’achever (TAILORx pour Oncotype DX et MINDACT pour MammaPrint) devraient permettre d’indiquer le bénéfice réel qu’apportent ces tests en pratique clinique. Une autre signature (→) prédictive de l’évolution clinique après chimiothérapie adjuvante sans taxane a été identifiée [18] ; nous avons analysé les conditions d’efficience économique de son utilisation pour orienter le choix du protocole de chimiothérapie [19]. Dans cette étude, il s’agissait de comparer deux stratégies thérapeutiques : (1) le standard thérapeutique qui combine une chimiothérapie à base de taxanes et anthracyclines pour l’ensemble des patientes ; (2) la stratégie innovante où la décision de traitement était guidée par le résultat de l’analyse génomique. Les patientes prédites comme « bonnes répondeuses » selon le résultat du test génomique étaient traitées par un protocole à base d’anthracyclines (médicament ciblé) sans taxane. Les résultats de ce travail ont montré que l’utilisation d’un profil d’expression génomique ne pourra être coût-efficace qu’en dessous d’une certaine valeur monétaire du test génomique, pour un prix donné de la molécule. Ainsi, c’est l’information combinée du prix du médicament et du prix du test qui permet d’établir la pertinence économique d’une stratégie d’identification du profil d’expression génomique pour guider la décision thérapeutique. (→) Voir encadré SA02 dans l’article de F. Bertucci, page 17 de ce numéro |
Les couples biomarqueurs/médicaments ciblés sont des biens complémentaires Cette analyse illustre parfaitement une caractéristique de ces couples test/médicament : ce sont des biens complémentaires4. En effet, dans cet exemple, le test génomique seul ne procure aucune utilité, quant au médicament, il est plus efficace s’il est prescrit sur la base des résultats du test. L’utilisation du test augmente ainsi l’utilité attendue du traitement par anthracycline. Ce travail illustre bien le fait que les conditions d’efficience doivent prendre en compte la complémentarité des couples biomarqueurs/médicaments. Notamment, cette complémentarité pose la question de savoir si tout ou partie du surplus d’utilité (amélioration de l’efficacité) que procure le couplage test/médicament sera répercuté sur le prix du test ou sur celui du médicament [20]. Ainsi, les décisions de régulation publique pourraient avoir un impact sur le développement des biomarqueurs, selon que le surplus d’utilité est capté par l’entreprise de biotechnologie (via le prix du test) ou le laboratoire pharmaceutique (via le prix de la molécule). Les incitations des industriels sont en effet dépendantes au moins en partie du niveau de remboursement de leurs produits. Actuellement, les procédures d’évaluation et de détermination des prix des médicaments et des tests sont de même nature (autorisation de mise sur le marché, décision de remboursement, fixation des prix), mais sont menées par des instances réglementaires différentes5,. Dans la pratique, il semble qu’il y ait très peu de concertation entre ces instances, même dans le cas de médicaments dont la prescription repose sur les résultats d’un test. En l’absence d’une concertation entre les organismes de réglementation, la complémentarité biomarqueur/médicament n’est pas prise en compte, alors que les règles de remboursement et la fixation des prix des biomarqueurs sont susceptibles d’avoir un impact sur les stratégies de développement des acteurs industriels, et donc sur la structuration du secteur [20]. |
Même si la part des dépenses consacrée aux médicaments anticancéreux reste faible (un peu plus de 1 % des dépenses pharmaceutiques de l’Assurance maladie), l’envolée des prix des thérapies ciblées est préoccupante dans un contexte où les contraintes économiques auxquelles les systèmes de santé doivent faire face sont de plus en plus fortes. Des choix s’imposent dans la mesure où toute décision d’engager un traitement revient implicitement à sacrifier la possibilité d’utiliser ces ressources à d’autres usages (notion de coût d’opportunité). Dans une logique d’approche ciblée, c’est-à-dire de traitement certes onéreux, mais concentrés sur un faible nombre de patients pour lesquels le bénéfice est très important, on peut s’attendre à une évolution favorable du rapport coût-bénéfice. Nul doute que les stratégies d’intégration des biomarqueurs et thérapies ciblées en routine devront faire l’objet d’évaluations économiques de type coût-efficacité, mais le point de vue des patients (notamment l’acceptabilité liée à l’usage de ces tests moléculaires) sera également un paramètre décisionnel central. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1. L’Horty Y, Quinet A, Rupprecht F. Expliquer la croissance des dépenses de santé : le rôle du niveau de vie et du progrès technique . Économie et Prévision. 1997; ; 129–130 : :257.–268. 2. Mariotto AB, Yabroff KR, Shao Y, et al. Projections of the cost of cancer care in the United States: 2010–2020 . J Natl Cancer Inst. 2011; ; 103 : :117.–128. 3. Situation de la chimiothérapie des cancers en 2010. Collection Rapports et synthèses . Boulogne-Billancourt: : INCa; , 2010. 4. Sobrero A, Bruzzi P. Incremental advance or seismic shift? The need to raise the bar of efficacy for drug approval . J Clin Oncol. 2009; ; 27 : :5868.–5873. 5. Cohn DE, Kim KH, Resnick KE, et al. At what cost does a potential survival advantage of Bevacizumab make sense for the primary treatment of ovarian cancer? A cost-effectiveness analysis . J Clin Oncol. 2009; ; 29 : :1247.–1251. 6. Hensley ML. Big costs for little gain in ovarian cancer . J Clin Oncol. 2011; ; 29 : :1230.–1232. 7. Munro AJ, Niblock PG. Cancer research in the global village . Lancet. 2010; ; 376 : :659.–660. 8. Jackson DB, Sood AK. Personalized cancer medicine-advances and socio-economic challenges . Nat Rev Clin Oncol. 2011; ; 8 : :735.–741. 9. Fojo T, Grady C. How much is life worth: Cetuximab, non-small cell lung cancer, and the $440 billion question . J Natl Cancer Inst. 2009; ; 101 : :1044.–1048. 10. Meropol NJ, Schrag D, Smith TJ, et al. American society of clinical oncology guidance statement: the cost of cancer care . J Clin Oncol. 2009; ; 27 : :3868.–3874. 11. Les tests de génétique moléculaire pour l’accès aux thérapies ciblées. Collection Rapports et synthèses . Boulogne-Billancourt: : INCa; , 2010. 12. De Lima Lopes G Jr, Segel JE, Tan DS, et al. Cost-effectiveness of epidermal growth factor receptor mutation testing and first-line treatment with gefitinib for patients with advanced adenocarcinoma of the lung . Cancer. 2011 ; 26 juillet;. doi : 10.1002/cncr.26372. 13. Blank PR, Moch H, Szucs TD, Schwenkglenks M. KRAS and BRAF mutation analysis in metastatic colorectal cancer: a cost-effectiveness analysis from a Swiss perspective . Clin Cancer Res. 2011; ; 17 : :6338.–6346. 14. Shankaran V, Bentrem DJ, Mulcahy MF, et al. Economic implications of KRAS testing in metastatic colorectal cancer . San Francisco, CA: : Gastrointestinal Cancers Symposium; , January 15–17; , 2009 . 15. Van’t Veer LJ, Dai H, van de Vijver MJ, et al. Gene expression profiling predicts clinical outcome of breast cancer . Nature. 2002; ; 415 : :530.–536. 16. Van de Vijver MJ, He YD, van’t Veer LJ, et al. A gene-expression signature as a predictor of survival in breast cancer . N Engl J Med. 2002; ; 347 : :1999.–2009. 17. Paik S, Shak S, Tang G, et al. A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer . N Engl J Med. 2004; ; 351 : :2817.–2826. 18. Bertucci F, Borie N, Roché H, et al. Gene expression profile predicts outcome after anthracycline-based adjuvant chemotherapy in early breast cancer . Breast Cancer Res Treat. 2011; ; 127 : :363.–373. 19. Marino P, Siani C, Bertucci F, et al. Economic issues involved in integrating genomic testing into clinical care: the case of genomic testing to guide decision-making about chemotherapy for breast cancer patients . Breast Cancer Res Treat. 2011; ; 129 : :401.–409. 20. Seror V, Elasri K, Avenel E. Premières applications de la pharmacogénomique en oncologie : stratégies industrielles et enjeux de régulation publique . Revue d’Économie Industrielle. 2007; ; 120 : :235.–252. 21. Gabszewicz J, Sonnac N, Wauthy X. On price competition with complementary goods . Economics Letters. 2001; ; 70 : :431.–439. 22. Bertucci F, Birnbaum D. Génomique et recherche clinique en cancérologie mammaire . Med Sci (Paris). 2012; ; 28 ((Suppl 1)) : :14.–18. |