| |
| Med Sci (Paris). 2012 January; 28(1): 109–111. Published online 2012 January 27. doi: 10.1051/medsci/2012281025.Chroniques génomiques Les points critiques du séquençage clinique Bertrand Jordan1* 1CoReBio PACA, case 901, Parc scientifique de Luminy, 13288Marseille Cedex 9, France MeSH keywords: Analyse de mutations d'ADN, économie, éthique, instrumentation, méthodes, ADN tumoral, génétique, Confidentialité des informations génétiques, Génétique médicale, Génome humain, Humains, Tumeurs, Contrôle de qualité, Reproductibilité des résultats, Analyse de séquence d'ADN |
La Chronique génomique du mois dernier (décembre 2011) [
1] présentait les dernières avancées technologiques du séquençage de nouvelle génération (NGS) et ses premières applications effectives en clinique - en clinique au sens propre, et non seulement en recherche médicale. Bien que déjà longue, cette chronique ne faisait pas le tour complet du sujet et appelait une suite portant sur un certain nombre de questions spécifiques : le niveau de qualité nécessaire, les modalités d’interprétation, les interrogations éthiques soulevées, et, bien sûr, le coût et sa prise en charge par les systèmes de santé. Voici donc quelques compléments utiles pour cet état des lieux d’une situation très évolutive.
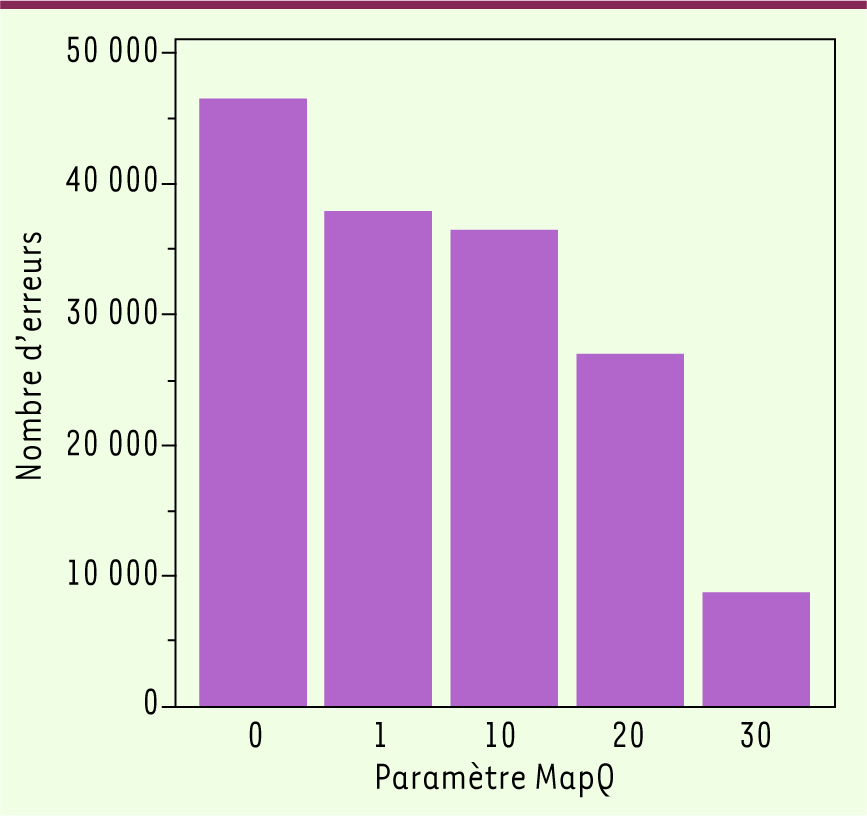
 | Figure 1
Nombre d’erreurs dans une séquence d’ADN humain. Le nombre d’erreurs est exprimé (en ordonnée) en fonction des critères de qualité appliqués, paramètre MapQ (en abscisse), qui tient compte du nombre de lectures pour chaque site. Si ce filtre n’est pas appliqué (MapQ = 0), on trouve près de 50 000 erreurs de séquence, et même avec la valeur maximale de 30, il en reste près de 10 000 (d’après les données de [
2]). |
|
La qualité : une question difficile, des cas d’espèce Rappelons qu’une séquence considérée comme de bonne qualité, avec un taux d’erreurs de 1/100 000, va fournir un génome humain contenant soixante mille erreurs de séquence1,. Un article récent [2] relate le résultat du séquençage du même ADN sur deux machines distinctes (Illumina GAII(x) et Life Sciences HiSeq 2000) à une redondance très élevée de 126 fois : la comparaison des deux séquences montre près de 50 000 différences (qui sont nécessairement des artéfacts puisqu’il s’agit du même ADN) si l’on n’applique aucun filtre de qualité, et encore près de 10 000 avec les critères les plus sévères (Figure 1). N’oublions pas qu’à l’heure actuelle, on se contente couramment de 30 passages seulement. Il n’est donc pas étonnant que, dans les articles de recherche, les mutations détectées soient systématiquement vérifiées par la technique de Sanger. Cela dit, le problème n’est pas aussi dramatique que le suggèrent ces chiffres. Si, par exemple, le séquençage effectué vise à repérer les éventuelles mutations présentes dans les exons d’une centaine de gènes représentant au total 300 kilobases d’ADN, on s’attend à quelques erreurs seulement, une dizaine tout au plus. Comme la probabilité qu’une de ces erreurs masque une mutation pathogène est quasiment nulle, on en sera quitte pour effectuer une vérification uniquement lorsqu’on détecte une altération connue comme pathogène ou susceptible de l’être (créant un codon faux-sens ou de terminaison). D’autres éléments viennent compliquer cette analyse. Si le séquençage concerne un échantillon tumoral et notamment une biopsie, l’hétérogénéité du prélèvement devient significative, qu’il s’agisse du mélange entre tissus tumoral et normal ou de l’hétérogénéité génétique de la tumeur elle-même. Cela signifie que le séquençage devra être capable de révéler des anomalies présentes dans 10 ou 20 % des cellules seulement, ce qui va forcément obliger à augmenter la redondance pour gagner en sensibilité. Finalement, et selon l’application, il faudra quantifier la précision requise, disposer d’outils pour la mesurer, et ajuster au mieux l’équilibre entre séquençage massif (et bon marché) et vérification précise (mais coûteuse) par la méthode de Sanger. Le tout devant forcément répondre à des critères de qualité clinique qui devront bien être établis par les organismes de régulation. Cela imposera sans doute de disposer d’un jeu de « génomes de référence », lus et relus afin d’arriver à un résultat « zéro défaut » et pouvant être utilisés pour étalonner les méthodes d’un laboratoire donné. La qualité, enfin, c’est aussi celle des bases de données employées pour définir le caractère pathogène ou inoffensif de telle ou telle mutation2. Or - et j’en ai déjà parlé dans une chronique récente [
3] - ces bases de données sont truffées d’erreurs, jusqu’à 25 % selon certaines estimations [
4] : de nombreuses variations répertoriées comme causales n’ont en fait aucune incidence, et c’est une autre mutation (découverte plus tard) qui est en fait responsable de la maladie. Or il n’existe actuellement aucune base de données publique de variations validées cliniquement, même si au moins deux projets (MutaDataBase par la fondation du même nom, et ClinVar par le NCBI, National center for biotechnology information) sont en cours. Il s’agit, on l’imagine bien, d’une entreprise de longue haleine et qui devrait bénéficier de moyens importants pour être constamment tenue à jour. |
L’interprétation, c’est selon… Le coût du séquençage proprement dit diminue sans cesse, mais il ne suffit pas d’obtenir la séquence, il faut aussi l’exploiter pour en tirer les informations recherchées - et là encore, en atteignant la qualité clinique. L’exemple que j’avais analysé dans une chronique il y a quelque temps [
5] était éloquent puisque l’interprétation de la séquence d’une personne avait mobilisé plusieurs informaticiens durant plusieurs mois - mais il faut reconnaître qu’il s’agissait d’une expérimentation et d’une sorte d’exercice de style. Quelques firmes proposent déjà d’effectuer l’interprétation biologique d’une séquence en termes médicaux [
6] : il s’agit de Knome, d’Omicia, et bientôt d’une nouvelle entreprise, Personalis, dans laquelle sont notamment impliqués certains des scientifiques qui avaient effectué l’analyse déjà citée [5]. Les tarifs annoncés sont de l’ordre de 5 000 dollars, dépassant donc déjà le coût d’établissement de cette séquence, mais il s’agit là de services plutôt destinés à la recherche, et dont on peut d’ailleurs se demander s’ils trouveront leur public. Pour les particuliers qui ont eu la curiosité de commander leur propre séquence à Illumina, cette dernière les renvoie pour l’interprétation vers 23andMe, Navigenics ou DeCode Genetics - qui fournissent, à un coût très inférieur, des résultats assez sommaires. En pratique clinique, les choses se poseront souvent différemment, dans la mesure où il s’agira rarement d’analyser une séquence intégrale. Si le but est de repérer la présence ou l’absence d’un millier de mutations prédéfinies dans une centaine de gènes, une suite bioinformatique bien conçue pourra venir à bout de cette tâche dans de bonnes conditions, si bien sûr la qualité des données de départ est correcte et définie sans ambiguïté. Lorsque l’analyse concerne un échantillon tumoral, les choses se compliquent un peu du fait de l’hétérogénéité, déjà indiquée ; mais là aussi, la pratique clinique ne consistera sans doute pas à comparer l’ensemble de l’ADN tumoral à une séquence de référence, mais plutôt à faire l’inventaire des mutations présentes dans une ou deux centaines de gènes dont l’implication potentielle est connue. Quoi qu’il en soit, il est évidemment hors de question de faire travailler une équipe de bioinformaticiens chaque fois qu’une séquence est déterminée dans un but clinique : il faudra nécessairement que soient mis au point des logiciels standard fournissant au clinicien une information non ambiguë et facilement utilisable. Et naturellement, s’agissant de données qui vont justifier une décision médicale, ces logiciels devront être dûment agréés par les autorités règlementaires. Il reste donc du pain sur la planche. |
Éthique : le casse-tête des résultats inattendus On imagine bien que l’obtention de données aussi riches et touchant à l’intimité génétique de chacun va soulever de sérieuses questions éthiques et sociétales. L’accord du patient pour le séquençage de son génome devra faire l’objet d’un consentement éclairé, pour lequel l’intéressé devra être informé de toutes les ramifications possibles d’une telle opération, et notamment de la possibilité d’obtention de résultats inattendus (incidental findings), résultant du séquençage mais ne faisant pas partie des informations recherchées a priori. La question se pose déjà pour la pratique de plus en plus courante de l’analyse cytogénétique par array CGH, dans laquelle une puce ad hoc permet de révéler la plupart des insertions, duplications ou délétions dans l’ADN. Bien plus résolutif que le caryotype traditionnel, ce procédé tend actuellement à le supplanter, mais il aboutit souvent à détecter des altérations dont le corrélat clinique est inconnu, ou est sans rapport avec l’indication (par exemple un retard mental inexpliqué) pour laquelle l’analyse est pratiquée. Que faire alors ? Faut-il informer le médecin, le malade ? Faut-il revoir périodiquement les résultats afin de définir si de nouvelles corrélations ont été mises en évidence ? La plupart des centres qui pratiquent de telles analyses ont adopté une attitude assez restrictive, et ne communiquent ces résultats inattendus que lorsqu’ils ont une incidence directe pour le malade. Mais toutes ces questions vont se poser de manière bien plus aiguë à propos de la séquence : quelle suite donner, par exemple, à la découverte dans l’ADN du patient de mutations récessives à l’état hétérozygote ? Et faut-il réexploiter périodiquement la séquence à la lumière de nouveaux résultats scientifiques, et le cas échéant recontacter le patient [
7] ? Reste aussi, bien sûr, la question de l’intimité génétique. À l’époque où l’ensemble de la séquence d’une personne tient sur une simple clef USB, peut-on vraiment garantir que cette information restera strictement confidentielle ? |
Le coût d’un séquençage (surtout s’il est limité à l’exome) est maintenant du même ordre que celui d’un examen par scanner un peu évolué ; il va sans doute baisser encore, et on peut espérer que l’emploi d’un logiciel informatique adapté aux besoins cliniques ne pèse pas trop sur les tarifs. Le montant à envisager est donc de quelques milliers d’euros, peut-être moins dans un avenir proche : il est à rapprocher de ce que facture encore aujourd’hui Myriad Genetics pour la seule séquence des gènes BRCA, soit plus de trois mille dollars américains. Une des premières expérimentations portant sur l’intégration effective d’une telle analyse dans la pratique clinique et sur l’évaluation de son rapport qualité/prix est en cours aux Pays-Bas [
8] à l’université de Nijmegen. Pour cette étude, qui va concerner 500 personnes, le séquençage d’exomes et son interprétation sont remboursés à hauteur de 1 500 euros, ce qui ne couvre pas totalement les coûts. Le but de cette expérimentation est de mettre en place l’ensemble des procédures et de montrer que cette approche est bien plus efficace que la traditionnelle analyse gène par gène (facturée et remboursée plusieurs centaines d’euros à chaque fois), après quoi l’hôpital négociera un tarif plus élevé auprès des compagnies d’assurance. Tout ceci laisse à penser que le coût ne va pas être un obstacle insurmontable à la généralisation du séquençage (exome ou génome entier) dans un cadre clinique. |
Les problèmes ne manquent pas, mais l’évolution semble irréversible Au terme de ces deux chroniques [1], il semble bien que l’entrée du séquençage dans la pratique clinique (pour la recherche clinique, c’est déjà fait) ne soit qu’une question de temps. Aucun des problèmes techniques, qu’il s’agisse du coût, des délais ou même de la mise au point de logiciels d’interprétation clinician-friendly ne semble insurmontable. Et en revanche, la richesse des informations ainsi obtenue est incomparable, et va à court terme emporter l’adhésion de l’ensemble des acteurs. Reste que cette nouvelle approche va imposer de sérieuses modifications dans l’organisation pratique hospitalière et un examen attentif des conditions éthiques dans lesquelles ces analyses seront pratiquées : consentement réellement éclairé, validation réglementaire des différentes procédures expérimentales et informatiques, établissement d’une politique claire concernant les résultats inattendus, et mise en place de garde-fous pour préserver l’intimité génétique des patients. Un chantier de grande ampleur, mais qui devrait permettre de grands progrès dans l’efficacité du dépistage, du diagnostic et des soins. |
L’auteur déclare n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Jordan
B
. Séquençage de nouvelle génération : déjà en clinique ?
Med Sci (Paris).
2011; ; 27 : :1127.–1130. 2.
Ajay
SS
,
Parker
SC
,
Abaan
HO
, et al.
Accurate and comprehensive sequencing of personal genomes . Genome Res.
2011; ; 21 : :1498.–1505. 3.
Jordan
B
. Le véritable « génome personnel » ?
Med Sci (Paris).
2011; ; 27 : :553.–556. 4.
Bale
S
,
Devisscher
M
,
Criekinge
WV
, et al.
MutaDATABASE: a centralized and standardized DNA variation database . Nat Biotechnol.
2011; ; 29 : :117.–118. 5.
Jordan
B
. La séquence… et après ?
Med Sci (Paris).
2010; ; 26 : :655.–658. 6.
Stokes
T
. Businesses ready whole-genome analysis services for researchers . Nat Med.
2011; ; 10 : :1161.. 7.
Pyeritz
RE
. The coming explosion in genetic testing: is there a duty to recontact?
N Engl J Med.
2011; ; 365 : :1367.–1369. |