| |
| Med Sci (Paris). 2012 January; 28(1): 76–81. Published online 2012 January 27. doi: 10.1051/medsci/2012281020.Les hyménoptères parasitoïdes Des modèles pour l’étude de l’hypofertilité mâle Charlotte Lécureuil,1*** Nathalie Rougière,1** Tanh Manh Nguyen,1 Christophe Bressac,1 and Claude Chevrier1 1Institut de recherche sur la biologie de l’insecte (IRBI), UMR CNRS 6035, université François Rabelais, parc de Grandmont, 37200Tours, France |
Depuis une trentaine d’années, l’effet néfaste de l’environnement sur les fonctions mâles est une source de préoccupations, et celles-ci s’aggravent. De nombreuses études rapportent, chez l’homme, des anomalies du tractus génital (cryptorchidie et hypospadias), une diminution du nombre de spermatozoïdes et une augmentation des cancers testiculaires [
1]. Sharpe et Skakkeback ont proposé que ces perturbations aient une même origine, l’altération de la différenciation testiculaire au cours de la vie fœtale, constituant le syndrome de dysgénésie testiculaire [
2]. Dans la faune sauvage, des anomalies dans le développement sexuel et la reproduction ont également été observées et corrélées avec des pollutions environnementales. Un exemple bien connu est la diminution du succès reproducteur des alligators du lac Apopka, en Floride (États-Unis), conséquence de la contamination du lac par des rejets issus d’une usine de pesticides [
3]. Chez les poissons, une étude réalisée en Ontario (Canada) montre une augmentation du nombre d’individus intersexués et une diminution de la production de stéroïdes par les mâles dans les sites en aval de décharges d’eaux usées [
4]. La dégradation simultanée des capacités de reproduction de diverses espèces dans des zones géographiques différentes conduites à suspecter la responsabilité des modifications de l’environnement (pollutions, changements climatiques, etc.). Des polluants chimiques de plus en plus variés et concentrés sont présents dans l’environnement et certains agissent comme des perturbateurs endocriniens, c’est-à-dire des substances exogènes qui entraînent des effets délétères sur un organisme vivant ou sur sa descendance, résultant de changements dans la fonction endocrine [
5]. La structure chimique et le mécanisme des perturbateurs endocriniens sont très variés : ils peuvent potentiellement interférer avec la production, la sécrétion, le transport, le métabolisme, la liaison, l’action ou l’élimination des hormones naturelles. Ainsi, leur identification est complexe et nécessite le recours à l’expérimentation animale pour caractériser leurs effets physiologiques délétères. Parmi ces substances, on trouve des produits pharmaceutiques, agricoles, à usage industriel ou domestique, et des mycotoxines [5]. D’autres facteurs peuvent également induire des troubles de la reproduction pouvant entraîner une hypofertilité mâle. Ce sont des facteurs physiques (température, champs magnétiques, lumière ou rayonnements ionisants) et physiologiques (nutrition). Jusqu’à présent, les études portant sur l’infertilité mâle se sont majoritairement intéressées aux vertébrés. Pourtant, 95 % des espèces animales ne font pas partie de ce groupe. Yang et al. ont montré que les mâles de crustacés issus d’un site industrialisé avaient un stock de gamètes mâles moins important que ceux issus de sites non industrialisés [
6]. Des lombrics traités avec un herbicide ont moins de spermatozoïdes que les témoins [
7]. De plus, des anomalies morphologiques peuvent être induites, par exemple chez des lombrics vivant dans des sols riches en plomb, une grande proportion de gamètes mâles ont des formes anormales [
8]. La reproduction des mâles peut aussi être affectée par des modifications de l’environnement qui agissent directement sur les spermatozoïdes, notamment chez les espèces à fécondation externe. Chez l’oursin, par exemple, une exposition aux UV-B, au cadmium ou au phénol induit une diminution de la motilité des spermatozoïdes et de la fertilité [
9,
10]. Pourtant, les modes d’action des facteurs environnementaux (action directe sur les gamètes ou perturbation des systèmes hormonaux) demeurent inconnus ainsi que l’existence d’une sensibilité plus ou moins importante de certaines périodes de développement à ces facteurs environnementaux. Il semble intéressant d’analyser l’infertilité dans un contexte évolutif, puisque de nombreux gènes sont conservés entre différents groupes taxonomiques. Cette démarche est nécessaire pour identifier les mécanismes sous-jacents de l’infertilité [
11]. |
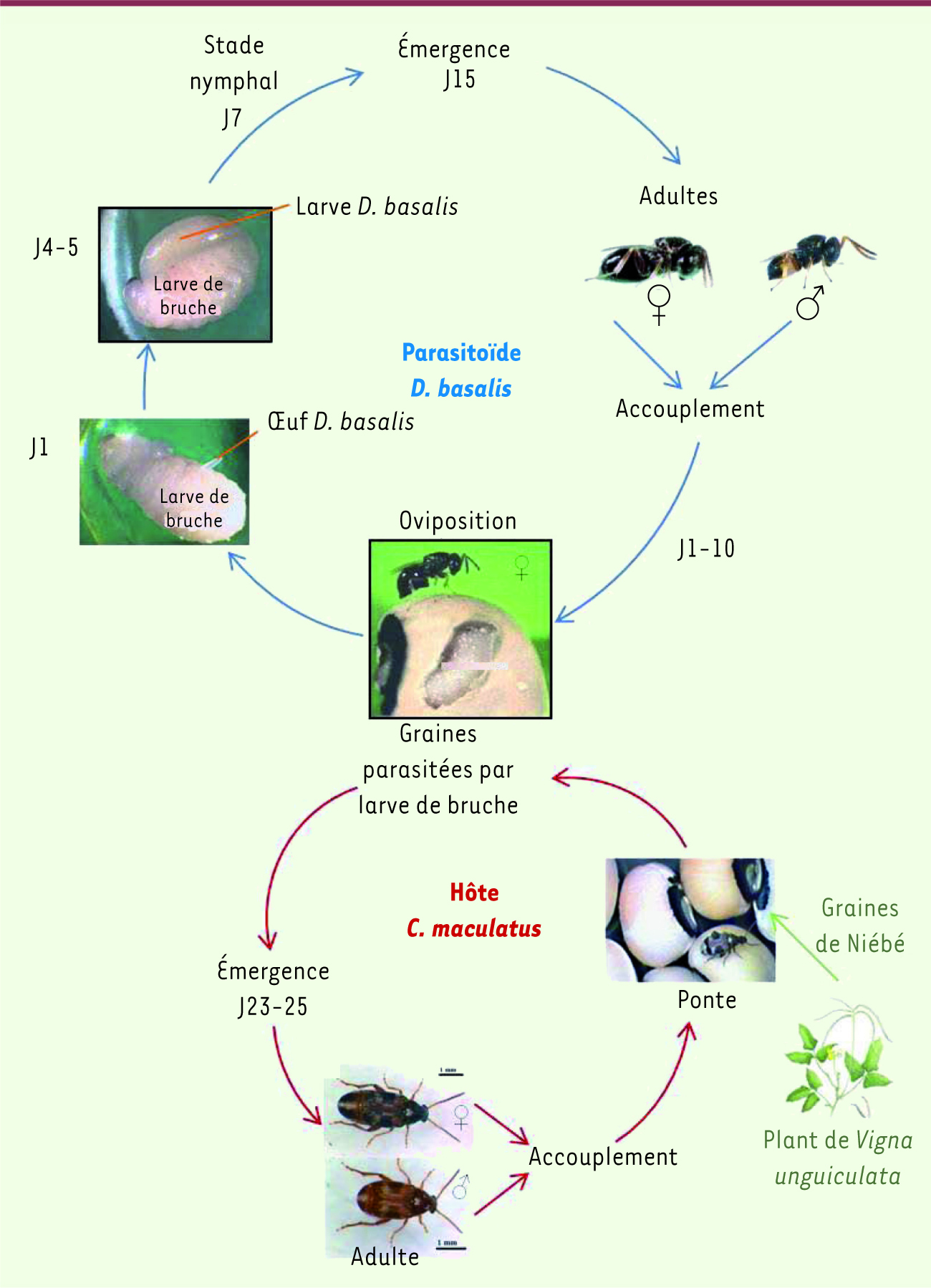
Rôle des hyménoptères parasitoïdes en agroécologie La classe des insectes est le groupe le plus important du règne animal par le nombre d’espèces. Parmi eux, les hyménoptères constituent, après les coléoptères, l’ordre d’insectes le plus diversifié. Cet ordre des hyménoptères comprend notamment les abeilles, les fourmis, les guêpes et les parasitoïdes. Les parasitoïdes se développent sur (ectoparasitoïdes) ou dans (endoparasitoïdes) un autre organisme, en se nourrissant de leur insecte hôte. Ils peuvent parasiter l’hôte à différents stades de son développement : œuf, larve, nymphe et adulte. Ainsi, les hyménoptères parasitoïdes jouent un rôle crucial dans le contrôle des populations d’autres insectes, notamment les ravageurs de cultures ou ceux qui détruisent les stocks de graines. Certaines de ces espèces sont commercialisées et utilisées dans le cadre de la lutte biologique qui vise à réduire les populations de certains ravageurs. Les hyménoptères parasitoïdes sont les plus utilisés dans ce cadre grâce à leur grande spécificité et leur capacité à localiser leurs hôtes. Par exemple, environ 96 % des coléoptères qui affectent des stocks de blé sont supprimés par l’utilisation d’Anisopteromalus calandrae [
12]. D’autre part, environ 15 millions d’hectares de cultures et de forêts dans le monde sont traités annuellement dans le cadre de la lutte biologique avec des trichogrammes1 [
13]. En plus de leur intérêt agronomique, les parasitoïdes sont aussi étudiés dans le cadre de recherches fondamentales en génétique, écologie et comportement. Par exemple, dans notre laboratoire, nous utilisons trois espèces d’hyménoptères parasitoïdes de la famille des Pteromalidae : Dinarmus basalis, Anisopteromalus calandrae et Nasonia vitripennis. Les deux premières vivent dans des régions chaudes et la dernière en pays tempérés. Chez D. basalis et A. calandrae, les femelles localisent les larves hôtes dans les graines contaminées par les hôtes ravageurs. Elles insèrent l’ovipositeur dans la graine, paralysent l’hôte et déposent un œuf sur celui-ci (Figure 1). L’éclosion a lieu en moyenne 30 h après, puis différents stades larvaires se succèdent, durant lesquels la larve croît rapidement en se nourrissant de son hôte [
14]. La mue nymphale a lieu 6 à 8 j après la ponte. La nymphose se poursuit durant 5 à 7 j pour les mâles et pendant 6 à 9 j pour les femelles. Ainsi ces espèces sont protandres, car les mâles émergent des graines 1 j avant les femelles [
15].
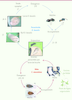 | Figure 1.
Cycle de développement chez les hyménoptères parasitoïdes. Exemple du parasitoïde Dinarmus basalis (cycle en bleu) et de son hôte Callosobruchus maculatus (cycle en rouge) ravageur des graines du haricot niébé (V. unguiculata). |
N. vitripennis est un parasitoïde de pupes de mouches. La femelle de Nasonia transperce avec son ovipositeur l’enveloppe de la pupe, qui contient la nymphe de mouche, et pond entre 20 et 50 œufs à sa surface. Après éclosion des œufs, les larves de nasonia se nourrissent de l’hôte. Plusieurs stades larvaires et la nymphose ont lieu avant que les adultes émergent. Ce cycle prend environ 14 j à 25 °C. |
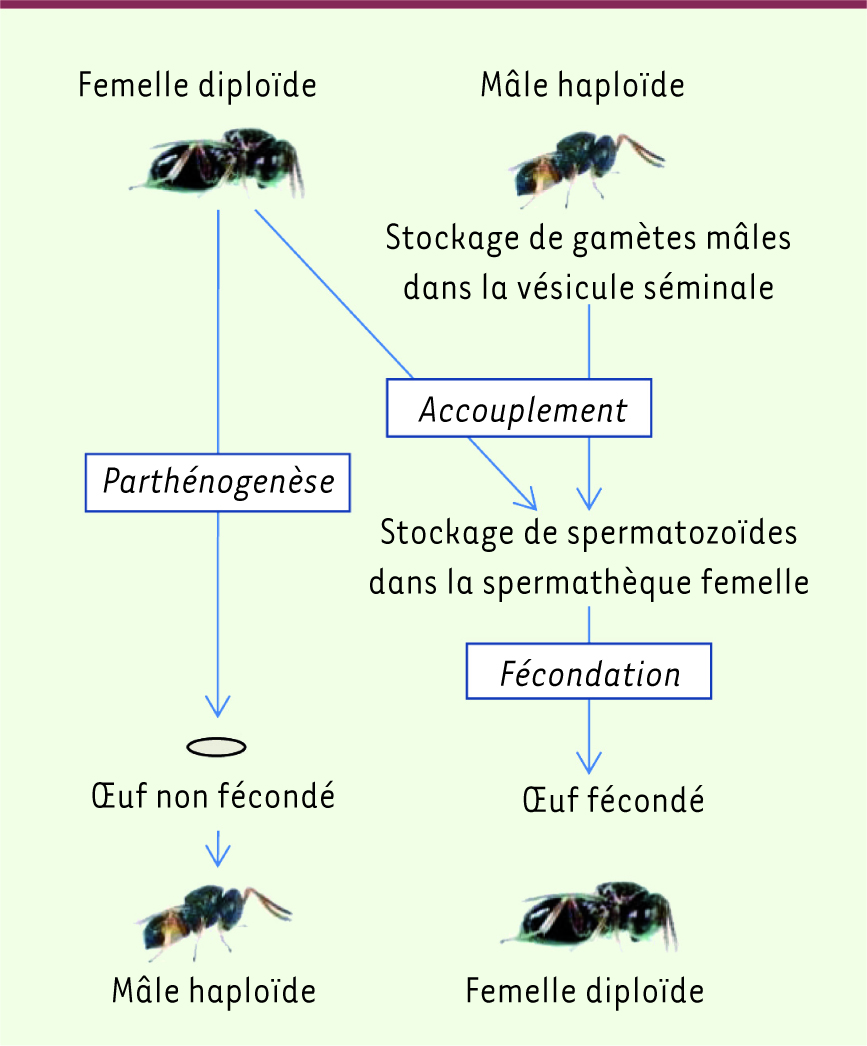
Biologie de la reproduction chez les hyménoptères parasitoïdes Le mode de reproduction des hyménoptères est la parthénogenèse arrhénotoque : un mâle est issu d’un œuf non fécondé et une femelle d’un œuf fécondé (Figure 2). Les mâles possèdent deux testicules formés de tubules qui contiennent les cellules germinales enfermées dans des cystes. Toutes les cellules germinales d’un cyste évoluent de façon synchrone et dérivent d’une même spermatogonie. Dans la zone de maturation du follicule, les spermatocytes subissent la méiose. La 1re division de méiose est raccourcie et la 2e normale [
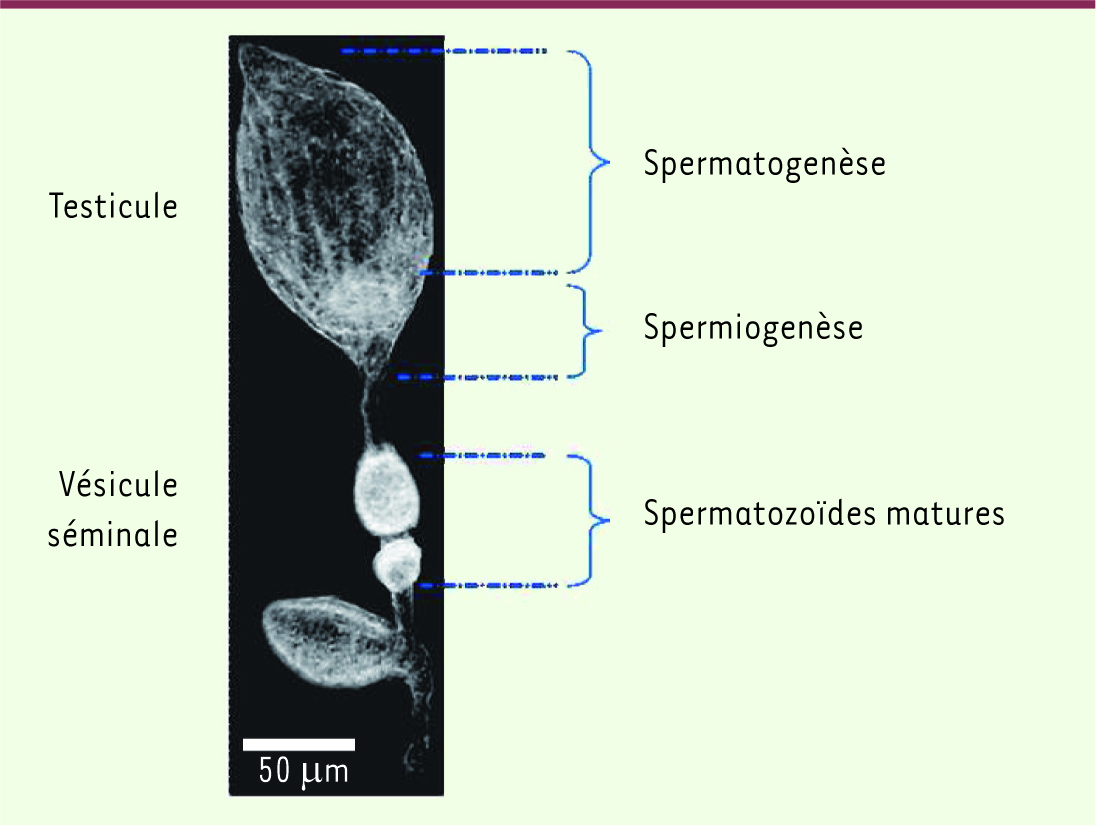
16]. Ainsi, le contenu génétique de tous les spermatozoïdes est identique. Ces spermatozoïdes sont ensuite stockés chez le mâle dans un organe appelé vésicule séminale (Figure 3).
 | Figure 2.
Principe de l’haplodiploïdie chez les hyménoptères parasitoïdes pratiquant la parthénogenèse arrhénotoque. Les mâles sont haploïdes et sont issus d’un œuf non fécondé, tandis que les femelles sont diploïdes et sont issues d’un œuf fécondé. |
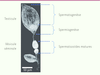 | Figure 3.
Demi-tractus mâle de D. basalis. La figure indique les différentes zones contenant des spermatozoïdes en cours d’élaboration (spermatogenèse et spermiogenèse) ou matures. |
Au stade nymphal, chez D. basalis, les testicules sont présents mais les vésicules séminales ne contiennent pas encore de spermatozoïdes matures ; la 1re vague de spermatogenèse ne serait pas achevée. Chez le jeune adulte, environ 350 spermatozoïdes/j sont produits [
17]. Le nombre de gamètes dans les vésicules séminales augmente avec l’âge [17,
18]. Après l’émergence, on en dénombre, stockés dans les vésicules séminales, environ 3 100 chez D. basalis [18], 4 000 chez A. calandrae [
19], et plus de 20 000 chez N. vitripennis [
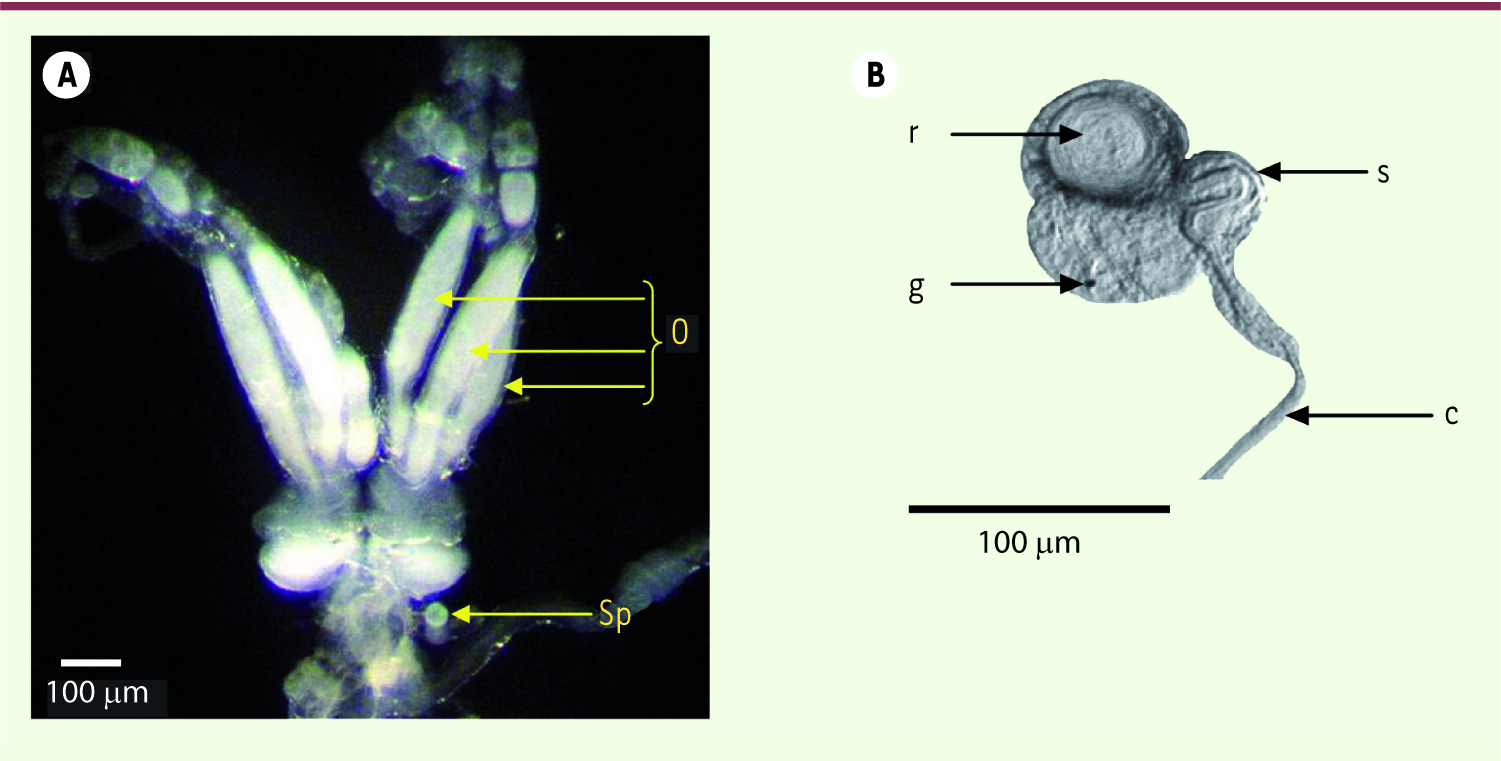
20]. Leur viabilité dans les vésicules séminales n’est pas affectée par l’âge, elle est d’environ 56 % chez D. basalis à 1 j et 30 j [18]. Après une cour de 15 s, la copulation a lieu en moyenne en 24 s chez D. basalis [15]. Les spermatozoïdes sont déposés dans la cavité utérine des femelles, aucun spermatophore2, n’est observé. Vingt-quatre heures après un accouplement simple, environ 150 spermatozoïdes se retrouvent dans la spermathèque (Figure 4). Ce stock permettra à la femelle de pondre tout au long de sa vie sans se réaccoupler [14], donnant environ 92 descendants filles durant la vie reproductive, soit une efficience de 0,6.
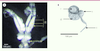 | Figure 4.
Appareil reproducteur des femelles. A. Appareil reproducteur des femelles Dinarmus basalis. o : ovarioles, sp : spermathèque. B. Spermathèque de la femelle D. basalis. r : réservoir de la spermathèque, g : glande spermathécale, c : conduit de la spermathèque, s : forme en S du conduit de la spermathèque (acquisition vidéo sous microscope). |
Les particularités de ce système de reproduction, par rapport à ceux des mammifères, sont le petit nombre de spermatozoïdes transférés par les mâles puis stockés par les femelles et la forte efficience des spermatozoïdes. De plus, le sex-ratio des descendants produits dépend du stock de spermatozoïdes dans la spermathèque. |
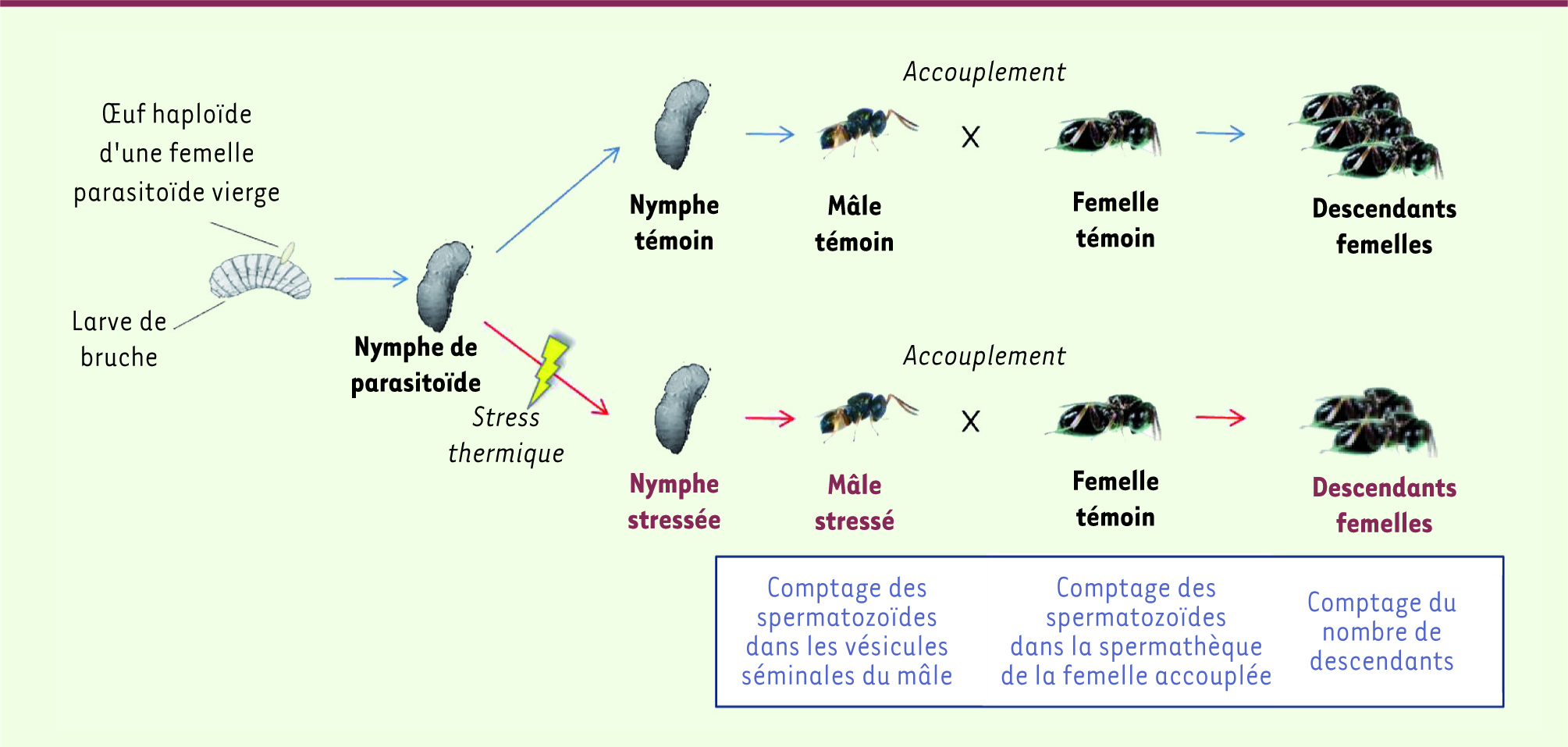
L’hypofertilité mâle induite chez les hyménoptères parasitoïdes Notre équipe a étudié la fertilité mâle chez les hyménoptères parasitoïdes. Nous avons pu constater que plusieurs stimulus, stress alimentaire, herbicide et chocs thermiques, lorsqu’ils sont appliqués sur la larve ou la nymphe, induisaient une diminution du nombre de spermatozoïdes chez les mâles adultes. Nous avons ainsi mis en évidence que les mâles de D. basalis se développant sur un hôte de faible poids (1 à 2,7 mg) avaient un stock de spermatozoïdes 2,3 fois moins important que les mâles nourris avec un hôte plus gros (8 à 10 mg) [
21]. Chez cette même espèce, un choc thermique (température de −18 °C pendant 1 h) (Figure 5) appliqué au premier stade nymphal provoque une réduction du nombre de spermatozoïdes de 80 % [17]. De la même manière, A. calandrae est sensible à la température puisque des mâles issus de nymphes maintenues à 38 °C pendant 3 j ont moins de gamètes que les mâles témoins issus de nymphes élevées à 30 °C. Enfin, notre équipe a étudié les effets du Paraquat, un herbicide mondialement utilisé avant son interdiction en Europe en 2007, sur les performances de reproductions mâles. Dans ces expériences, les larves d’A. calandrae se nourrissaient de larves d’hôtes dans lesquelles des quantités croissantes de Paraquat (0,1 à 0,5 g/L) avaient été injectées. Le nombre de gamètes des mâles issus de ces larves était réduit par rapport à celui des mâles témoins [
22].
 | Figure 5.
Exemple de protocole utilisé pour l’étude du potentiel reproducteur mâle.
|
Bien que ces stimulus, appliqués sur les larves ou nymphes de parasitoïdes, induisent une baisse de la production de gamètes chez le mâle adulte, cette diminution a-t-elle une conséquence sur la capacité de reproduction des mâles traités ? En effet, après un accouplement simple avec une femelle, on retrouve autant de spermatozoïdes dans les spermathèques et le même nombre de descendants filles, que les mâles aient été traités ou non [21, 22]. En revanche, lors des compétitions, les mâles traités ont moins accès aux femelles que les mâles témoins. Par exemple, les mâles soumis à un choc thermique (froid) ne gagnent la compétition pour la femelle que dans 35 % des cas [17]. Dans des conditions d’accouplements multiples (1 mâle avec 20 femelles), les mâles issus de larves exposées aux stimulus inséminent moins de femelles que les mâles témoins et par conséquent moins de spermatozoïdes sont dénombrés dans les spermathèques des femelles [17]. Il est donc possible d’induire expérimentalement une hypofertilité mâle en exposant à des stress les hyménoptères parasitoïdes lors de leur développement. De plus, le succès du mâle dans sa fonction de reproducteur dépend principalement de son stock de spermatozoïdes, ce dernier dépendant des conditions de vie (âge, ressources alimentaires, perturbations environnementales). |
Les hyménoptères parasitoïdes : un bon organisme modèle pour étudier l’hypofertilité Nos travaux chez les hyménoptères parasitoïdes sont en accord avec d’autres travaux chez les mammifères qui montrent que des pollutions de l’environnement perturbent la mise en place du tractus génital pendant la vie embryonnaire avec des conséquences sur la fertilité de l’adulte. Ainsi, l’étude des fonctions mâles chez ces espèces peut susciter de nouvelles pistes de recherche dans le domaine de la dysgénésie testiculaire chez les mammifères. Nous disposons aujourd’hui d’un modèle d’hyménoptère parasitoïde permettant cette étude. Le faible nombre de spermatozoïdes produits et stockés permet une étude aisée de la descendance et des capacités de reproduction des mâles de cette espèce, qu’ils soient en compétition ou non pour les femelles. Nous pouvons dénombrer les spermatozoïdes et en mesurer également la viabilité lorsqu’ils sont stockés aussi bien dans les vésicules séminales que dans la spermathèque de la femelle après l’accouplement. Chaque spermatozoïde, ou presque, transmis et conservé par la femelle contribuera à la formation d’un descendant [14], ce qui souligne chez ces espèces l’efficience spermatique. Grâce à des mutants facilement identifiables et des expériences d’accouplements successifs avec plusieurs mâles (mutants et sauvages), il est aisé de comparer les succès reproducteurs de chaque mâle en analysant les phénotypes des descendants. De plus, l’haploïdie des mâles est un avantage dans le criblage de mutations permettant de révéler les allèles récessifs. Outre les avantages de ce modèle pour l’étude de la fonction mâle, décrits ci-dessus, les hyménoptères parasitoïdes s’élèvent en laboratoire, et on peut même arrêter leur développement quelques jours par réfrigération. Leur cycle est court (environ 14 j), ce qui facilite l’étude des individus et de leur descendance. A. calandrae est disponible commercialement en tant qu’auxiliaire pour la protection des stocks de graines et, comme pour N. vitripennis, il existe une grande variété de mutants ayant des yeux de couleurs différentes. Enfin, le séquençage très récent du génome de N. vitripennis [
23] ainsi que le développement de techniques de manipulations génétiques, notamment d’ARN interférence, font de cette espèce un bon organisme modèle pour étudier l’hypofertilité. N. vitripennis est bien connu en laboratoire, car cet insecte est utilisé depuis plus de 60 ans comme sujet d’étude en écologie, comportement, environnement et développement. Il a été découvert récemment que N. vitripennis disposait du matériel enzymatique pour réaliser la méthylation de l’ADN (gènes dnmt-1 à -3, DNA methyltransferase) [23]. Ceci peut être important, car chez les rongeurs, des travaux expérimentaux ont montré que les effets des perturbateurs endocriniens pouvaient se transmettre aux générations suivantes via des mécanismes épigénétiques [
24]. |
Les mécanismes de la reproduction chez les hyménoptères parasitoïdes peuvent être étudiés grâce : (1) aux méthodes d’analyse des fonctions testiculaires, (2) aux avantages du modèle (parthénogenèse arrhénotoque, temps de génération court, efficience des spermatozoïdes), (3) aux outils génétiques développés. Les mécanismes de régulation pourront alors être comparés avec ceux existant chez d’autres espèces. De plus, l’étude du génome de nasonia a révélé que 60 % de ses gènes avaient un orthologue humain, 18 % étaient spécifiques des arthropodes et 2,4 % spécifiques des hyménoptères [23]. Ainsi les connaissances acquises chez ces espèces pourront peut-être être extrapolées chez d’autres organismes. Le contrôle endocrinien de la reproduction chez les insectes est réputé être différent de celui des mammifères. Certaines hormones sont spécifiques des arthropodes, parmi elles les ecdystéroïdes, produits par les glandes prothoraciques et les gonades, et les hormones juvéniles produites par les corpora allata. Elles agissent au niveau génomique via des récepteurs nucléaires proches de ceux des vertébrés. Les récepteurs aux œstrogènes et aux androgènes ne sont pas présents chez les insectes. N. vitripennis a le plus petit nombre de gènes précurseurs de neuropeptides en comparaison avec d’autres insectes (y compris l’abeille) puisqu’une étude récente a identifié 51 neuropeptides et hormones protéiques [
25]. D’autre part, il est primordial de ne pas prendre seulement en compte les mammifères pour l’identification des substances agissant en tant que perturbateurs endocriniens. Pour endiguer le déclin de la biodiversité, le criblage des molécules altérant la fertilité doit également tenir compte des modes d’action des hormones des invertébrés. Ces modes d’action peuvent être plus facilement compris en utilisant les hyménoptères parasitoïdes comme modèle. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Delbès
G
,
Levacher
C
,
Duquenne
C
, et al.
Le testicule fœtal est-il en danger ?
Med Sci (Paris).
2005; ; 21 : :1083.–1088. 2.
Sharpe
RM
,
Skakkebaek
NE
. Are oestrogens involved in falling sperm counts and disorders of the male reproductive tract ?
Lancet.
1993; ; 341 : :1392.–1396. 3.
Guillette
LJ
,
Gross
TS
,
Masson
GR
, et al.
Developmental abnormalities of the gonad and abnormal sex hormone concentrations in juvenile alligators from contaminated and control lakes in Florida . Environ Health Perspect.
1994; ; 102 : :680.–688. 4.
Tetreault
GR
,
Bennett
CJ
,
Shires
K
, et al.
Intersex and reproductive impairement of wild fish exposed to multiple municipal wastewater discharges . Aquat Toxicol.
2011; ; 104 : :278.–290. 5.
Cravedi
JP
,
Zalko
D
,
Savouret
JF
, et al.
Le concept de perturbation endocrinienne et la santé humaine . Med Sci (Paris).
2007; ; 23 : :198.–204. 6.
Yang
G
,
Kille
P
,
Ford
AT
. Infertility in a marine crustacean : Have we been ignoring pollution impacts on male invertebrates?
Aquat Toxicol.
2008; ; 88 : :81.–87. 7.
Xiao
NW
,
Song
Y
,
Ge
F
, et al.
Biomarkers responses of the earthworm Eisenia fetida to acetochlor exposure in OECD soil . Chemos.
2006; ; 65 : :907.–912. 8.
Zheng
R
,
Li
C
. Effect of lead on survival, locomotion and sperm morphology of Asian earthworm, Pheretima guillelmi . J Environ Sci.
2009; ; 21 : :691.–695. 9.
Au
DWT
,
Chiang
MWL
,
Tang
JYM
, et al.
Impairment of sea urchin sperm quality by UV-B radiation : predicting fertilization success from sperm motility . Mar Pollut Bull.
2002; ; 44 : :583.–589. 10.
Au
DW
,
Chiang
MW
,
Wu
RS
. Effects of cadmium and phenol on motility and ultrastructure of sea urchin and mussel spermatozoa . Arch Environ Contam Toxicol.
2000; ; 38 : :455.–463. 11.
Joly
D
, Évolution, spermatozoides et fertilité. Introduction . J Soc Biol.
2008; ; 202 : :101.–102. 12.
Phillips
T
,
Baker
J
,
Maegdan
B
. Biological control of stored-product pests . In : IPM of Alaska, 2003. Alaska’s integrated pest management . http://www.uaf.edu/ces/ipm
13.
Van Lenteren
JC
. Success in biological control of arthropods by augmentation of natural enemies . In :
Gurr
GM
,
Wratten
SD
, eds.
Biological control : measures of success . Dordrecht: : Kluwer Academic Publishers; , 2000 : :77.–103. 14.
Damiens
D
,
Bressac
C
,
Chevrier
C
. The effect of age on sperm stock and egg laying in the parasitoid wasp, Dinarmus basalis . J Insect Sci.
2003; ; 3 : :22.–27. 15.
Chevrier
C
,
Bressac
C
. Sperm storage and use after multiple mating in Dinarmus basalis (Hymenoptera : Pteromalidae) . J Insect Behav.
2002; ; 15 : :385.–398. 16.
Pennypacker
MI
. The chromosomes of the parasitic wasp, Mormoniella vitripennis. I. In spermatogenesis of haploid and diploid males . Arch Biol.
1958; ; 69 : :483.–495. 17.
Lacoume
S
,
Bressac
C
,
Chevrier
C
. Sperm production and mating potential of males after a cold shock on pupae of the parasitoid wasp Dinarmus basalis (Hymenoptera : Pteromalidae) . J Insect Physiol.
2007; ; 53 : :1008.–1015. 18.
Bressac
C
,
Damiens
D
,
Chevrier
C
. Sperm stock and mating of males in a parasitoid wasp . J Exp Zool B Mov Dev Evol.
2008; ; 310B : :160.–166. 19.
Bressac
C
,
Thi Khanh
HD
,
Chevrier
C
. Effects of age and repeated mating on male sperm supply and paternity in a parasitoid wasp . Entomol Exp Appl.
2009; ; 130 : :207.–213. 20.
Clark
ME
,
O’Hara
FP
,
Chawla
A
, et al.
Behavioral and spermatogenic hybrid male breakdown in Nasonia . Heredity.
2010; ; 104 : :289.–301. 21.
Lacoume
S
,
Bressac
C
,
Chevrier
C
. Effect of host size on male fitness in the parasitoid wasp Dinarmus basalis . J Insect Physiol.
2006; ; 52 : :249.–254. 22.
Lacoume
S
,
Bressac
C
,
Chevrier
C
. Male hypofertility induced by Paraquat consumption in the non-target parasitoid Anisopteromalus calandrae (Hymenoptera : Pteromalidae) . Biol Control.
2009; ; 49 : :214.–218. 23.
Werren
JH
,
Richards
S
,
Desjardins
CA
, et al.
Functional and evolutionary insights from the genomes of three parasitoid Nasonia species . Science.
2010; ; 327 : :343.–348. 24.
Anway
MD
,
Cupp
AS
,
Uzumcu
M
, et al.
Epigenetic transgenerational actions of endocrine disruptors and male fertility . Science.
2005; ; 308 : :1466.–1469. 25.
Hauser
F
,
Neupert
S
,
Williamson
M
, et al.
Genomics and peptidomics of neuropeptides and protein hormones present in the parasitic wasp Nasonia vitripennis . J Proteome Res.
2010; ; 9 : :5296.–5310. |