| |
| Med Sci (Paris). 2012 January; 28(1): 41–44. Published online 2012 January 27. doi: 10.1051/medsci/2012281015.Connexines Un nouveau mécanisme de protection des cellules sécrétrices d’insuline contre l’apoptose Philippe Klee1 and Paolo Meda1* 1Département de physiologie cellulaire et métabolisme, université de Genève, 1, rue Michel-Servet, 1211Genève, Suisse MeSH keywords: Allèles, Animaux, Apoptose, effets des médicaments et des substances chimiques, physiologie, Communication cellulaire, Lignée cellulaire, Connexines, Cytokines, Diabète expérimental, prévention et contrôle, Diabète de type 2, traitement médicamenteux, métabolisme, Humains, Insuline, biosynthèse, génétique, Cellules à insuline, anatomopathologie, Souris, Souris knockout, Souris transgéniques, Régions promotrices (génétique), Rats, Transduction du signal, Lymphocytes auxiliaires Th1, immunologie, sécrétion |
Apoptose des cellules bêta pancréatiques sécrétrices d’insuline dans le diabète Les cellules bêta qui produisent l’insuline au sein des îlots pancréatiques jouent un rôle central dans la plupart des formes de diabète, qu’il soit de type 1 (forme la plus fréquente chez le jeune), de type 2 (forme la plus fréquente de l’adulte) ou MODY (rares formes dites maturity onset diabetes of the young) [
1]. Dans tous ces cas, les cellules bêta pancréatiques ne reconnaissent plus le glucose comme un stimulus de la sécrétion d’insuline (diabète de type 2 et MODY) et/ou ne sont plus en nombre adéquat pour assurer une sécrétion suffisante d’insuline, en raison d’une apoptose importante (diabète de type 1) [1]. Malgré d’intenses efforts de recherche, les causes et les mécanismes de ces altérations fonctionnelles et de la masse cellulaire, qui varient simultanément dans la grande majorité des cas de la maladie (diabète de type 2), restent encore peu compris. Cependant, la persistance de quelques cellules bêta fonctionnelles chez des patients ayant un diabète de longue durée [
2] suggère une hétérogénéité des cellules bêta [
3], certaines d’entre elles étant capables de résister aux attaques auto-immunes (diabète de type 1) et aux défauts génétiques et métaboliques (diabète de type 2 et MODY) qui altèrent la plupart des autres cellules bêta au début de la maladie diabétique. Pour expliquer une telle résistance, nous avons émis l’hypothèse que les connexines [
4,
5] - des protéines intégrales de la membrane cellulaire - qui forment les canaux des jonctions communicantes de type gap, pouvaient être impliquées. En effet, ces protéines forment des canaux intercellulaires qui peuvent compenser des différences métaboliques et fonctionnelles entre cellules hétérogènes, en les « couplant » tant du point de vue électrique (par des échanges intercellulaires d’ions) et métabolique (par des échanges intercellulaires de métabolites et second messagers) [3–5]. |
La connexine 36 (Cx36) protège les cellules pancréatiques de l’apoptose Nous avons précédemment montré que les cellules produisant l’insuline sont couplées par un seul type de connexine, appelée Cx36, et que cette protéine participe de façon importante au contrôle de la fonction des cellules bêta. En effet, la perte de cette protéine entraîne une augmentation de la sécrétion basale d’insuline, la perte de la réponse normale au glucose et des oscillations de calcium et d’insuline normalement induites par le sucre [
6–
8]. Ces défauts, qui résultent de la perte de la synchronisation intercellulaire des oscillations calciques et de la diffusion intercellulaire de courants stimulateurs et inhibiteurs [3–8], rappellent les altérations caractéristiques du prédiabète (perte des oscillations insuliniques) et du diabète de type 2 (augmentation de la sécrétion basale d’insuline, perte de la réponse au glucose) [1]. Par ailleurs, la Cx36 participe au contrôle de la masse des cellules bêta pancréatiques [
9]. En utilisant une série de souris transgéniques et de lignées cellulaires exprimant différents niveaux de Cx36, nous démontrons le rôle remarquable et jusqu’ici ignoré de cette protéine dans le contrôle de la sensibilité des cellules bêta à diverses conditions qui induisent leur apoptose. Ces résultats ont été publiés en décembre dernier dans le Journal of Clinical Investigation [
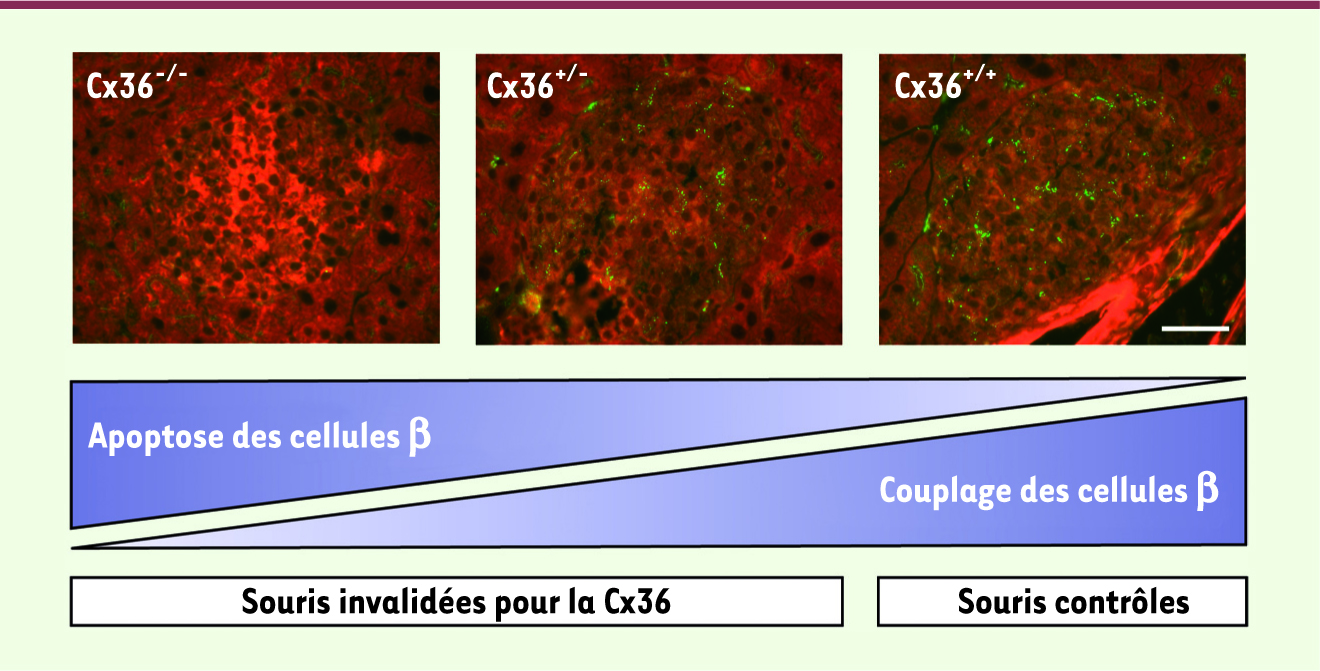
10]. Pour identifier cette fonction de Cx36, nous avons injecté à des souris deux toxines, la streptozotocine et l’alloxane, qui détruisent spécifiquement les cellules bêta, et avons mesuré la glycémie des animaux traités. Les souris contrôles, qui exprimaient un taux normal de Cx36, sont devenues diabétiques comme attendu. La glycémie des souris transgéniques dont l’un (Cx36+/-
) ou les deux allèles (Cx36−/−
) du gène gjd2, qui code pour la Cx36, avaient été invalidés (Figure 1), était, quant à elle, plus élevée que celle des souris contrôles, ce qu’explique la perte plus importante des cellules sécrétant de l’insuline. En revanche, et de façon remarquable, les souris RIP (rat insulin promoter)-Cx36+/-
et RIP-Cx36+/+
, dont les cellules pancréatiques surexprimaient la Cx36, n’ont pas développé d’hyperglycémie pendant plusieurs semaines et le taux d’insuline comme le nombre de cellules bêta sont restés normaux [10]. Ces expériences montrent que la Cx36 protège in vivo les cellules bêta de l’apoptose.
 | Figure 1.
La signalisation par la Cx36 est inversement corrélée à l’apoptose des cellules bêta. Dans la lignée transgénique de souris Cx36, cette connexine est exprimée (points verts) dans les îlots pancréatiques des souris contrôles (Cx36+/+
; droite). Dans la même fratrie, les niveaux de Cx36 sont réduits dans les îlots des souris hétérozygotes pour le transgène (Cx36
+/- ; milieu) et nuls dans ceux des souris homozygotes (Cx36−/−
). La microscopie par TUNEL et la microinjection de traceurs fluorescents ont montré que la perte de Cx36 est associée à celle du couplage des cellules bêta et à une augmentation de l’apoptose de ces cellules, en réponse à des toxines et des cytokines Th1. Barre : 40 µm. |
Cette sensibilité différentielle a pu être confirmée in vitro en exposant des îlots pancréatiques isolés de chaque type d’animal aux deux toxines mentionnées ci-dessus. Elle a été également démontrée en présence de cytokines, qui sont impliquées dans l’attaque auto-immune des cellules bêta au début du développement d’un diabète de type 1. En effet, en étudiant par la technique TUNEL (terminal deoxynucleotidyl transferase dUTP nick end labeling) l’augmentation d’apoptose induite par un mélange de tumor necrosis factor α, d’interféron γ et d’interleukine-1β, nous avons observé que la mort cellulaire programmée était plus importante dans les îlots pancréatiques isolés des souris dont le gène codant la Cx36 avait été partiellement ou complètement invalidé que dans ceux des animaux qui surexprimaient la Cx36 [10]. Ces expériences montrent que la protection induite par la Cx36 est efficace contre plusieurs types d’agressions et fait intervenir un mécanisme qui est autonome aux îlots pancréatiques. |
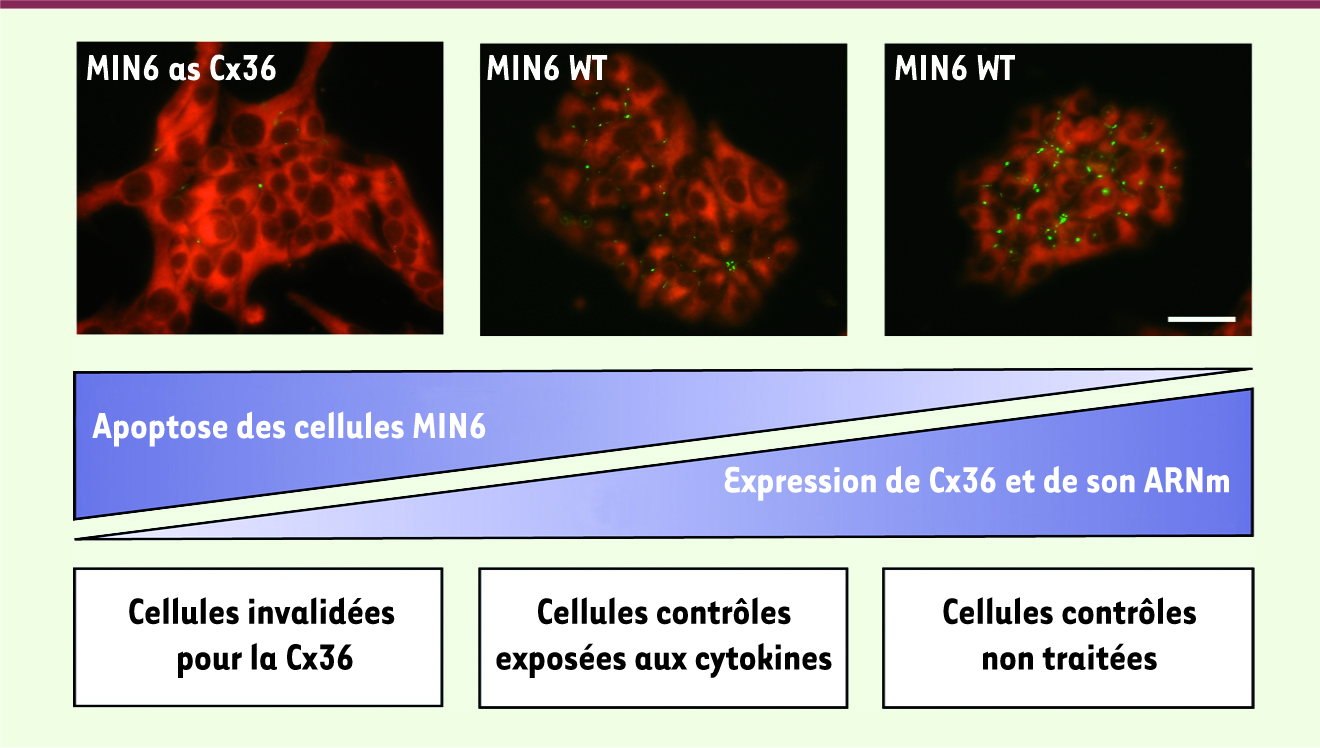
Importance du couplage intercellulaire via Cx36 dans la résistance à l’apoptose Pour comprendre ce mécanisme, nous avons d’abord étudié l’expression et le fonctionnement de GLUT-2 (glucose transporter 2), étant donné que c’est ce transporteur du glucose qui permet aussi l’incorporation de streptozotocine et d’alloxane par les cellules bêta. Nous n’avons trouvé aucune différence d’expression de GLUT-2 chez les différents animaux qu’ils soient normaux, sensibilisés à l’apoptose ou protégés de l’apoptose. Nous avons alors analysé la production de monoxyde d’azote, relâché par les cellules bêta en réponse à leur exposition aux cytokines de type Th1 (produites par les lymphocytes T helper), mais aucune différence n’a été constatée. De même le relâchement du cytochrome C mitochondrial après exposition aux cytokines, le blocage des caspases proapoptotiques par l’inhibiteur Z-VAD et l’absence d’effet de la ciclosporine A étaient identiques chez les différents animaux [10]. Ces expériences indiquent que les changements d’expression de Cx36 ne modifient pas les récepteurs des cytokines, ni l’activation des cascades de signalisation qui en découlent et qui activent l’apoptose des cellules bêta via l’activation des mêmes caspases effectrices chez tous les animaux étudiés. En revanche, nous avons révélé le rôle crucial de l’établissement de canaux jonctionnels via Cx36 : en effet, l’exposition à la streptozotocine ou au mélange de cytokines de cellules isolées à partir d’îlots pancréatiques, et qui ne peuvent donc plus être couplées par la Cx36, entraîne une apoptose accrue des cellules bêta quelle que soit l’expression de Cx36 [10]. La protection des cellules bêta induite par la Cx36 est donc dépendante du contact intercellulaire. Nous avons alors étudié l’abondance et la perméabilité des canaux formés par la Cx36, en injectant, dans des cellules bêta individuelles au sein d’îlots pancréatiques isolés, deux traceurs fluorescents dont la diffusion intercellulaire reflète la présence de canaux Cx36 fonctionnels. Nous avons pu démontrer que dans les îlots surexprimant la Cx36 et protégés de l’apoptose, le couplage était augmenté, alors que dans ceux dépourvus de Cx36 et sensibilisés à l’apoptose, il était diminué, voire aboli [10]. On peut donc suggérer qu’une augmentation du couplage intercellulaire pourrait être responsable de la protection que la Cx36 confère aux cellules bêta. Un argument en faveur de cette interprétation vient de l’observation qu’une protection analogue est conférée aussi par deux autres types de connexines [10], qui ne sont pas normalement exprimées par les îlots pancréatiques natifs [4,5]. Une explication plausible est que le volume plus important de cytoplasme formé par la somme fonctionnelle des cytoplasmes de toutes les cellules couplées, permettrait de diluer, en dessous d’un seuil critique, les activateurs des voies proapoptotiques. Cette interprétation n’exclut pas, a priori, d’autres mécanismes dépendants de la Cx36 [4]. Une série d’expériences in vitro sur plusieurs clones de deux lignées différentes de cellules productrices d’insuline dont l’expression de Cx36 a été soit augmentée soit réduite expérimentalement par rapport à la valeur des cellules natives, démontrent que la protection contre l’apoptose des cellules bêta est directement liée au taux d’expression de la Cx36 qui, entre autres, est fortement diminué par les mêmes cytokines qui activent l’apoptose des cellules bêta (Figure 2) [10].
 | Figure 2.
Les cytokines Th1 réduisent l’expression de Cx36 dans les cellules MIN6 et les sensibilisent à l’apoptose. En culture, les cellules MIN6 agrégées expriment spontanément la Cx36 (points verts ; droite). L’exposition à un mélange de cytokines diabétogéniques réduit cette expression (milieu), qui devient quasi nulle dans des cellules MIN6 transfectées avec un ADNc codant pour un antisens de la Cx36 (gauche). La réduction au niveau transcriptionnel de l’expression de Cx36 est associée à une augmentation de l’apoptose des cellules MIN6, en réponse à des cytokines Th1 (barre 30 µm). |
|
Tirer parti des communications intercellulaires pour l’innovation thérapeutique Ces observations soulignent le rôle, jusqu’ici négligé, des communications intercellulaires et des connexines dans le contrôle de la survie des cellules sécrétrices d’insuline, qui est essentiel dans la pathogenèse de la maladie diabétique. Elles ouvrent par là de nouvelles pistes pour le développement de stratégies thérapeutiques innovantes, ciblées sur les moyens d’accroître, voire rétablir, la résistance de ces cellules à des agressions chimiques et auto-immunes. C’est d’autant plus important face aux limites des outils pharmacologiques et immuns actuels et à l’explosion épidémique du diabète dans le monde entier. Compte tenu de la distribution spécifique de la Cx36, qui est restreinte aux cellules bêta pancréatiques, à la plupart des neurones et à quelques cellules d’origine neuro-ectodermique [5], ces nouvelles avancées thérapeutiques pourraient également se révéler utiles dans des maladies dégénératives du système nerveux, dont les mécanismes pathogéniques ressemblent à ceux qui déclenchent la maladie diabétique. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Le travail résumé dans cet article a pu être réalisé grâce au financement du Fonds national suisse de la recherche scientifique, de l’Union Européenne et de la Juvenile diabetes research foundation (USA).
|
1.
Holt
RIG
,
Cockram
C
,
Flyvberg
A
,
Goldstein
BJ
(eds). Textbook of diabetes (4th ed) . 4th ed . Hoboken: : Wiley-Blackwell; , 2010 : :1144. p. 2.
Meier
JJ
,
Bhushan
A
,
Butler
AE
, et al.
Sustained beta cell apoptosis in patients with long-standing type 1 diabetes: indirect evidence for islet regeneration?
Diabetologia.
2005; ; 48 : :2221.–2228. 3.
Bavamian
S
,
Klee
P
,
Britan
A
, et al.
Islet-cell-to-cell communication as basis for normal insulin secretion . Diabetes Obes Metab.
2007; ; 9 ((suppl 2)) : :118.–132. 4.
Bosco
D
,
Haefliger
JA
,
Meda
P
. Connexins: key mediators of endocrine function . Physiol Rev.
2011; ; 91 : :1393.–1345. 5.
Potolicchio
I
,
Cigliola
V
,
Velazquez-Garcia
S
, et al.
P. Connexin-dependent signaling in neuro-hormonal systems . Biochim Biophys Acta.
2012 ( sous presse.). 6.
Calabrese
A
,
Zhang
M
,
Serre-Beinier
V
, et al.
Connexin 36 controls synchronization of Ca2+ oscillations and insulin secretion in MIN6 cells . Diabetes.
2003; ; 52 : :417.–424. 7.
Speier
S
,
Gjinovci
A
,
Charollais
A
, et al.
Cx36-mediated coupling reduces beta-cell heterogeneity, confines the stimulating glucose concentration range, and affects insulin release kinetics . Diabetes.
2007; ; 56 : :1078.–1086. 8.
Ravier
MA
,
Güldenagel
M
,
Charollais
A
, et al.
Loss of connexin36 channels alters beta-cell coupling, islet synchronization of glucose-induced Ca2+ and insulin oscillations, and basal insulin release . Diabetes.
2005; ; 54 : :1798.–1807. 9.
Klee
P
,
Lamprianou
S
,
Charollais
A
, et al.
Connexin implication in the control of the murine beta-cell mass . Pediatr Res.
2011; ; 70 : :142.–147. 10.
Klee
P
,
Allagnat
F
,
Pontes
H
, et al.
Connexins protect mouse pancreatic β cells against apoptosis . J Clin Invest.
2011; ; 121 : :4870.–4879. |