| |
| Med Sci (Paris). 2012 January; 28(1): 28–31. Published online 2012 January 27. doi: 10.1051/medsci/2012281010.Comprendre et combattre les toxines A/B en décryptant leur transport intracellulaire Dimitri Moreau1 and Frédéric Bard1* 1Institute for molecular and cell biology, FB lab - room 5-12 - Proteos, 61 Biopolis drive, 138673Singapore MeSH keywords: Animaux, Antidotes, pharmacologie, Toxines bactériennes, métabolisme, pharmacocinétique, Protéines de transport, antagonistes et inhibiteurs , physiologie, Conception de médicament, Endocytose, Réticulum endoplasmique, Techniques génétiques, Appareil de Golgi, Humains, Mammifères, Fusion membranaire, effets des médicaments et des substances chimiques, Modèles biologiques, Thérapie moléculaire ciblée, Famille multigénique, Transport de protéines, Interférence par ARN, Ricine |
Les toxines A/B : un important problème de santé publique La ricine, issue des graines de la plante Ricinus communis, et l’exotoxine de Pseudomonas (PE), produite par certaines souches de Pseudomonas aeruginosae, font partie d’une large famille de toxines protéiques [
1]. Ces toxines comportent deux sous-unités, A et B, requises pour le transport dans la cellule cible et l’activité catalytique nocive, respectivement [
2]. La ricine et les autres toxines végétales représentent une menace bioterroriste significative en raison de leur relative facilité de purification et de leur toxicité importante. D’autres toxines, comme la PE, sont produites par des pathogènes. Pseudomonas aeruginosae est impliqué dans de nombreuses infections des voies respiratoires et des plaies, notamment chez des patients ayant un déficit immunitaire, constitutionnel ou acquis. Parmi les autres toxines A/B, on trouve aussi les toxines Shiga et Shiga-like, qui sont en cause dans la dysenterie provoquée par Shigella et les intoxications alimentaires liées à certaines souches d’E. coli. Ces infections sont responsables de diarrhées hémolytiques et de complications rénales pouvant conduire au décès des patients. Les toxines diphtérique et cholérique sont impliquées dans certaines pathologies létales comme l’angine diphtérique et le choléra, maladies infectieuses qui sévissent encore dans certains pays en voie de développement. Dans toutes ces infections, les toxines sont des facteurs de virulence essentiels, notamment en raison des faibles doses requises pour engendrer la mort des cellules de l’hôte, y compris celles du système immunitaire. Les toxines compliquent aussi le traitement médical des pathologies associées. En effet, le traitement antibiotique, parce qu’il détruit les bactéries productrices, peut provoquer une importante libération de toxines potentiellement fatale. À l’heure actuelle, les traitements ciblant spécifiquement ces toxines sont basés principalement sur l’utilisation d’anticorps monoclonaux [
3,
4], mais leur efficacité est cependant limitée, et aucun n’a reçu d’AMM (autorisation de mise sur le marché) chez l’homme. Ces toxines posent un réel problème de santé publique, comme l’illustre leur responsabilité dans plusieurs catastrophes récentes : l’épidémie de choléra en Haïti et les intoxications alimentaires via des bactéries présentes dans les graines germées au printemps 2011 en Allemagne [
5]. Mais ces cas très médiatisés ne doivent pas faire oublier le fardeau quotidien que représentent les pathogènes et leurs toxines dans la pratique médicale quotidienne. Ainsi Pseudomonas aeruginosa peut représenter jusqu’à 42 % des pneumonies et 23 % des infections de plaies chirurgicales en unités de soins intensifs [
6,
7]. Ces infections augmentent sensiblement la mortalité, notamment pour des patients atteints d’insuffisance respiratoire [
8]. Les souches d’E. coli entérotoxiques et le vibrion cholérique sont aussi responsables de millions d’infections débilitantes dans le monde [
9]. La Commission Européenne a d’ailleurs réagi par la mise en place d’un consortium (ANTIGONE1) pour l’étude des souches de bactéries productrices de toxine Shiga [
10]. |
Le transport dans la cellule de mammifère Une particularité commune à la plupart des toxines A/B est leur capacité d’entrer dans les cellules de mammifères par endocytose, puis d’utiliser le transport rétrograde intracellulaire pour migrer des endosomes vers l’appareil de Golgi puis le réticulum endoplasmique où ces toxines trouvent une porte d’accès au cytosol où se trouve leur cible. Notons que la toxine diphtérique fait partie des rares exceptions à ce schéma : elle est en effet capable de traverser les membranes des endosomes. Une fois dans le cytosol, les toxines dérèglent la physiologie cellulaire en bloquant la synthèse protéique (ricine, shiga, PE et toxine diphtérique) ou en induisant une surproduction de messagers secondaires (cas de la toxine cholérique), ce qui finit par engendrer la mort cellulaire. Ainsi la machinerie de transport membranaire de la cellule cible, parce qu’elle permet aux toxines d’atteindre le compartiment cytosolique, est essentielle à l’intoxication de cette cellule. |
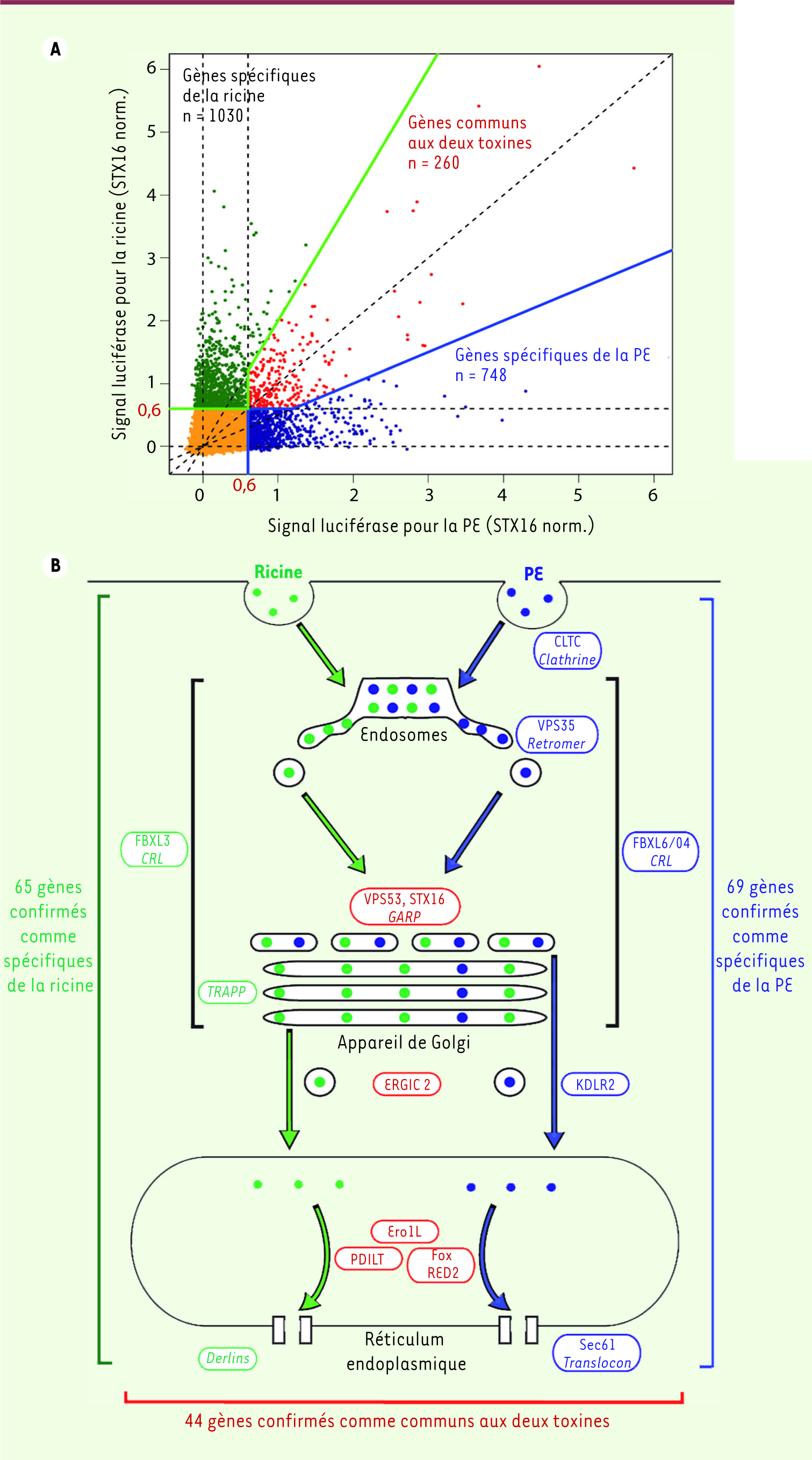
Criblage du génome humain pour identifier les acteurs du transport de la ricine et de la PE La première description du transport intracellulaire des toxines date des années 1990 [
11]. Même si depuis, de nombreux travaux ont été effectués pour mieux comprendre ce transport, les mécanismes moléculaires impliqués restent dans l’ensemble mal connus [
12]. Pour explorer cette question, nous avons utilisé une approche génétique basée sur le criblage par interférence ARN [1]. Nous avons mis au point une mesure sensible et rapide de l’intoxication basée sur la synthèse protéique de la protéine luciférase. L’inhibition par des ARN interférents de l’expression du produit d’un gène impliqué dans le transport des toxines aura un effet protecteur sur le signal luciférase. La ricine et la PE ont été étudiées en parallèle afin d’identifier des gènes communs et spécifiques des voies utilisées par ces deux toxines. Au cours de criblages pilotes, nous avons identifié la syntaxine 16 (STX16) comme essentielle au transport intracellulaire des deux toxines. Ce résultat validait notre approche car la syntaxine 16 est une protéine impliquée dans la fusion vésiculaire au niveau du Golgi. Le criblage des 20 000 gènes codant pour des protéines dans le génome humain a ensuite été réalisé (Figure 1). De façon surprenante, ce criblage a identifié de nombreux gènes dont l’effet protecteur est plus important que celui de la STX16, révélant une complexité biologique du trafic rétrograde jusqu’alors inconnue. En utilisant des seuils de sensibilité définis de façon mathématique, environ 2 000 gènes ont été sélectionnés et classés en fonction de leur spécificité pour chaque toxine (Figure 1A). Cette approche a révélé la surprenante divergence des mécanismes moléculaires mobilisés par les deux toxines, suggérant l’existence de différentes voies de transport rétrograde.
 | Figure 1.
Identification des protéines importante pour le transport intracellulaire des toxines. A. Représentation graphique des résultats du criblage par ARN interférence. Chaque point représente un gène (22 000 au total). Les axes représentent les valeurs d’activité luciférase normalisées par rapport à la valeur du contrôle positif (STX16), avec la ricine (abscisse) ou avec la PE (ordonnée). B. Carte du trafic membranaire des toxines avec le nombre de nouveaux gènes essentiels découverts (ces gènes représentent des cibles importantes pour le blocage de l’intoxication s’ils sont éteints, ce qui a été confirmé avec plusieurs méthodes de validation). |
|
Découverte de nouveaux complexes protéiques fonctionnels impliqués dans l’intoxication L’un des résultats les plus surprenants de ces travaux est le grand nombre de gènes requis pour l’intoxication et dont le rôle dans le trafic membranaire était jusqu’alors inconnu (Figure 1B). Par exemple, certaines culin ring ligases ont été identifiées. Ces complexes sont impliqués dans l’ubiquitinylation et la dégradation des protéines cytosoliques, mais leur rôle dans le trafic membranaire était jusqu’à présent insoupçonné. Autre surprise, des gènes essentiels pour l’intégrité du Golgi, comme ceux codant pour les protéines des complexes TRAPP (transport protein particle) et COG (conserved oligomeric Golgi), sont essentiels pour le transport de la ricine mais pas pour celui de la PE. Ceci suggère que la PE est capable de court-circuiter l’appareil de Golgi. Au niveau du réticulum endoplasmique, les deux toxines semblent interagir avec deux systèmes différents de translocation à travers la membrane, ce qui est surprenant : le translocon Sec61 pour la PE et les Derlins pour la ricine. Nos résultats suggèrent aussi pour la première fois que des complexes de protéines chaperonnes situés dans le cytosol aident les toxines à retrouver une configuration active. |
Des cibles moléculaires pour développer un antidote L’inhibition du trafic intracellulaire des toxines constitue une stratégie thérapeutique attractive. En effet, par contraste avec des anticorps bloquants par exemple, cette approche ne serait pas dépendante des variations antigéniques entre les différentes toxines et pourrait être plus générale. Des criblages pour découvrir des molécules thérapeutiques pouvant inhiber le transport intracellulaire des toxines ont d’ailleurs déjà été effectués [
13]. La découverte de nombreux gènes essentiels au transport des toxines offre autant de nouvelles cibles potentielles. Un candidat particulièrement intéressant est le gène ERGIC2 (endoplasmic reticulum-Golgi intermediate compartment), dont l’extinction par interférence ARN a un effet drastique sur la toxicité de la ricine, de la PE et même de la toxine de Shiga. Le produit de ce gène apparaît indispensable au transport rétrograde entre le Golgi et le réticulum endoplasmique de la plupart des toxines connues. En revanche, son inhibition ne semble pas avoir d’incidence marquée sur la viabilité cellulaire ou sur la sécrétion des protéines. Ainsi, cette analyse génétique a apporté une masse d’informations inédites sur les différents mécanismes moléculaires impliqués dans le transport intracellulaire des toxines protéiques de la famille des A/B toxines. Les gènes identifiés nous permettent d’établir une liste de nouvelles cibles thérapeutiques, dans laquelle on peut trouver des facteurs communs au transport de plusieurs types de toxines. De plus, il devient aussi possible d’envisager des stratégies intelligentes de multiciblage pour inhiber plus modérément le transport à plusieurs niveaux et ainsi limiter les effets indésirables tout en augmentant le potentiel protecteur. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Footnotes |
1.
Moreau
D
,
Kumar
P
,
Wang
SC
, et al.
Genome-wide RNAi screens identify genes required for ricin and PE intoxications . Dev Cell.
2011; ; 21 : :231.–244. 2.
Sandvig
K
,
Torgersen
ML
,
Engedal
N
, et al.
Protein toxins from plants and bacteria : probes for intracellular transport and tools in medicine . FEBS Lett.
2010; ; 584 : :2626.–2634. 3.
Rainey
GJ
,
Young
JA
. Antitoxins : novel strategies to target agents of bioterrorism . Nat Rev Microbiol.
2004; ; 2 : :721.–726. 4.
Thullier
P
,
Pelat
T
,
Vidal
D
. Anticorps et bioterrorisme . Med Sci (Paris).
2009; ; 25 : :1145.–1148. 5.
Buchholz
U
,
Bernard
H
,
Werber
D
, et al.
German outbreak of Escherichia coli O104 : H4 associated with sprouts . N Engl J Med.
2011; ; 365 : :1763.–1770. 6.
Barbier
F
,
Wolff
M
. Multirésistance chez Pseudomonas aeruginosa : vers l’impasse thérapeutique ?
Med Sci (Paris).
2010; ; 26 : :960.–968. 7.
Vojtova
V
,
Kolar
M
,
Hricova
K
, et al.
Antibiotic utilization and Pseudomonas aeruginosa resistance in intensive care units . New Microbiol.
2011; ; 34 : :291.–298. 8.
Montero
M
,
Dominguez
M
,
Orozco-Levi
M
, et al.
Mortality of COPD patients infected with multi-resistant Pseudomonas aeruginosa : a case and control study . Infection.
2009; ; 37 : :16.–19. 9.
Fischer Walker
CL
,
Sack
D
,
Black
RE
. Etiology of diarrhea in older children, adolescents and adults : a systematic review . PLoS Negl Trop Dis.
2010; ; 4 : :e768.. 10.
Eurosurveillance. New European research project to respond to unexpected epidemic threats such as Escherichia coli
. Eurosurveillance.
2011; ; 16 : :14.. 11.
Sandvig
K
,
Garred
O
,
Prydz
K
, et al.
Retrograde transport of endocytosed Shiga toxin to the endoplasmic reticulum . Nature.
1992; ; 358 : :510.–512. 12.
Johannes
L
,
Popoff
V
. Tracing the retrograde route in protein trafficking . Cell.
2008; ; 135 : :1175.–1187. 13.
Stechmann
B
,
Bai
SK
,
Gobbo
E
, et al.
Inhibition of retrograde transport protects mice from lethal ricin challenge . Cell.
2010; ; 141 : :231.–242. |