| |
| Med Sci (Paris). 2012 January; 28(1): 21–23. Published online 2012 January 27. doi: 10.1051/medsci/2012281007.L’étude des connexions cérébrales révèle les bases anatomiques de la dominance de l’hémisphère droit pour l’attention spatiale Michel Thiebaut de Schotten1,2,3* 1Natbrainlab, Department of Forensic and Neurodevelopmental Sciences, Institute of Psychiatry, King’s College London, Londres, Royaume-Uni 2Inserm, université Pierre et Marie Curie Paris 6, UMR S 975, groupe hospitalier Pitié-Salpêtrière, Paris, France 3Institut du cerveau et de la moelle (ICM), 47, Boulevard de l’Hôpital, 75651Paris Cedex 13France MeSH keywords: Attention, physiologie, Cartographie cérébrale, méthodes, Imagerie par tenseur de diffusion, Dominance cérébrale, Lobe frontal, Humains, Voies nerveuses, Lobe pariétal, Performance psychomotrice, Perception de la taille, Perception de l'espace, Transmission synaptique |
Contempler une œuvre d’art, chercher un ami dans la foule ou éviter un danger soudain sont des mécanismes qui reposent sur l’efficacité de notre cerveau pour le traitement visuospatial. Plusieurs décennies de recherche en neuropsychologie [
1] et en neuro-imagerie [
2] ont révélé que le traitement visuospatial est une fonction dominante de l’hémisphère cérébral droit, construite grâce à l’interaction du lobe frontal avec le lobe pariétal [
3]. Cependant, l’anatomie précise de cette dominance et l’organisation des connexions frontopariétales chez l’homme restaient jusqu’à ce jour inconnues [
4,
5]. |
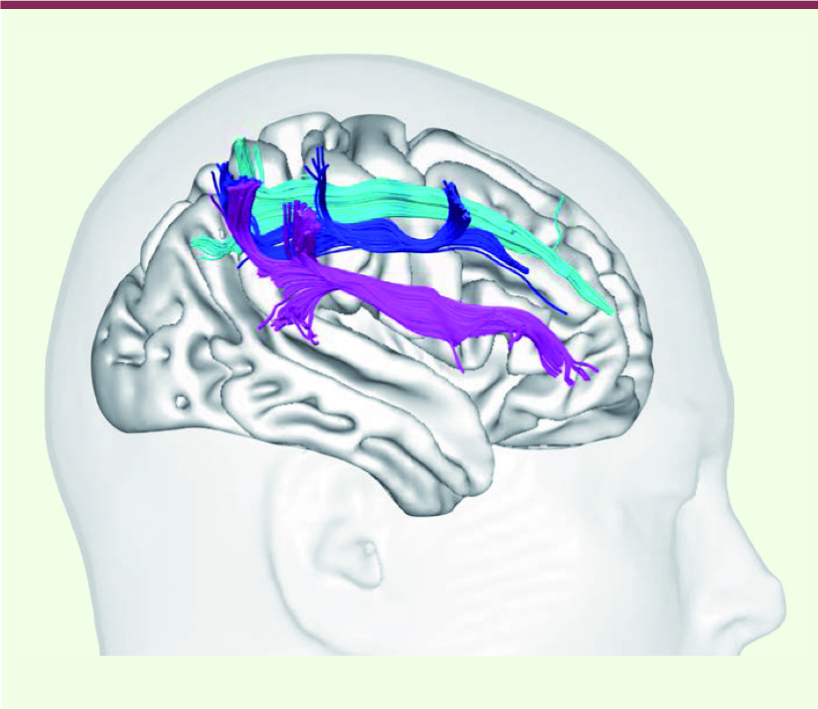
Explorer les connexions cérébrales chez l’être vivant Afin d’étudier plus en détail ces deux questions, nous avons scanné le cerveau de 20 participants sains avec une nouvelle technologie d’imagerie par résonance magnétique qui permet d’explorer les connexions cérébrales chez l’être vivant : la tractographie des déconvolutions sphériques (SD) calculées à partir de l’imagerie par résonance magnétique (IRM) pondérée par la diffusion (DWI) [
6,
7] (voir Encadré). En parallèle, nous avons mesuré le degré de dominance de l’hémisphère cérébral droit avec des tests neuropsychologiques comme la bissection de ligne et une expérience simple de détection de cibles dans les champs visuels gauche et droit. La tractographie des déconvolutions sphériques a révélé chez l’homme vivant trois connexions majeures entre le lobe frontal et le lobe pariétal, similaires à celles que l’on met en évidence chez le singe [
8] et appelées faisceaux longitudinaux supérieurs I, II et III (Figure 1). Le faisceau longitudinal supérieur I connecte le gyrus frontal supérieur et le sillon frontal supérieur au lobule pariétal supérieur et au précunéus. Le faisceau longitudinal supérieur II connecte le gyrus frontal moyen et la frontal eye field avec le gyrus angulaire et le sillon intrapariétal. Le faisceau longitudinal supérieur III connecte tout le gyrus frontal inférieur (incluant les pars orbitalis, triangularis et opercularis) et le sillon frontal inférieur avec la jonction temporopariétale et le gyrus supramarginal.
 | Figure 1.
Reconstruction en 3 dimensions des connexions cérébrales découvertes chez l’homme par tractographie des images de diffusion. Les faisceaux longitudinal supérieur I (en bleu clair), II (en bleu foncé) et III (en rose) sont figurés. |
|
Tractographie des déconvolutions sphériques des images de diffusion La tractographie des images de diffusion a permis l’identification de nombreux faisceaux de connexions de substance blanche [
11,
12]. Il s’agit d’une nouvelle méthode en neuro-imagerie qui permet de mesurer l’orientation de la diffusion des molécules d’eau dans le cerveau [
13]. En l’absence de contraintes physiques, plusieurs milliards de molécules d’eau se déplacent aléatoirement dans l’équivalent d’une goutte d’eau. Ce mouvement aléatoire est appelé mouvement brownien ou encore diffusion [
14]. Dans le cerveau, les contraintes physiques exercées par les fibres de connexions sur les molécules d’eau limitent les possibilités de diffusion à une direction générale. La tractographie des DWI construit alors un « tube » qui suit cette direction générale de voxel à voxel [13]. L’ensemble de ces tubes reproduisent l’organisation des grands faisceaux assurant la connectivité d’une zone cérébrale à une autre [
15]. Cependant un même voxel peut contenir plusieurs populations de fibres qui se croisent et ainsi biaiser la direction générale suivie par la tractographie. C’est pourquoi le modèle des déconvolutions sphériques est utilisé afin de modéliser les croisements de fibres et de reproduire une anatomie des connexions cérébrales plus précise que celle que peuvent offrir les méthodes standard.
|
|
Le volume des faisceaux longitudinaux est corrélé à la dominance de l’hémisphère cérébral droit dans le traitement visuospatial Le test de la bissection de ligne est une tâche durant laquelle les participants doivent marquer à l’aide d’un crayon le centre d’une ligne de 20 cm de long. Il est fréquent que le centre de la ligne indiqué par les participants soit décalé à gauche du centre réel de cette ligne. Cet effet est du à la meilleure performance de l’hémisphère droit dans le traitement visuospatial de la moitié gauche de la ligne. Notre étude révèle que cette déviation est corrélée au volume du faisceau longitudinal II dans les hémisphères gauche et droit. Un faisceau longitudinal supérieur II plus gros dans l’hémisphère droit que dans l’hémisphère gauche amène donc à surestimer la taille des évènements apparaissant dans le champ visuel gauche comparé avec ceux apparaissant dans le champ visuel droit Quelles sont alors les bases biologiques déterminant la taille de nos faisceaux cérébraux ? Le volume des faisceaux que nous avons mesuré peut varier selon le diamètre des axones, le nombre d’axones ou la quantité de myéline. Ces trois paramètres augmentent la vitesse de propagation des potentiels d’action le long des connexions cérébrales [
9]. C’est pourquoi dans une seconde expérience nous avons comparé la vitesse de traitement visuospatial par les hémisphères gauche et droit en utilisant une tâche durant laquelle les participants devaient détecter le plus rapidement possible des cibles apparaissant dans leurs champs visuels gauche et droit. À nouveau, la vitesse de détection des cibles apparaissant dans les champs visuels gauche et droit était corrélée à la taille du faisceau longitudinal supérieur II dans les hémisphères gauche et droit. Un faisceau longitudinal supérieur II plus gros dans l’hémisphère droit que dans l’hémisphère gauche est donc associé avec un traitement visuospatial plus rapide des évènements survenant à gauche comparé à ceux survenant à droite. En conclusion le degré de dominance de l’hémisphère droit pour le traitement visuospatial est associé à la taille du faisceau longitudinal supérieur II dans les hémisphères gauche et droit [
10]. Ces nouvelles données pourraient être des paramètres déterminants prédictifs de la récupération fonctionnelle des patients souffrant de problèmes visuospatiaux comme par exemple, l’héminégligence. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Sperry
RW
. Lateral specialization in the surgically separated hemispheres . The Neurosciences. 3rd Study Program 1974 . New York: : Rockefeller University Press; , 1974. 2.
Heilman
KM
,
Van Den Abell
T
. Right hemisphere dominance for attention: the mechanism underlying hemispheric asymmetries of inattention (neglect) . Neurology.
1980; ; 30 : :327.–330. 3.
Thiebaut de Schotten
M
,
Urbanski
M
,
Duffau
H
, et al.
Direct evidence for a parietal-frontal pathway subserving spatial awareness in humans . Science.
2005; ; 309 : :2226.–2228. 4.
Thiebaut de Schotten
M
,
Kinkingnéhun
S
,
Delmaire
C
, et al.
Visualization of disconnection syndromes in humans . Cortex.
2008; ; 44 : :1097.–1103. 5.
Thiebaut de Schotten
M
,
Ffytche
DH
,
Bizzi
A
, et al.
Atlasing location, asymmetry and inter-subject variability of white matter tracts in the human brain with MR diffusion tractography . Neuroimage.
2011; ; 54 : :49.–59. 6.
Dell’acqua
F
,
Scifo
P
,
Rizzo
G
, et al.
A modified damped Richardson-Lucy algorithm to reduce isotropic background effects in spherical deconvolution . Neuroimage.
2010; ; 49 : :1446.–1458. 7.
Dell’Acqua
F
,
Rizzo
G
,
Scifo
P
, et al.
A model-based deconvolution approach to solve fiber crossing in diffusion-weighted MR imaging . IEEE Transactions Bio-Medical Engineering.
2007; ; 54 : :462.–472. 8.
Thiebaut de Schotten
M
,
Dell’acqua
F
,
Valabregue
R
,
Catani
M
. The monkey to human comparative anatomy of the frontal lobe association tracts . Cortex.
2012; ; 48 : :82.–96. 9.
Waxman
SG
,
Bennett
MV
. Relative conduction velocities of small myelinated and non-myelinated fibres in the central nervous system . Nat New Biol.
1972; ; 238 : :217.–219. 10.
Thiebaut de Schotten
M
,
Dell’acqua
F
,
Forkel
SJ
, et al.
A lateralized brain network for visuospatial attention . Nat Neurosci.
2011; ; 14 : :1245.–1246. 11.
Catani
M
,
Howard
RJ
,
Pajevic
S
,
Jones
DK
. Virtual in vivo interactive dissection of white matter fasciculi in the human brain . Neuroimage.
2002; ; 17 : :77.–94. 12.
Wakana
S
,
Jiang
H
,
Nagae-Poetscher
LM
, et al.
Fiber tract-based atlas of human white matter anatomy . Radiology.
2004; ; 230 : :77.–287. 13.
Basser
PJ
,
Mattiello
J
,
Le Bihan
D
. MR diffusion tensor spectroscopy and imaging . Biophys J.
1994; ; 66 : :259.–267. 14.
Brown
R
. A brief account of microscopical observations. On the particles contained in the pollen of plants . The miscellaneous botanical works of Robert Brown. , volume 1 ; :1829.. 15.
Catani
M
,
Thiebaut de Schotten
M
. A diffusion tensor imaging tractography atlas for virtual in vivo dissections . Cortex.
2008; ; 44 : :1105.–1132. |