| |
| Med Sci (Paris). 2012 January; 28(1): 18–21. Published online 2012 January 27. doi: 10.1051/medsci/2012281006.Un rôle nouveau des métaux de transition dans l’immunité antimicrobienne Hélène Botella,1,2 Gustavo Stadthagen,1,2 Chantal de Chastellier,3,4,5 and Olivier Neyrolles1,2* 1Centre national de la recherche scientifique (CNRS), UMR 5089, Institut de pharmacologie et de biologie structurale (IPBS), Toulouse, 31077, France 2Université de Toulouse, université Paul Sabatier, IPBS, Toulouse, 31077, France 3Université Aix Marseille, faculté des sciences de Luminy, centre d’immunologie de Marseille-Luminy (CIML), Marseille, 13288, France 4Inserm, U 631, CIML, Marseille, F-13288, France 5CNRS, UMR 6102, CIML, Marseille, 13288, France MeSH keywords: Adenosine triphosphatases, antagonistes et inhibiteurs , métabolisme, Animaux, Antibactériens, pharmacologie, usage thérapeutique, Bactéries, effets des médicaments et des substances chimiques, enzymologie, pathogénicité, Infections bactériennes, traitement médicamenteux, immunologie, Protéines bactériennes, Transport biologique actif, Transporteurs de cations, physiologie, Cuivre, Conception de médicament, Humains, Immunité cellulaire, Fer, Macrophages, Manganèse, Souris, Modèles immunologiques, Phagocytose, Phagosomes, microbiologie, Éléments de transition, Virulence, Zinc |
Comprendre l’immunité antimicrobienne est essentiel afin de pouvoir envisager de nouvelles thérapeutiques permettant de combattre, voire d’éradiquer les infections. Quatre articles publiés récemment dans les revues Journal of Biological Chemistry, Proceedings of the National Academy of sciences of USA et Cell Host and Microbe jettent un regard nouveau sur les mécanismes impliqués dans la destruction des micro-organismes par les macrophages, en montrant comment les métaux de transition peuvent contribuer directement à cette fonction. |
NRAMP, un paradigme à revisiter Les macrophages, cellules immunitaires impliquées dans la phagocytose et la destruction des micro-organismes ainsi que dans la restructuration des tissus, emploient divers mécanismes pour détruire les microbes, notamment : acidification de la vacuole de phagocytose (phagosome), accumulation et activation dans le phagosome de plusieurs hydrolases, génération de radicaux libres nitrés et oxygénés, production de peptides antimicrobiens (défensines) qui lysent l’enveloppe des bactéries [
1]. Un autre de ces mécanismes repose sur la capacité des macrophages à priver les micro-organismes ingérés d’éléments essentiels à leur croissance, tels le fer ou le manganèse. Cette notion a été si généralisée qu’elle constitue presqu’un paradigme de la microbiologie cellulaire et de l’immunité innée antimicrobienne qu’on pourrait appeler le « paradigme NRAMP ». Quelques explications s’imposent. Du milieu des années 1970 au début des années 1980, trois équipes indépendantes ont localisé chez la souris un gène (encore non identifié à l’époque) conférant, selon sa forme allélique, une susceptibilité différentielle à l’infection par des pathogènes intracellulaires : le parasite Leishmania donovani et les bactéries Salmonella typhimurium et Mycobacterium bovis BCG. Ce gène mystère fut nommé respectivement Lsh, Ity et Bcg par les trois équipes. Les chercheurs réalisèrent rapidement que les trois gènes n’en formaient qu’un, à présent séquencé et connu sous le nom de Nramp1 pour natural resistance-associated protein 1 [
2,
3]. Près de quatre décennies de travaux réalisés par de nombreuses équipes ont permis de montrer que ce gène code pour un transporteur intracellulaire de métaux, plus précisément de fer et de manganèse, et que lorsque les macrophages phagocytent une particule, un micro-organisme par exemple, ce transporteur s’accumule à la membrane du phagosome et pompe le fer et le manganèse depuis l’intérieur de la vacuole vers le cytosol de la cellule, privant ainsi le microbe ingéré de métaux essentiels à sa survie (Figure 1) [
4]. Il est à présent admis que la privation en métaux (d’une façon générale) constitue un des mécanismes de l’immunité antimicrobienne. Cette généralisation est peut-être abusive.
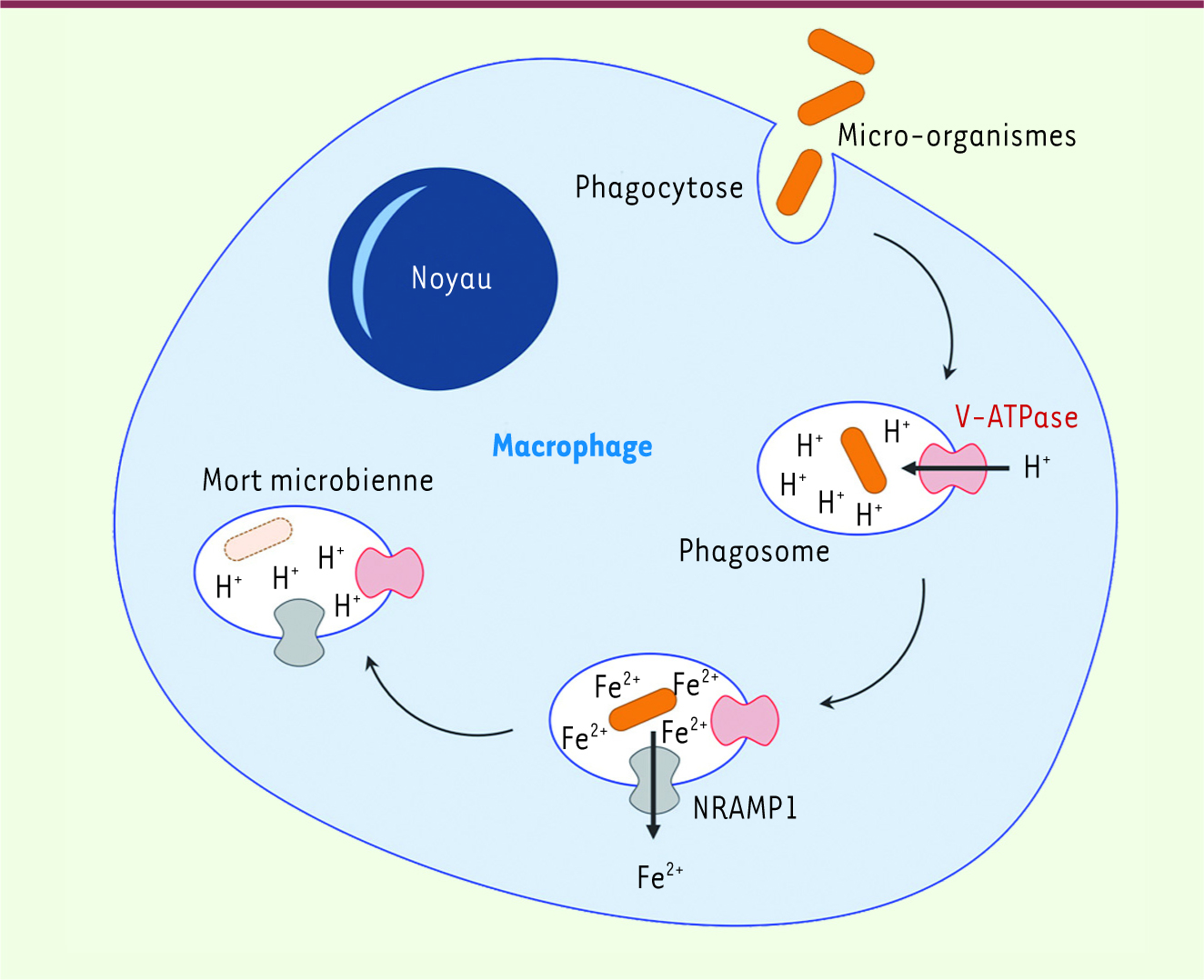
 | Figure 1.
Mode d’action de NRAMP1. Après ingestion (ou phagocytose) d’un micro-organisme par un macrophage, la particule ingérée se localise dans une vacuole intracellulaire ou phagosome. Une pompe à protons (V-ATPase) acidifie l’intérieur du phagosome (accumulation de protons H+). Au cours de sa maturation, le phagosome accumule à sa membrane la protéine Nramp1 qui pompe, dans un mouvement d’antiport avec des protons, des ions fer et manganèse (Fe2+, Mn2+) depuis la lumière du phagosome vers le cytosol de la cellule, privant ainsi le micro-organisme ingéré de ces nutriments essentiels à sa survie et sa prolifération. L’ensemble de ces mécanismes, avec d’autres, conduit à la mort microbienne. |
|
Empoisonnement et immunité, vers un second paradigme ? Les travaux récents conduits dans notre laboratoire et d’autres sont à apprécier à la lumière de ce « paradigme NRAMP ». Ces études suggèrent que le mécanisme inverse serait également vrai : les macrophages pourraient aussi non pas exclure mais accumuler des métaux, comme le cuivre ou le zinc, dans les phagosomes, à des concentrations potentiellement toxiques pour les micro-organismes. Concernant le cuivre, il a été montré qu’une pompe cellulaire à cuivre, ATP7A, s’accumule à la membrane des phagosomes dans des macrophages contenant des bactéries Escherichia coli, et que des mutants de E. coli déficients pour la pompe d’efflux CopA (permettant à la bactérie de résister à un excès de cuivre dans son environnement) sont détruits plus rapidement par les cellules immunitaires que la souche sauvage [
5]. Les mycobactéries, dont les plus connues sont les agents de la lèpre et de la tuberculose, Mycobacterium leprae et Mycobacterium tuberculosis, possèdent également des pompes d’efflux de métaux comme CopA (qu’on appelle des ATPases de type P). En particulier le génome de M. tuberculosis contient douze gènes codant potentiellement de telles ATPases ; ces gènes sont appelés ctp, pour cation-transporting protein. De façon un peu similaire à l’étude chez E. coli précédemment citée, deux équipes américaines ont montré en 2010 et 2011 que la protéine MctB et l’ATPase CtpV sont nécessaires à l’efflux de cuivre chez M. tuberculosis, et que des mutants mctB- ou ctpV-déficients de la bactérie sont moins virulents que la souche sauvage dans divers modèles cellulaires et animaux [
6,
7]. Ces résultats suggèrent que, comme pour E. coli, M. tuberculosis a besoin d’un système d’efflux de cuivre fonctionnel pour être pleinement virulente. Des études réalisées avec d’autres pathogènes, comme Listeria monocytogenes ou Streptococcus pneumoniae, ont conduit à des conclusions similaires, montrant qu’un système d’efflux de cuivre intact est nécessaire à la virulence de ces bactéries [
8]. Plus récemment encore, nous avons montré au laboratoire qu’une autre de ces ATPases de type P chez M. tuberculosis, la protéine CtpC, est impliquée dans la résistance des bactéries à des concentrations potentiellement toxiques de zinc, et qu’un mutant inactivé dans le gène ctpC se multiplie mal dans les macrophages, sa virulence est donc atténuée [
9]. Nous avons également observé, par microscopie confocale et électronique, que du zinc est libéré dans les macrophages au cours de l’infection par M. tuberculosis, une fraction de ce zinc libre s’accumulant dans le phagosome mycobactérien (Figure 2A). Ces résultats renforcent des résultats plus anciens obtenus par fluorescence aux rayons X, montrant que la concentration du phagosome mycobactérien en zinc peut atteindre près de 0,5 mM après 24 heures d’infection [
10], une concentration à laquelle le mutant ctpC-déficient de la bactérie est tué.
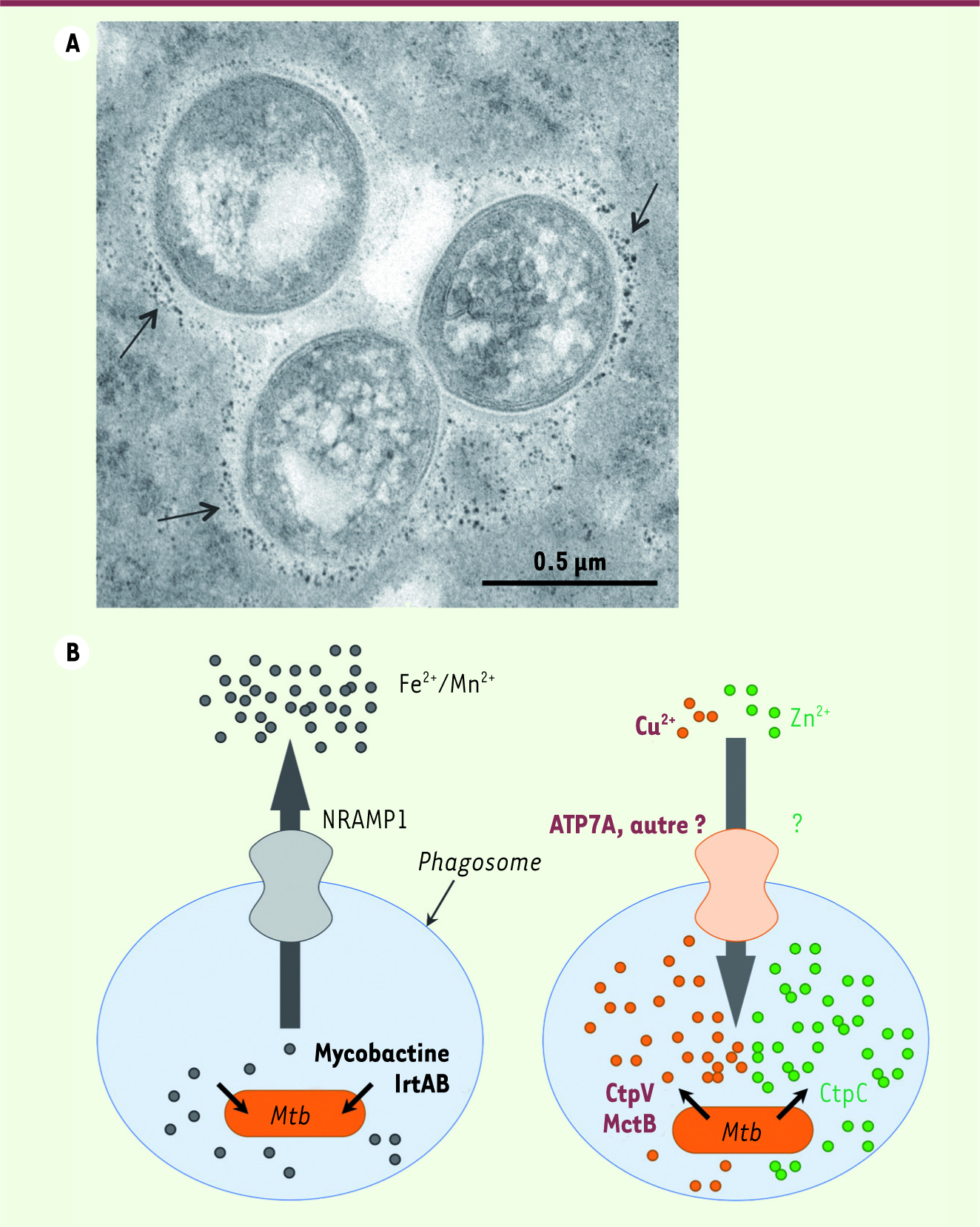
 | Figure 2.
Modèle d’action antimicrobienne des métaux de transition (cuivre et zinc) dans les macrophages. A. coupe fine (70 nm) de trois bacilles tuberculeux (Mycobacterium tuberculosis) dans un macrophage humain. Le compartiment dans lequel résident les bacilles (phagosome) est riche en zinc, que l’on voit sous forme de petits dépôts noirs de sulfate de zinc (flèches) obtenus après traitement approprié en microscopie électronique. B. En complément du « paradigme NRAMP » qui propose que les macrophages privent les micro-organismes ingérés d’éléments essentiels comme le fer ou le manganèse (schéma de gauche), nous proposons que ces cellules immunitaires sont aussi capables d’intoxiquer les microbes par d’autres métaux de transition, le cuivre et le zinc en particulier. Les pompes à cuivre et surtout à zinc restent à identifier. En réaction à ces mécanismes cellulaires, M. tuberculosis (Mtb) surexprime dans les phagosomes des molécules lui permettant à la fois de capter le fer (mycobactine, protéines IrtA et IrtB) et d’effluer le cuivre (CtpV, MctB) et le zinc (CtpC). |
|
Préadaptation et virulence, ou comment sortir des eaux pour entrer dans un macrophage Ces travaux jettent un regard nouveau sur le rôle des métaux dans l’immunité antimicrobienne et la virulence bactérienne. À la différence du mécanisme d’exclusion du fer par NRAMP, et en complément de celui-ci, ces études mettent en évidence l’existence de mécanismes de surcharge en autres métaux des compartiments intracellulaires contenant des bactéries. Nous proposons que les macrophages utilisent certains métaux de transition pour empoisonner les microbes ingérés (Figure 2B). Le zinc et le cuivre en sont deux exemples, d’autres seront peut-être découverts plus tard. En réaction à cette intoxication intracellulaire, les bactéries utilisent des transporteurs de métaux, dont les ATPases de type P (telles CopA pour E. coli, ou CtpV et CtpC pour M. tuberculosis) pour détoxifier leur milieu intracellulaire. Il est intéressant de remarquer que ces ATPases de type P ne sont pas restreintes aux espèces pathogènes. Par exemple des mycobactéries environnementales non pathogènes, telle que Mycobacterium smegmatis, une lointaine cousine de M. tuberculosis, possède aussi certaines de ces pompes. On peut proposer que l’ancêtre de M. tuberculosis, qui était très vraisemblablement une espèce environnementale, utilisait ces pompes pour détoxifier les métaux présents dans les sols et les eaux, des milieux qui peuvent être soumis à de brusques variations de composition chimique. Au cours de son évolution vers sa forme actuelle de pathogène intracellulaire, M. tuberculosis a pu trouver « utile » de conserver ces pompes pour détoxifier les métaux présents dans un nouvel environnement : le phagosome. Cette idée rappelle la théorie de « l’exaptation » (ou préadaptation) proposée il y a une trentaine d’années par le paléontologue Stephen J. Gould, et qui décrit une forme d’évolution dans laquelle la fonction actuellement remplie par l’adaptation n’était pas celle remplie initialement. Les plumes des oiseaux par exemple ont sans doute d’abord servi à réguler la chaleur du corps avant d’être « exaptées » pour le vol. |
Vers des applications thérapeutiques ? Comment les métaux atteignent-ils le phagosome ? Que transportent les autres ATPases de type P de M. tuberculosis et jouent-elles un rôle dans la virulence de la bactérie ? Dans quelle mesure pourrait-on manipuler ces mécanismes pour les rendre encore plus efficaces et envisager des applications thérapeutiques ? Pourrait-on développer des antibiotiques qui bloqueraient l’action des ATPases de type P chez les microbes et faciliteraient leur intoxication métallique et leur élimination ? Pourrait-on améliorer les traitements classiques avec des suppléments nutritionnels adaptés aux populations et en particulier à leur capacité relative à métaboliser le zinc (différences génétiques) ? De multiples questions se posent maintenant. L’avenir et la recherche diront si la manipulation de mécanismes aussi sophistiqués soutenant les interactions hôte-pathogène peut être envisagée à des fins thérapeutiques. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Pluddemann
A
,
Mukhopadhyay
S
,
Gordon
S
. Innate immunity to intracellular pathogens: macrophage receptors and responses to microbial entry . Immunol Rev.
2011; ; 240 : :11.–24. 2.
Forbes
JR
,
Gros
P
. Divalent-metal transport by NRAMP proteins at the interface of host-pathogen interactions . Trends Microbiol.
2001; ; 9 : :397.–403. 3.
Skamene
E
,
Schurr
E
,
Gros
P
. Infection genomics: Nramp1 as a major determinant of natural resistance to intracellular infections . Annu Rev Med.
2008; ; 49 : :275.–287. 4.
Cellier
MF
,
Courville
P
,
Campion
C
. Nramp1 phagocyte intracellular metal withdrawal defense . Microbes Infect.
2007; ; 9 : :1662.–1670. 5.
White
C
,
Lee
J
,
Kambe
T
,
Fritsche
K
,
Petris
MJ
. A role for the ATP7A copper-transporting ATPase in macrophage bactericidal activity . J Biol Chem.
2009; ; 284 : :33949.–33956. 6.
Ward
SK
,
Abomoelak
B
,
Hoye
EA
,
Steinberg
H
,
Talaat
AM
. CtpV: a putative copper exporter required for full virulence of Mycobacterium tuberculosis
. Mol Microbiol.
2010; ; 77 : :1096.–110. 7.
Wolschendorf
F
,
Ackart
D
,
Shrestha
TB
, et al.
Copper resistance is essential for virulence of Mycobacterium tuberculosis
. Proc Natl Acad Sci USA.
2011; ; 108 : :1621.–1626. 8.
Shafeeq
S
,
Yesilkaya
H
,
Kloosterman
TG
, et al.
The cop operon is required for copper homeostasis and contributes to virulence in Streptococcus pneumoniae
. Mol Microbiol.
2011; ; 81 : :1255.–1270. 9.
Botella
H
,
Peyron
P
,
Levillain
F
, et al.
Mycobacterial p(1)-type ATPases mediate resistance to zinc poisoning in human macrophages . Cell Host Microbe.
2011; ; 10 : :248.–259. 10.
Wagner
D
,
Maser
J
,
Lai
B
, et al.
Elemental analysis of Mycobacterium avium-, Mycobacterium tuberculosis-, and Mycobacterium smegmatis-containing phagosomes indicates pathogen-induced microenvironments within the host cell’s endosomal system . J Immunol.
2005; ; 174 : :1491.–1500. |