| |
| Med Sci (Paris). 2012 January; 28(1): 13–15. Published online 2012 January 27. doi: 10.1051/medsci/2012281004.Stéatose hépatique et stress du réticulum endoplasmique Une histoire de phospholipides Mélissa Flamment1,2* and Fabienne Foufelle1,2 1Inserm, UMR-S 872, centre de recherches des Cordeliers, Paris, France 2Université Pierre et Marie Curie-Paris 6, UMR-S 872, Paris, France MeSH keywords: Animaux, Transport biologique actif, Calcium, métabolisme, Choline-phosphate cytidylyltransferase, Stress du réticulum endoplasmique, physiologie, Stéatose hépatique, Homéostasie, Humains, Lipides membranaires, Souris, Souris obèse, Phosphatidylcholines, Phosphatidylethanolamine N-methyltransferase, Phosphatidyléthanolamine, Phospholipides, Sarcoplasmic Reticulum Calcium-Transporting ATPases, Triglycéride, Réponse aux protéines mal repliées |
La stéatose hépatique métabolique, qui se caractérise par une accumulation de triglycérides dans l’hépatocyte, est une des complications majeures de l’obésité. Considérée pendant longtemps comme bénigne, la stéatose hépatique suscite depuis quelques années un intérêt croissant principalement pour deux raisons. D’une part, elle est le prérequis pour l’évolution vers des maladies hépatiques plus sévères (stéatohépatite, cirrhose, hépatocarcinome), d’autre part elle est fortement associée au développement d’une insulinorésistance caractéristique du syndrome métabolique. Le captage des acides gras libres circulants et la synthèse de novo d’acides gras (lipogenèse) sont les deux voies majeures impliquées dans l’accumulation des triglycérides hépatiques lors de la stéatose [
1]. Au cours de ces dernières années, le stress du réticulum endoplasmique (RE) est apparu comme un nouvel acteur dans le développement de la stéatose hépatique associée à l’obésité [
2]. |
Réticulum endoplasmique et unfolded protein response
Le réticulum endoplasmique assure des fonctions cruciales pour le maintien de l’homéostasie cellulaire. Il est le premier compartiment de la voie sécrétoire. Toutes les protéines membranaires ou sécrétées sont dirigées après leur traduction dans la lumière du réticulum endoplasmique, où elles sont modifiées (N-glycosylation, ajout de ponts disulfures, oligomérisation, etc.) pour acquérir leur fonction définitive. Le réticulum endoplasmique joue également un rôle majeur dans l’homéostasie calcique. La concentration calcique dans le réticulum endoplasmique est environ mille fois plus importante que dans le cytoplasme. L’entrée du Ca++ se fait par la pompe SERCA (sarco/endoplasmic reticulum calcium ATPase) qui permet le transport actif du Ca++ du cytosol vers la lumière du réticulum endoplasmique. Finalement, le réticulum endoplasmique est le lieu où sont synthétisées la plupart des macromolécules lipidiques (triglycérides, phospholipides, cholestérol). Toute modification qui conduit à une altération des fonctions du réticulum endoplasmique (accumulation de protéines mal repliées, modification de l’équilibre calcique, etc.) est appelée « stress » du réticulum endoplasmique et entraîne la mise en place d’une réponse cellulaire appelée UPR (unfolded protein response) [
10]. Le rôle de l’UPR est de rétablir l’homéostasie du réticulum endoplasmique principalement par deux mécanismes : d’une part en diminuant la synthèse protéique, d’autre part en activant la transcription de protéines résidentes du réticulum endoplasmique nécessaires au repliement des protéines. |
Stress du réticulum endoplasmique et stéatose hépatique La présence d’un stress du réticulum endoplasmique chronique a été mise en évidence dans le foie stéatosé chez le rongeur et chez l’homme [
3,
4]. Cette activation chronique du stress du réticulum endoplasmique conduit à des perturbations importantes du métabolisme lipidique hépatique. Nous avons montré que le stress du réticulum endoplasmique activait le facteur de transcription SREBP-1c (sterol regulatory element binding protein-1c), facteur majeur contrôlant la lipogenèse hépatique (synthèse de novo d’acides gras) [
5]. Il entraîne d’autre part une diminution de la synthèse de l’apoB, apolipoprotéine majeure des VLDL (very low density lipoproteins), conduisant ainsi à une diminution de l’export des acides gras. Ainsi, la présence d’un stress du réticulum endoplasmique chronique contribue à l’accumulation des acides gras dans le foie en stimulant les voies de synthèse et en inhibant les voies d’export. On peut souligner que le traitement de souris obèses par des chaperons moléculaires ou chimiques qui inhibent la voie du stress du réticulum endoplasmique entraîne une diminution de la stéatose hépatique qui s’accompagne d’une amélioration de la sensibilité à l’insuline [5,
6]. Alors que les conséquences de l’activation du stress du réticulum endoplasmique sur le métabolisme hépatique commencent à être élucidées [
7], les facteurs conduisant à l’apparition d’un stress chronique dans le foie au cours de la stéatose métabolique demeuraient jusqu’à présent inconnus. |
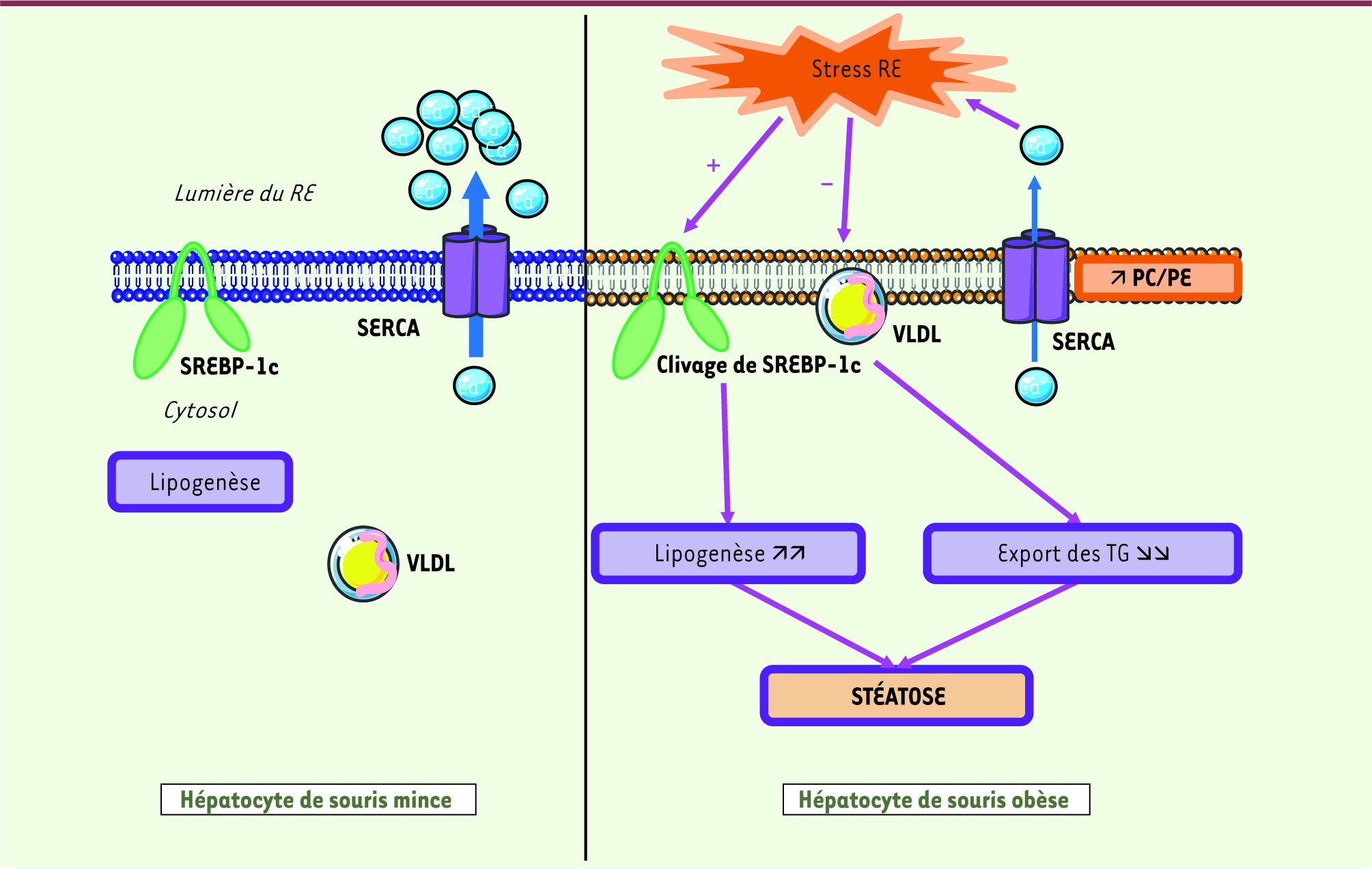
Rôle de la composition en phospholipides des membranes du réticulum endoplasmique dans le stress du réticulum endoplasmique dans le foie Dans un article récent publié dans Nature, l’équipe de G.S. Hotamisligil (Harvard school of public health, Boston, MA, États-Unis) a cherché à identifier les facteurs responsables du développement d’un stress du réticulum endoplasmique chronique dans le foie de souris obèses. Les auteurs ont analysé les profils protéique et lipidique du réticulum endoplasmique purifié à partir de foies de souris génétiquement obèses (ob/ob, déficitaires en leptine) ou de souris minces [
8]. L’analyse protéomique montre, contrairement à ce qui était attendu, qu’une synthèse accrue de protéines n’est pas à l’origine du stress du réticulum endoplasmique observé dans le foie de la souris obèse. L’analyse des différentes espèces lipidiques présentes dans le réticulum endoplasmique permet de tirer deux importantes conclusions : (1) les lipides présents dans les membranes du réticulum endoplasmique ne sont pas d’origine alimentaire mais sont synthétisés de novo par la voie de la lipogenèse ; (2) les membranes du réticulum endoplasmique des souris obèses ont une composition lipidique distincte de celle des souris minces. La nature des phospholipides membranaires est très différente avec un rapport phosphatidylcholine (PC)/phosphatidyléthanolamine (PE) très augmenté dans le foie des souris obèses. L’augmentation du contenu en PC est probablement due à la surexpression de deux enzymes clés de la voie de synthèse des PC et de la conversion de PE en PC, respectivement : la Pcyt1a (choline-phosphate cytidylyl-transférase A) et la Pemt (phosphatityl-éthanolamine N-méthyltransférase). Dans la mesure où il a été montré qu’une augmentation du contenu en PC dans les membranes du réticulum endoplasmique inhibe l’activité de transport du calcium par la pompe SERCA [
9], les auteurs ont ensuite mesuré le transport de calcium dans des membranes de réticulum endoplasmique enrichies en PC. Le traitement de microsomes (fragments de membranes du réticulum endoplasmique) avec de la PC ou la surexpression de l’enzyme responsable de la conversion de PE en PC (Pemt) dans des lignées d’hépatome, entraînent une diminution du transport de calcium dans le réticulum endoplasmique qui est la conséquence d’une diminution d’activité de la pompe SERCA. Les auteurs ont ensuite mis en évidence que chez la souris obèse, l’augmentation du contenu en PC dans les membranes du réticulum endoplasmique s’accompagne d’une diminution du transport de calcium vers la lumière du RE. Ainsi, l’augmentation du rapport PC/PE entraîne une diminution de l’activité de la pompe calcique SERCA qui aboutit à l’apparition d’un stress du réticulum endoplasmique. Afin de confirmer l’importance du contenu en PC et de l’homéostasie calcique dans l’apparition du stress du réticulum endoplasmique chez la souris ob/ob, les auteurs ont utilisé deux stratégies. Ils ont d’une part inhibé l’expression de la Pemt afin de limiter la synthèse de PC, et d’autre part surexprimé la SERCA afin d’augmenter le transport de calcium dans le réticulum. Les deux approches conduisent à une amélioration de l’homéostasie calcique, à une diminution du stress du réticulum endoplasmique, à une réduction de la stéatose hépatique et à une amélioration de l’homéostasie glucidique chez la souris obèse. En conclusion, ce travail a permis de montrer qu’une modification de la composition lipidique des membranes du réticulum endoplasmique, en altérant l’homéostasie calcique, est à l’origine du développement d’un stress du réticulum endoplasmique chronique chez la souris obèse. Une des notions qui émerge de ces résultats est la contribution importante de la lipogenèse dans l’altération de la composition en phospholipides du réticulum endoplasmique. Ceci met en évidence l’existence d’un cercle vicieux dans lequel l’augmentation de la lipogenèse dans le foie des rongeurs obèses entraîne une activation du stress du réticulum endoplasmique qui, en retour, induit la lipogenèse via l’activation de SREBP-1c (Figure 1). Plusieurs questions restent toutefois en suspens. Quels sont les mécanismes qui entraînent une modification du rapport PC/PE chez les animaux obèses ? Ce type de mécanisme est-il responsable du stress du réticulum endoplasmique observé dans d’autres types de stéatose notamment la stéatose induite par un régime gras dans laquelle la lipogenèse contribue peu à l’accumulation des triglycérides ?
 | Figure 1.
Mécanisme conduisant à l’activation du stress du réticulum endoplasmique et à l’installation d’une stéatose dans le foie de la souris obèse. Dans l’hépatocyte normal, l’homéostasie calcique est maintenue grâce à la pompe SERCA qui fait entrer le calcium dans le RE. Dans l’hépatocyte de souris obèse, la composition en phospholipides des membranes du réticulum endoplasmique est profondément modifiée avec une augmentation du rapport PC/PE (phosphatidylcholine/phosphatidyléthanolamine). Cette altération de la composition en lipides des membranes du réticulum endoplasmique conduit à une diminution de l’activité de la pompe SERCA, à une perturbation de l’homéostasie calcique et à l’apparition d’un stress du réticulum endoplasmique. Celui-ci entraîne une diminution de la synthèse des VLDL et une activation de la lipogenèse en induisant le clivage du facteur de transcription SREBP-1c. Ces deux mécanismes concourent ainsi à l’installation d’une stéatose. |
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Donnelly
KL
,
Smith
CI
,
Schwarzenberg
SJ
, et al.
Sources of fatty acids stored in liver and secreted via lipoproteins in patients with nonalcoholic fatty liver disease . J Clin Invest.
2005; ; 115 : :1343.–1351. 2.
Flamment
M
,
Kammoun
HL
,
Hainault
I
, et al.
Endoplasmic reticulum stress: a new actor in the development of hepatic steatosis . Curr Opin Lipidol.
2010; ; 21 : :239.–246. 3.
Ozcan
U
,
Cao
Q
,
Yilmaz
E
, et al.
Endoplasmic reticulum stress links obesity, insulin action, and type 2 diabetes . Science.
2004; ; 306 : :457.–461. 4.
Puri
P
,
Mirshahi
F
,
Cheung
O
, et al.
Activation and dysregulation of the unfolded protein response in nonalcoholic fatty liver disease . Gastroenterology.
2008; ; 134 : :568.–576. 5.
Kammoun
HL
,
Chabanon
H
,
Hainault
I
, et al.
GRP78 expression inhibits insulin and ER stress-induced SREBP-1c activation and reduces hepatic steatosis in mice . J Clin Invest.
2009; ; 119 : :1201.–1215. 6.
Ozcan
U
,
Yilmaz
E
,
Ozcan
L
, et al.
Chemical chaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes . Science.
2006; ; 313 : :1137.–1140. 7.
Cnop
M
,
Foufelle
F
,
Velloso
LA
. Endoplasmic reticulum stress, obesity and diabetes . Trends Mol Med.
2011; ; 31
août (online).
8.
Fu
S
,
Yang
L
,
Li
P
, et al.
Aberrant lipid metabolism disrupts calcium homeostasis causing liver endoplasmic reticulum stress in obesity . Nature.
2011; ; 473 : :528.–531. 9.
Li
Y
,
Ge
M
,
Ciani
L
, et al.
Enrichment of endoplasmic reticulum with cholesterol inhibits sarcoplasmic-endoplasmic reticulum calcium ATPase-2b activity in parallel with increased order of membrane lipids: implications for depletion of endoplasmic reticulum calcium stores and apoptosis in cholesterol-loaded macrophages . J Biol Chem.
2004; ; 279 : :37030.–37039. 10.
Foufelle
F
,
Ferré
P
. La réponse UPR : son rôle physiologique et physiopathologique . Med Sci (Paris).
2007; ; 23 : :291.–296. |