Identifier les précurseurs de la microglie L’origine de la microglie, initialement décrite comme étant neuroectodermique comme celle de la macroglie, est restée un sujet de controverses depuis sa description dans les années 1930 par del Rio Hortega. Il est maintenant établi que la microglie, en tant que macrophages du SNC, est d’origine hématopoïétique [
5]. Mais la nature exacte des précurseurs initiaux de la microglie reste inconnue. Préalablement à notre étude, il avait été montré chez la souris que des cellules présentant un potentiel de prolifération et de différenciation microgliale in vitro sont présentes très précocement dans le cerveau présomptif (à partir de 8 jours de gestation [jdg] sur les 20 jours totaux du développement murin) [
6]. À ce stade de développement, seul le sac vitellin (SV), annexe extra-embryonnaire, est capable de produire les premières cellules hématopoïétiques, principalement des érythrocytes et des macrophages dès 7 jdg. Cette hématopoïèse précoce du SV est nommée hématopoïèse primitive, par opposition à celle dite définitive qui dérive de cellules souches multipotentes produites dans la région intra-embryonnaire appelée splanchnopleure para-aortique (P-Sp), puis aorte-gonades-mésonéphros (AGM) [
7,
11]. Ces cellules migrent ultérieurement dans le foie fœtal et la moelle osseuse pour y produire toutes les cellules hématopoïétiques. Les précurseurs de la microglie pourraient donc provenir du SV, mais ces observations ne montraient pas formellement que les précurseurs du SV contribuaient à la totalité de la microglie adulte. Il était tout à fait envisageable que la microglie embryonnaire pût être remplacée partiellement ou totalement par une seconde vague de microglie provenant de précurseurs issus du foie fœtal et/ou de la moelle osseuse. En effet, de nombreuses études des différentes pathologies du SNC adulte ont montré que les monocytes du sang circulant recrutés dans le tissu nerveux enflammé se différenciaient en cellules phénotypiquement analogues à la microglie [
8]. Ces résultats ont promu l’hypothèse de l’origine monocytaire (et donc issue de l’hématopoïèse définitive) de la microglie, au détriment d’une origine primitive dans le SV, bien que ces travaux n’aient jamais vraiment démontré quel était le degré de similitude entre la microglie dérivée des monocytes lors d’un processus inflammatoire et la microglie dans le tissu sain. Les progéniteurs hématopoïétiques du sac vitellin à l’origine de la microglie ? Pour répondre à cette question fondamentale, nous avons comparé la contribution à la formation de la microglie des progéniteurs du SV (hématopoïèse primitive) à celle des progéniteurs du foie fœtal et/ou de la moelle osseuse (hématopoïèse définitive) [
9]. Nous avons utilisé différentes approches pour savoir où, quand et comment la microglie se développait dans le SNC murin. Pour évaluer la contribution de précurseurs dérivant de la moelle osseuse tels que les monocytes après la naissance, nous avons irradié sublétalement des nouveau-nés (entre 12 h et 24 h après la naissance) et avons reconstitué la moelle osseuse en greffant à ces animaux la moelle osseuse de souris congéniques (souris génétiquement identiques ne différant que par un marqueur génique). Pour distinguer l’origine des cellules de la microglie après irradiation et reconstitution, nous avons utilisé le système congénique CD45.1/CD45.2 (CD45.1 et CD45.2 sont deux allèles du marqueur hématopoïétique CD45, détectables par cytométrie de flux). Dans ce système, les cellules hématopoïétiques de l’hôte (nouveau-nés irradiés) sont CD45.2 et les cellules hématopoïétiques du donneur (moelle osseuse transférée) sont CD45.1. Plusieurs mois après la transplantation (de 3 à 7 mois), nous avons mesuré par cytométrie en flux la proportion de cellules de l’hôte (CD45.2) et du donneur (CD45.1) parmi les cellules microgliales adultes. Celles-ci étaient presque uniquement CD45.2 (pour 95 à 99 %) et donc dérivées de l’hôte alors que les leucocytes sanguins dont les monocytes ainsi que diverses autres populations de macrophages se caractérisaient par leur chimérisme (en proportion de 30 à 60 %). Ces résultats montrent clairement que les précurseurs de la microglie adulte étaient déjà présents avant la naissance et excluent ainsi toute contribution de progéniteurs postnataux dérivant de la moelle osseuse. Si les précurseurs de la microglie sont présents dès la naissance, ils peuvent donc provenir du SV ou du foie fœtal, les deux sites principaux de l’hématopoïèse embryonnaire. L’activité hématopoïétique du SV, qui produit des cellules érythromyéloïdes, débute dès 7 jdg, alors que celle du foie fœtal commence seulement autour de 10,5 jdg, après la colonisation par des précurseurs du SV et par des cellules souches multipotentes produites dans l’AGM dès 9,5 jdg. Nous avons donc cherché à déterminer à quel moment de l’embryogenèse nous pouvions détecter des cellules de type microglial dans le cerveau présomptif. Utilisant un modèle murin qui exprime un gène rapporteur fluorescent (GFP, green fluorescent protein) sous le contrôle du promoteur du gène codant pour le récepteur de la fractalkine (CX3CR1, qui est un marqueur spécifique de la microglie adulte), nous avons pu détecter des cellules exprimant la GFP (et donc CX3CR1) dès 9,5 jdg. Ces cellules expriment aussi les marqueurs de macrophages CD11b et F4/80 et présentent donc un phénotype analogue à celui des macrophages primitifs isolés du SV au même stade de développement. De plus, ces deux types cellulaires expriment fortement le récepteur du colony stimulating factor 1 (CSF-1R), une cytokine cruciale pour la différenciation des macrophages. Ces deux types cellulaires sont aussi tous deux dépendants de ce récepteur, puisque absents dans le modèle murin déficient pour CSF-1R. Bien que corrélatifs, ces résultats suggèrent une possible filiation entre ces macrophages du SV et les précurseurs de la microglie, mais n’expliquent pas leur persistance chez l’adulte. Détermination du destin cellulaire des progéniteurs hématopoïétiques du SV Pour répondre à cette question, nous avons utilisé un modèle de souris dit de fate mapping (suivi du destin cellulaire) qui consiste à marquer spécifiquement les cellules dérivant des précurseurs du SV, ce qui permet de suivre ainsi leur évolution au cours du développement. Dans ce modèle est d’une part exprimée, sous le contrôle du promoteur d’un gène spécifiquement exprimé par les précurseurs du SV, une recombinase CRE dont la fonction est induite par le tamoxifène. D’autre part, un gène rapporteur est exprimé sous le contrôle d’un promoteur ubiquitaire. Cependant, sa transcription est bloquée par un stop transcriptionnel entouré de deux sites lox-P, séquences cibles de la CRE (Figure 1) [
10]. L’activation temporaire de la CRE (de 12 h à 24 h) après administration du tamoxifène induit la délétion du stop transcriptionnel et conduit ainsi à l’expression irréversible du gène rapporteur seulement dans les précurseurs du SV et leur descendance.
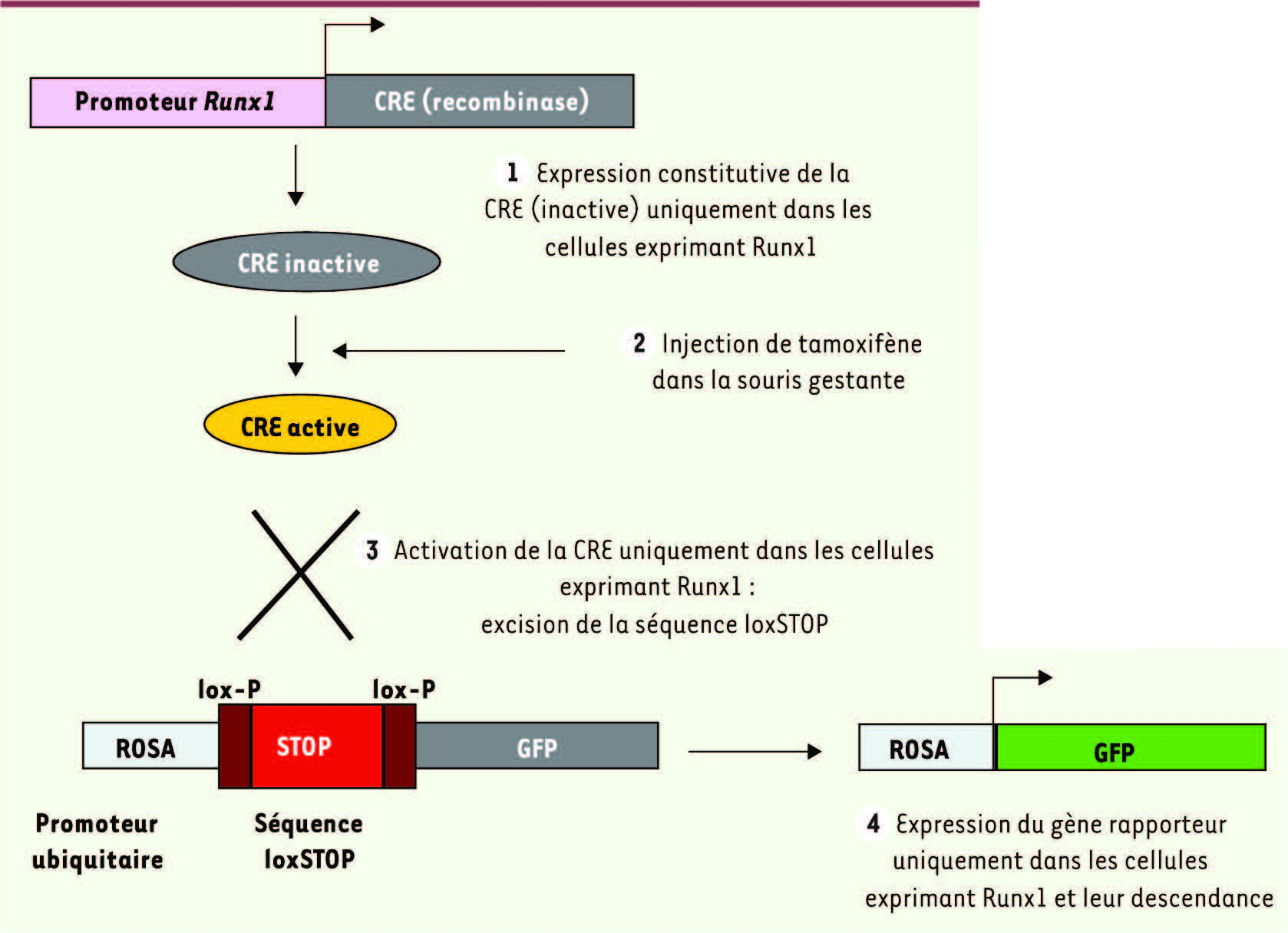
 | Figure 1.
Stratégie de suivi du destin cellulaire des précurseurs du sac vitellin chez la souris. Dans ce modèle, l’expression de la recombinase (CRE) est sous le contrôle du promoteur du gène Runx1, spécifiquement exprimé par les précurseurs du sac vitellin (SV) dès 7 jdg (jours de gestation). Ce type de CRE est inactif à l’état basal et s’active seulement en présence de tamoxifène (injecté par voie intra-péritonéale chez la souris gestante) pendant 12 h à 24 h, le tamoxifène ne persistant que 12 h. Une fois activée, la CRE reconnaît et excise par recombinaison ses séquences cibles dites lox-P, ainsi que la séquence se trouvant entre ces sites, un stop transcriptionnel qui bloque en temps normal l’expression d’un gène rapporteur. Ainsi, ce système nous permet de suivre la contribution des précurseurs du SV aux différentes populations hématopoïétiques adultes en quantifiant l’expression du gène rapporteur dans ces dernières. ROSA, promoteur ubiquitaire. |
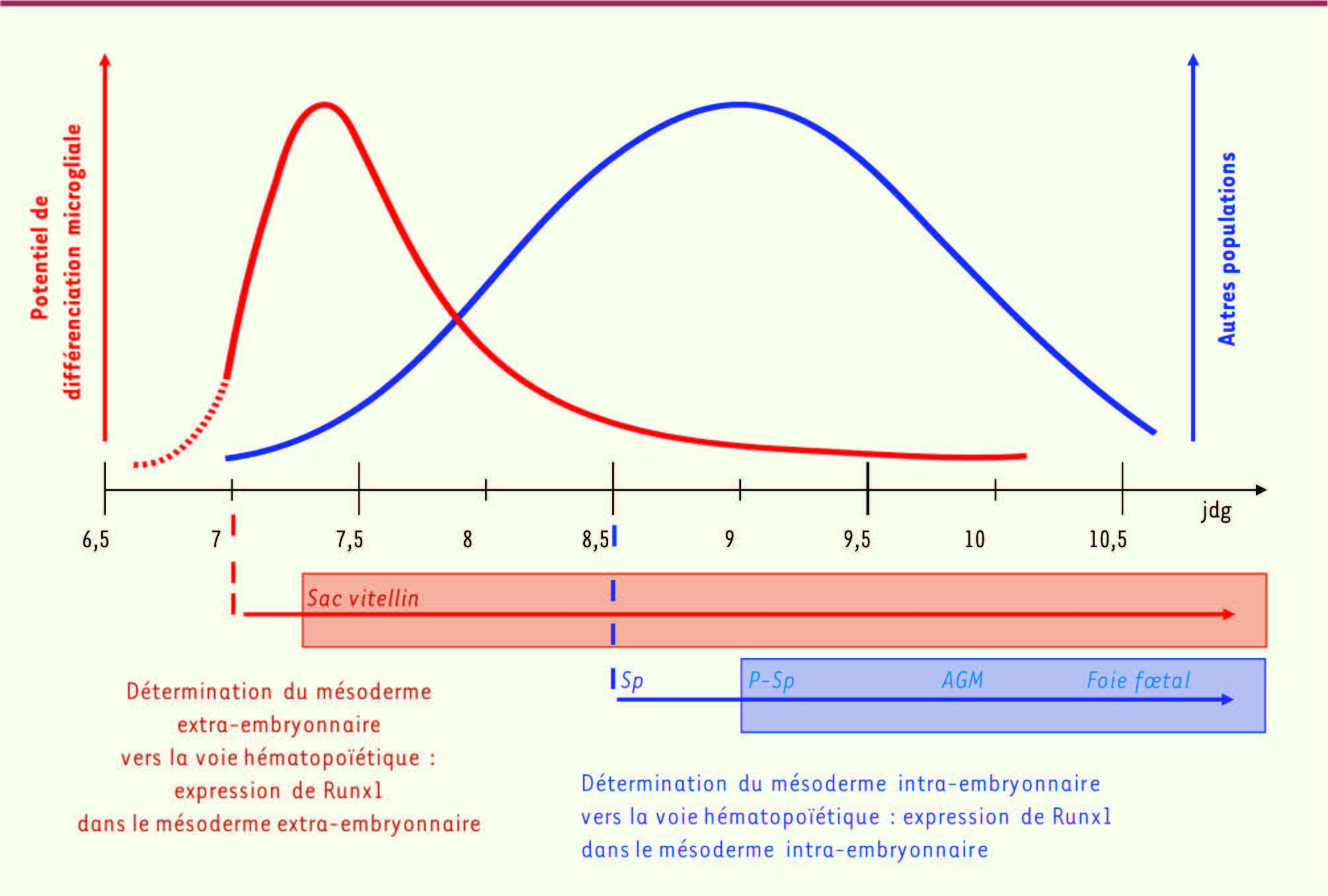
Le promoteur contrôlant l’expression de la CRE est le promoteur du gène Runx1. Runx1 (AML1 ou cbfa2) est un facteur de transcription exprimé principalement dans le système hématopoïétique, initialement au niveau du SV où il marque notamment les cellules hématopoïétiques primitives à partir de 7 jdg [11]. Plus tard, Runx1 est exprimé dans le compartiment intra-embryonnaire, notamment par les cellules souches hématopoïétiques des AGM, mais seulement à partir de 8,5 jdg (Figure 2). Ainsi, le traitement de la souris gestante par le tamoxifène entre 6,75 et 7,5 jdg permet de suivre spécifiquement la descendance des précurseurs primitifs du SV et non celle des précurseurs définitifs des AGM, alors que le traitement de la souris par le tamoxifène après 8 jdg permet de suivre la descendance des précurseurs primitifs et définitifs (Figure 1).
 | Figure 2.
Parallèle entre la cinétique et le site d’expression du gène Runx1 et le potentiel de différenciation des précurseurs hématopoïétiques. Les précurseurs expriment Runx1 à différents stades de développement, ce que détecte l’expression du gène rapporteur dans les diverses populations hématopoïétiques adultes testées après injection de tamoxifène aux différents stades de développement. Le facteur de transcription Runx1 est d’abord exprimé dans les cellules hématopoïétiques primitives du sac vitellin (SV) à partir de 7 jdg (jours de gestation), après la détermination du mésoderme extra-embryonnaire vers la voie hématopoïétique (rouge), puis dans les cellules souches hématopoïétiques de la région nommée splanchnopleure para-aortique (P-Sp) et des aorte-gonades-mésonéphros (AGM) à partir de 8,5 jdg, après la détermination du mésoderme intra-embryonnaire vers la voie hématopoïétique (bleu). De plus, dans le système d’étude de destin cellulaire, l’activation de la CRE est transitoire (de 12 h à 24 h), car le tamoxifène injecté chez la souris gestante ne persiste pas plus de 24 h. Ainsi, le traitement de la souris par le tamoxifène entre 6,75 et 7,5 jdg permet de suivre spécifiquement la descendance des précurseurs primitifs du SV et non celle des précurseurs définitifs des AGM, alors que le traitement de la souris par le tamoxifène après 8 jdg permet de suivre sans discrimination la descendance des précurseurs primitifs et définitifs. Lors d’une induction de la CRE à 7 ou 7,5 jdg, seules les cellules microgliales exprimaient le gène rapporteur, alors qu’aucune autre population hématopoïétique n’était marquée. Cependant, lors d’une induction de la CRE à un stade plus tardif (8,5 jdg), les cellules microgliales n’exprimaient pas le gène rapporteur, alors que toutes les autres populations hématopoïétiques étaient marquées. L’ensemble de ces résultats montre clairement que la microglie adulte ne dérive pas de progéniteurs de l’hématopoïèse définitive, mais exclusivement de progéniteurs de l’hématopoïèse primitive du SV. Les précurseurs du sac vitellin contribuent aux cellules de la microglie uniquement entre 7 et 8 jdg. |
Nous avons donc induit la CRE dans les embryons à différents stades de développement par injection intra-péritonéale de tamoxifène à la souris gestante et mesuré l’expression du gène rapporteur dans la microglie et les autres populations hématopoïétiques à l’âge adulte. Lors d’une induction de la CRE à 7 ou 7,5 jdg, nous avons observé que seules les cellules microgliales exprimaient le gène rapporteur, alors qu’aucune autre population hématopoïétique n’était marquée. Cependant, lors d’une induction de la CRE à un stade plus tardif (8,5 jdg), nous avons observé la situation inverse. Les cellules microgliales n’exprimaient pas le gène rapporteur, alors que toutes les autres populations hématopoïétiques étaient marquées (Figure 2). L’ensemble de ces résultats montre clairement que la microglie adulte ne dérive pas de progéniteurs de l’hématopoïèse définitive, mais exclusivement de progéniteurs de l’hématopoïèse primitive du SV. Il est important de noter toutefois que toutes les cellules microgliales n’expriment pas le gène rapporteur après une induction de la CRE à 7 ou 7,5 jdg. L’efficacité de recombinaison n’est que partielle (30 à 35 %). Cette absence de recombinaison totale est inhérente à ce type de stratégie permettant de suivre le destin cellulaire in vivo et est probablement liée à une expression insuffisante de la CRE ou à une distribution/disponibilité limitée du tamoxifène [10]. Nous pensons ainsi que ce modèle sous-estime la contribution des progéniteurs du SV exprimant Runx1, sans pouvoir non plus exclure formellement l’existence d’une source alternative de progéniteurs non marqués à ce même stade de développement. Toutefois, pour vérifier que le pourcentage de recombinaison détecté chez l’adulte reflète bien la contribution initiale des progéniteurs du SV, nous avons comparé le pourcentage de recombinaison après une induction de la CRE à 7 ou 7,5 jdg à celui détecté à des temps embryonnaires plus tardifs (10,5 jdg et 13,5 jdg) et chez l’adulte. Les pourcentages de recombinaison mesurés à ces différents temps sont similaires, ce qui réfute l’éventualité d’une contribution ultérieure par d’autres précurseurs non marqués. En effet, si d’autres précurseurs non marqués contribuaient ultérieurement à la microglie, le pourcentage de recombinaison mesuré chez l’adulte devrait être inférieur à celui mesuré initialement dans l’embryon (effet de dilution de la population initiale marquée), ce qui n’est pas le cas. |
Les progéniteurs du SV contribuent uniquement à la microglie chez la souris adulte Il est aussi important de noter que le potentiel de différenciation microgliale des précurseurs du SV est restreint dans le temps. En effet, bien que le SV présente une activité hématopoïétique jusqu’à 12,5 jdg, seuls les progéniteurs produits entre 7 et 8 jdg peuvent se différencier en cellules microgliales. Les raisons de cette spécificité restent à établir : elle pourrait être due soit à une propriété intrinsèque de ces précurseurs dont le programme de différenciation cellulaire spécifique serait restreint dans le temps, soit à la seule permissivité du cerveau présomptif, uniquement capable de recruter ces précurseurs du SV à ces temps précoces. Enfin, il semble bien que la microglie soit l’unique population de macrophages chez la souris adulte provenant des progéniteurs du SV. Aucune autre population de macrophages (poumon, foie, rate) ne présente une expression significative du gène rapporteur après une induction de la CRE à 7 ou 7,5 jdg. Ces résultats indiquent que la microglie possède une origine unique, indépendante de celle des autres populations de macrophages. Cependant, il est intéressant de noter que les macrophages primitifs qui dérivent des progéniteurs du SV migrent dans tout l’embryon lors de l’établissement de la circulation sanguine entre le SV et l’embryon à 8,5/9 jdg. En effet, après une induction de la CRE à 7 ou 7,5 jdg, nous pouvons détecter ces macrophages primitifs (exprimant un pourcentage de recombinaison analogue à celui des cellules du SV et des cellules microgliales) non seulement dans le cerveau présomptif, mais aussi dans tout l’embryon à 10,5 jdg et 13,5 jdg. Mais avec le temps, elles ne persistent que dans le seul SNC adulte. Cette spécificité du SNC pourrait être liée à la présence dans le cerveau présomptif de signaux spécifiques, seuls capables de maintenir ces progéniteurs ou, comme précédemment, à la non-permissivité du cerveau présomptif après 13,5 jdg, et donc à l’arrêt du recrutement des progéniteurs. Il reste ainsi à établir combien de temps ces macrophages primitifs survivent dans les tissus embryonnaires et néonataux autres que le cerveau présomptif et la nature de leur fonction. L’ensemble de ce travail révèle donc l’origine unique des cellules de la microglie, dérivant de précurseurs du SV. Ces résultats aussi justifient l’utilisation de précurseurs embryonnaires comme les cellules souches embryonnaires (ES) pour produire des cellules microgliales in vitro dans un but thérapeutique. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|