| |
| Med Sci (Paris). 2011 August; 27(8-9): 696–698. Published online 2011 August 31. doi: 10.1051/medsci/2011278006.
TIF1γ : un gène suppresseur de tumeur dans la leucémie myélomonocytaire chronique Romain Aucagne,1,2 Nathalie Droin,3 Éric Solary,3 Jean-Noël Bastie,1 and Laurent Delva1* 1Inserm UMR 866, Faculté de médecine, Université de Bourgogne, 21000Dijon, France 2Laboratoire de génétique moléculaire des cellules souches, IRIC, Université de Montréal, Montréal H3C3J7, Québec, Canada 3Inserm UMR 1009, Institut Gustave Roussy, 94805Villejuif, France MeSH keywords: Animaux, Moelle osseuse, anatomopathologie, Lignée cellulaire, Transformation cellulaire néoplasique, génétique, Méthylation de l'ADN, Modèles animaux de maladie humaine, Délétion de gène, Gènes suppresseurs de tumeur, Hématopoïèse, Cellules souches hématopoïétiques, métabolisme, Humains, Leucémie myélomonocytaire chronique, traitement médicamenteux, Souris, Modèles génétiques, Thérapie moléculaire ciblée, Cellules souches tumorales, Facteurs de transcription, déficit, physiologie, Transcription génétique |
Le cofacteur transcriptionnel TIF1γ TIF1γ (transcription intermediary factor 1 gamma) appartient à la famille des corégulateurs transcriptionnels TIF1. Son rôle est majeur au cours de l’embryogenèse puisque sa délétion génique est létale [
1,
2]. Chez le poisson zèbre, une mutation du gène tif1γ perturbe spécifiquement l’hématopoïèse embryonnaire et adulte [
3,
4]. Différentes fonctions de TIF1γ ont été décrites également au cours de l’hématopoïèse, tant chez la souris que chez l’homme. Il agit positivement sur la différenciation érythroïde humaine [
5], module l’élongation pendant la transcription des gènes érythroïdes [
6] et réprime l’activité transcriptionnelle de Scl (stem cell leukemia)/Tal-1 (T-cell acute lymphocytic leukemia-1) et de Spi-1 (spleen focus forming virus proviral integration site-1)/Pu.1 (purine rich box.1) [
7,
13]. Afin d’étudier le rôle de Tif1γ dans l’hématopoïèse murine adulte, nous avons généré des souris nullizygotes conditionnelles c-FES (cellular-feline sarcoma oncogene)-cre (cyclization recombinase)/Tif1γ (Tif1γΔ/Δ) dans lesquelles ce gène est spécifiquement inactivé dans les cellules hématopoïétiques [
8]. |
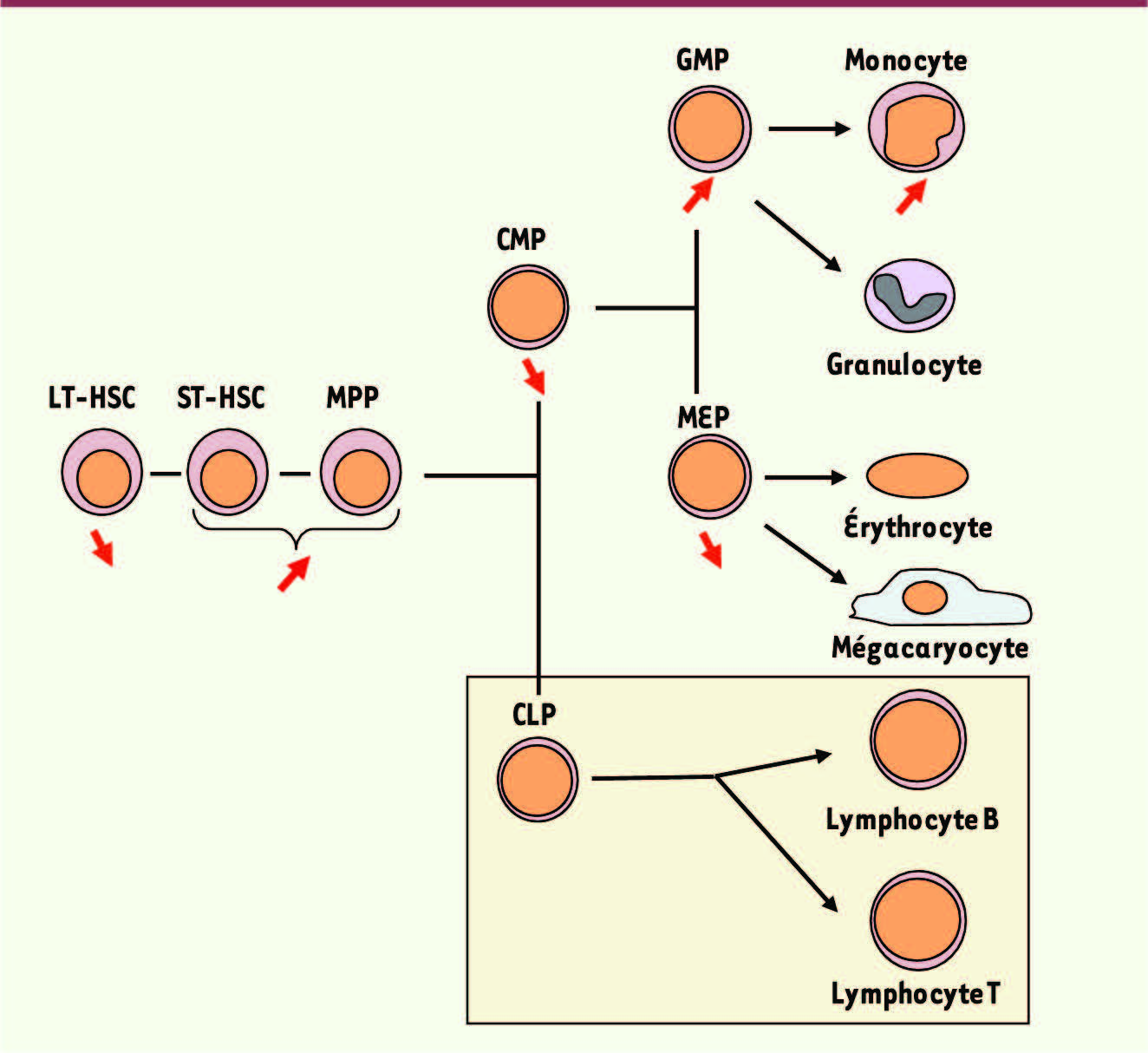
Délétion conditionnelle de Tif1 γ dans les lignées hématopoïétiques chez la souris L’analyse de l’hématopoïèse de ces souris c-FES-cre/Tif1γ (Tif1γΔ/Δ) montre une altération profonde de la répartition des cellules immatures de la moelle : le nombre de LT-HSC (long-term hematopoietic stem cell) est diminué, les nombres de ST-HSC (short-term hematopoietic stem cell) et de MPP (multipotent progenitor) sont augmentés. En aval, on note une baisse du nombre de CMP (common myeloid progenitor) et une expansion sélective du compartiment des GMP (granulocyte-monocyte progenitor) aux dépens des MEP (megakaryocyte-erythroid progenitor) [8] (Figure 1). À partir de l’âge de 6 mois, les souris Tif1γΔ/Δ présentent une hypercellularité médullaire due à une hyperplasie monocytaire, et une splénomégalie, parfois accompagnée d’une hépatomégalie, résultant d’une infiltration de cellules myéloïdes proliférant activement. Ces caractéristiques miment ce qui est observé dans la leucémie myélomonocytaire chronique (LMMC) humaine.
 | Figure 1
Représentation schématique de la différenciation hématopoïétique dans les souris nullizygotes conditionnelles pour Tif1 γ dans la moelle osseuse. Au niveau du compartiment des cellules souches hématopoïétiques, le nombre de LT-HSC décroît alors que les nombres de ST-HSC et de MPP augmentent fortement. Une baisse du nombre de CMP et une expansion sélective du compartiment des GMP aux dépens des MEP sont observées. Le nombre de lymphocytes ne varie pas. La distribution des CLP n’a pas été évaluée. LT-HSC : long-term hematopoietic stem cell; ST-HSC : short-term hematopoietic stem cell; MPP : multipotent progenitor; CMP : common myeloid progenitor; GMP : granulocyte-monocyte progenitor; MEP : megakaryocyte-erythroid progenitor; CLP : common lymphoid progenitor. |
|
La leucémie myélomonocytaire chronique (LMMC) La LMMC est une pathologie clonale de la cellule souche hématopoïétique conduisant à une prolifération de monocytes qui s’accumulent dans la moelle, le sang et la rate, et provoquent une inhibition progressive de l’hématopoïèse normale. Elle est classée par l’organisation mondiale de la santé dans la catégorie des syndromes myélodysplasiques/myéloprolifératifs. Une anomalie cytogénétique clonale est retrouvée dans les cellules de 40 % des patients, mais aucune n’est spécifique de la maladie. La fréquence des disomies uniparentales a révélé un certain nombre de mutations somatiques dans le clone leucémique. Les plus fréquentes (30 à 60 % des patients) concernent les gènes TET2 (tet oncogene family member 2) [
9], RUNX1 (runt-related transcription factor 1) et ASXL1 (additional sex combs like 1). Des mutations des gènes RAS (rat sarcoma viral oncogene) et C-CBL (Casitas B-lineage lymphoma) sont moins fréquentes (10 à 30 %), celles de JAK2 (Janus kinase 2), FLT3 (FMS-like tyrosine kinase 3), IDH1 (isocitrate dehydrogenase 1), IDH2, EZH2 (enhancer of zeste homolog 2), UTX (ubiquitously transcribed tetratricopeptide repeat, X chromosome), DNMT3A (DNA méthyltransferase 3A) et certains acteurs moléculaires de la voie NOTCH sont beaucoup plus rares (< 10 %). De multiples combinaisons sont possibles, mais il est encore impossible de distinguer les mutations initiales oncogéniques des mutations secondaires responsables de l’évolution clonale. |
TIF1 γ chez les patients atteints d’une LMMC Du fait de la grande similitude des proliférations myélomonocytaires observées chez les souris Tif1γΔ/Δ et dans la LMMC, nous avons cherché des mutations de ce gène dans la pathologie humaine. Nous n’avons identifié aucune mutation somatique de la séquence codante de TIF1γ dans des monocytes de 66 patients atteints de LMMC. Cependant, l’expression de TIF1γ est extrêmement faible, voire le plus souvent indétectable, dans les cellules de 35 % de ces patients [8]. En outre, dans une cohorte de patients sélectionnés sur des critères de gravité, cette proportion atteint 50 %. La très faible expression de TIF1γ ou même son absence, représente donc, avec les mutations de TET2, une des anomalies génétiques les plus fréquentes dans la LMMC. Nous avons démontré que la diminution de l’expression de TIF1γ était liée à l’hyperméthylation des CpG de son promoteur à la différence de ce qui est observé dans les monocytes de sujets sains. Des altérations de la méthylation de l’ADN au niveau de promoteurs de plusieurs gènes avaient déjà été identifiées dans des syndromes myélodysplasiques, ce qui pouvait partiellement expliquer l’efficacité des agents dits hypométhylants comme l’azacytidine et la décitabine qui inhibent les ADN méthyltransférases (DNMT) dans ces hémopathies [
10] (→). La décitabine induit une réponse clinique et biologique dans 40 % des LMMC de haut grade [
11]. Lors de ce traitement, nous avons mis en évidence une restauration de l’expression normale de TIF1γ aussi bien in vitro qu’in vivo chez les répondeurs [8]. La normalisation de cette expression pourrait donc être utilisée comme un biomarqueur de la réponse à la décitabine. Néanmoins, le niveau de méthylation du promoteur de ce gène n’est pas prédictif de la survie sous traitement, ce qui suggère que d’autres effets du médicament sont en cause dans les réponses thérapeutiques observées. (→) Voir l’article de H. Chaib et al., page 725 de ce numéro |
Hypothèse d’une dérégulation génétique et épigénétique en cascade dans les LMMC La méthylation du promoteur du gène TIF1γ pourrait être associée à celle de plusieurs autres gènes comme p15 et les séquences LINE-1 (long interspersed nuclear element-1), traduisant un mécanisme plus global de dérégulation épigénétique et permettant de distinguer deux catégories de patients ayant des phénotypes de méthylation distincts. Dans ce cas, l’hyperméthylation du promoteur de TIF1γ pourrait être liée aux mutations du gène TET2, dont le produit régule la méthylation de l’ADN, et aux mutations d’IDH1 ou d’IDH2, deux enzymes qui, lorsqu’elles sont mutées, ne produisent plus l’α-cétoglutarate nécessaire au fonctionnement de TET2. La compréhension des liens entre ces différentes mutations devrait aider à définir les meilleures conditions d’utilisation des agents déméthylants, seuls ou en association avec d’autres agents ciblant les modifications de la structure chromatinienne comme les inhibiteurs de HDAC (histone désacétylase) [
12]. D’une manière plus générale, la LMMC, maladie rare du sujet âgé longtemps assimilée à un syndrome myélodysplasique, devient une entité indépendante pour laquelle les critères du choix thérapeutique, comme ceux de la réponse au traitement, doivent être revus à la lumière de ces découvertes récentes. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Kim
J
,
Kaartinen
V
. Generation of mice with a conditional allele for Trim33 . Genesis.
2008; ; 46 : :329.-333. 2.
Morsut
L
,
Yan
KP
,
Enzo
E
, et al.
Negative control of Smad activity by ectodermin/Tif1gamma patterns the mammalian embryo . Development.
2010; ; 137 : :2571.-2578. 3.
Ransom
DG
,
Bahary
N
,
Niss
K
, et al.
The zebrafish moonshine gene encodes transcriptional intermediary factor 1gamma, an essential regulator of hematopoiesis . PLoS Biol.
2004; ; 2 : :E237.. 4.
Monteiro
R
,
Pouget
C
,
Patient
R
. The gata1/pu.1 lineage fate paradigm varies between blood populations and is modulated by tif1gamma . EMBO J.
2011; ; 30 : :1093.-1103. 5.
He
W
,
Dorn
DC
,
Erdjument-Bromage
H
, et al.
Hematopoiesis controlled by distinct TIF1gamma and Smad4 branches of the TGFbeta pathway . Cell.
2006; ; 125 : :929.-941. 6.
Bai
X
,
Kim
J
,
Yang
Z
, et al.
TIF1gamma controls erythroid cell fate by regulating transcription elongation . Cell.
2010; ; 142 : :133.-143. 7.
Kusy
S
,
Gault
N
,
Ferri
F
, et al.
Adult hematopoiesis is regulated by TIF1gamma, a repressor of TAL1 and PU.1 transcriptional activity . Cell Stem Cell.
2011; ; 8 : :412.-425. 8.
Aucagne
R
,
Droin
N
,
Paggetti
J
, et al.
Transcription intermediary factor 1gamma is a tumor suppressor in mouse and human chronic myelomonocytic leukemia . J Clin Invest.
2011; ; 121 : :2361.-2370. 9.
Kosmider
O
,
Gelsi-Boyer
V
,
Ciudad
M
, et al.
TET2 gene mutation is a frequent and adverse event in chronic myelomonocytic leukemia . Haematologica.
2009; ; 94 : :1676.-1681. 10.
Chaib
H
,
Collette
Y
,
Prébet
T
,
Vey
N
. Histone méthyltransférases : une nouvelle classe de cibles thérapeutiques dans le traitement du cancer ?
Med Sci (Paris).
2011; ; 27 : :725.-732. 11.
Kantarjian
H
,
Oki
Y
,
Garcia-Manero
G
, et al.
Results of a randomized study of 3 schedules of low-dose decitabine in higher-risk myelodysplastic syndrome and chronic myelomonocytic leukemia . Blood.
2007; ; 109 : :52.-57. 12.
Mottet
D
,
Castronovo
V
. Les histone désacétylases : nouvelles cibles pour les thérapies anticancéreuses . Med Sci (Paris).
2008; ; 24 : :742.-746. 13.
Kusy
S
,
Roméo
PH
. Quand TIF1γ devient chef d’orchestre de l’hématopoïèse adulte . Med Sci (Paris).
2011; ; 27 : :698.-700. |