| |
| Med Sci (Paris). 2011 August; 27(8-9): 687–689. Published online 2011 August 31. doi: 10.1051/medsci/2011278002.Olfaction : quand le cortex redistribue les cartes Gabriel Lepousez1* and Gilles Gheusi1 1Laboratoire Perception et Mémoire, Institut Pasteur, 25-28, rue du Docteur Roux, 75015Paris, France MeSH keywords: Amygdale (système limbique), physiologie, Transport axonal, Cartographie cérébrale, méthodes, Cortex entorhinal, Humains, Terminaisons nerveuses, ultrastructure, Neurones, classification, Odorisants, Bulbe olfactif, cytologie, Muqueuse olfactive, Voies olfactives, Neurorécepteurs olfactifs, Odorat |
Comprendre les voies de connexions au sein d’un système sensoriel est indispensable pour formuler des hypothèses fonctionnelles sur la logique de la perception ou encore pour faciliter le développement de systèmes artificiels de détection bio-inspirés. Le prix Nobel récompensait en 1906 S. Ramon y Cajal et C. Golgi pour leurs travaux révélant les premières descriptions de l’agencement des réseaux de neurones du cerveau. Trois récentes publications dans la revue Nature [
1–
3] rendent hommage aux deux neuroanatomistes en apportant des données originales et capitales sur l’organisation de la connectivité du système olfactif. |
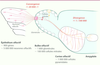
Comment le nez se connecte au cerveau : une histoire de cartes L’information olfactive prend naissance au sein des millions de neurones sensoriels de l’épithélium olfactif. Ces neurones olfactifs expriment un parmi les quelque 900 différents gènes codant pour un récepteur olfactif. Chaque récepteur olfactif est activé par une famille de molécules volatiles proches. Lorsque des récepteurs détectent une molécule odorante, les neurones olfactifs portant ces récepteurs sont activés et transmettent le signal à un premier relais cérébral, le bulbe olfactif, au niveau de structures appelées glomérules (Figure 1).
 | Figure 1
Organisation synaptique du système olfactif. Chacun des millions de neurones olfactifs présents dans l’épithélium olfactif exprime un seul des quelque 900 gènes codant pour les récepteurs olfactifs. Les neurones olfactifs exprimant le même récepteur convergent dans le bulbe olfactif vers un glomérule précis pour transmettre l’information aux cellules mitrales appartenant à ce glomérule, selon un ratio de convergence d’environ 20 000 neurones olfactifs pour une cellule mitrale. Ces cellules mitrales vont ensuite innerver les cellules pyramidales qui composent le cortex olfactif, selon un ratio de divergence d’une cellule mitrale pour environ 100 000 cellules pyramidales. Deux cellules mitrales appartenant à un même glomérule (ici, le glomérule rouge) vont innerver des territoires corticaux aussi différents que deux cellules mitrales issues de glomérules distincts (jaune et rouge). L’amygdale, elle, est davantage innervée par les glomérules dorsaux du bulbe olfactif. |
La connectivité entre l’épithélium et le bulbe olfactif suit une règle simple : dispersés de façon relativement homogène au niveau de l’épithélium, les neurones olfactifs exprimant le même récepteur convergent vers un même glomérule dont la position spatiale est remarquablement précise et stéréotypée [
4]. Ainsi, la détection d’une odeur par une combinaison unique de récepteurs au niveau de l’épithélium se traduit à la surface du bulbe par une carte spatiale d’activation glomérulaire, spécifique d’une odeur et comparable d’un individu à l’autre. En d’autres termes, l’observation des cartes spatiales d’activation bulbaire permet de prédire quels sont les récepteurs activés et, par là même, l’odeur détectée. Les principes d’organisation d’une telle connectivité reposent sur l’existence de processus complexes d’adressage et de guidage axonal qui définissent le caractère odotopique de la représentation des odeurs dans le bulbe (on parle d’odotopie pour l’olfaction, comme on parle de rétinotopie pour la vision) [
5]. À l’instar des autres systèmes sensoriels - vision [
6], audition ou toucher -, le codage des informations olfactives repose sur des cartes sensorielles au niveau du bulbe. Dans les autres systèmes sensoriels, ces cartes sont relativement bien conservées au niveau des cortex sensoriels correspondants. Qu’en est-il vraiment des projections des cartes olfactives bulbaires au sein du cortex olfactif ? Les trois récentes publications de Nature répondent à cette question et montrent que le système olfactif se distingue des autres sens par la manière dont sont distribuées les cartes au sein du cortex olfactif. |
Projection des cartes olfactives dans le cortex olfactif Comment tracer les projections vers le cortex olfactif ? L’information olfactive qui converge au niveau des glomérules est transmise aux cellules mitrales, cellules principales du bulbe olfactif, qui projettent directement vers le cortex olfactif. La longueur de ces projections (jusqu’à 4-5 mm chez la souris) et les limites des techniques de traçage avaient jusqu’à ce jour limité les connaissances sur le tracé restreint emprunté par les axones des cellules mitrales depuis les glomérules jusqu’au cortex olfactif. Les groupes de L. Luo, K. Baldwin et S. Datta ont, chacun à leur manière, surmonté ces obstacles pour nous offrir une vision plus précise des projections du bulbe vers le cortex olfactif. Deux des trois équipes se sont appuyées sur une technique de traçage antérograde permettant de marquer une ou plusieurs cellules mitrales localisées dans un même glomérule, et, dès lors, de suivre et de visualiser l’organisation des terminaisons axonales de ces cellules mitrales dans le cortex olfactif. Quant au troisième groupe, il a choisi de suivre le trajet inverse en utilisant une technique récente de marquage transsynaptique rétrograde [
7]. L’opération consiste à identifier et infecter une cellule du cortex olfactif par un vecteur modifié dérivé du virus de la rage. Après réplication, la particule virale est transportée jusque dans les dendrites et traverse les espaces synaptiques pour envahir les partenaires présynaptiques de la cellule infectée. Différentes modifications génétiques du virus utilisé permettent : (1) l’expression d’une protéine fluorescente pour visualiser l’ensemble des neurones présynaptiques ; (2) le blocage de tout nouveau passage transsynaptique secondaire restreignant ainsi la présence du virus aux seules cellules présynaptiques. De fait, un traçage transsynaptique rétrograde de ce type a conduit les auteurs jusqu’à la source des cellules corticales infectées, c’est-à-dire jusqu’aux glomérules et aux cellules mitrales à l’origine des projections corticales. Avec des stratégies différentes, ces trois études ont conduit aux mêmes conclusions. Elles confirment tout d’abord que les cellules principales du bulbe olfactif innervent les différentes structures qui composent le cortex olfactif, en priorité le cortex piriforme, le cortex olfactif accessoire et le tubercule olfactif, et, dans une moindre mesure, l’amygdale et le cortex entorhinal. En outre, les auteurs montrent que l’organisation des terminaisons axonales des cellules mitrales dans le cortex olfactif est largement distribuée et ne donne pas lieu à des projections spatialement organisées (odotopiques) au sein du cortex olfactif. Chaque cellule corticale est ainsi la cible d’afférences en provenance de nombreux glomérules indépendamment de leur position dans le bulbe olfactif, et chaque cellule principale du bulbe olfactif innerve un nombre important de cellules largement distribuées dans le cortex (Figure 1). Quelles conséquences pour le codage de l’information olfactive ? Ces trois études offrent de nouvelles hypothèses quant au traitement de l’information dans le cortex olfactif. En premier lieu, la distribution aléatoire des projections depuis le bulbe vers le cortex suggère un codage combinatoire de l’information olfactive des nombreux glomérules par les cellules corticales. À la différence du bulbe olfactif qui représente l’information en une combinaison unique d’activations glomérulaires, le cortex olfactif semble intégrer ces informations spatiales pour en élaborer une synthèse. La plupart des odeurs que nous percevons sont composées de plusieurs molécules odorantes (près de 600 pour l’odeur du chocolat par exemple). La perception d’une seule odeur, d’un seul « objet olfactif » repose sur l’intégration de l’activation des glomérules olfactifs activés par les différentes molécules odorantes qui composent cette odeur, un processus qui s’effectuerait au niveau du cortex olfactif. Des enregistrements de l’activité des neurones dans le cortex olfactif confirment qu’une même cellule corticale peut être activée par plusieurs odeurs parfois très différentes [
8]. En second lieu, il apparaît que deux cellules mitrales d’un même glomérule ont pour cible des territoires corticaux aussi distants que deux cellules mitrales émanant de glomérules distincts (Figure 1). Ce niveau extrême de dispersion suggère des territoires de projection corticale des cellules principales bulbaires propres à chaque individu. De tels résultats soulèvent d’importantes questions : comment une même odeur peut-elle être perçue de manière identique par différents individus ? Comment l’expérience de chacun participe-t-elle à la construction des représentations olfactives supportées par des projections aléatoires ? Au cours du développement, quelles règles et quels processus moléculaires guident les projections glomérulaires vers le cortex ? Enfin, à l’inverse des projections bulbaires vers le cortex olfactif, une relative ségrégation des terminaisons glomérulaires est observée au niveau de l’amygdale, une structure déterminante dans l’expression de la peur. L’amygdale reçoit préférentiellement des projections en provenance de glomérules localisés dans la partie dorsale du bulbe. Ces glomérules dorsaux partagent la caractéristique de répondre à des odeurs qui suscitent des comportements d’évitement, comme l’odeur de prédateur ou de nourriture avariée [
9]. Si la précision d’un tel câblage au niveau de l’amygdale contraste avec la dispersion et le caractère combinatoire des projections corticales, elle trouve un certain sens sur le plan adaptatif en raison de la forte valeur de survie des réponses comportementales aux odeurs signalant un danger. De manière intéressante, des schémas de connectivité semblables existent dans le système olfactif de la drosophile, où les réponses comportementales apprises et non apprises à des odeurs reposent sur des réseaux de projection respectivement aléatoires et ségrégés. Encore une belle confirmation de l’unité du Vivant. ‡ |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Ghosh
S
,
Larson
SD
,
Hefzi
H
, et al.
Sensory maps in the olfactory cortex defined by long-range viral tracing of single neurons . Nature.
2011; ; 472 : :217.-220. 2.
Miyamichi
K
,
Amat
F
,
Moussavi
F
, et al.
Cortical representations of olfactory input by trans-synaptic tracing . Nature.
2011; ; 472 : :191.-196. 3.
Sosulski
DL
,
Bloom
ML
,
Cutforth
T
, et al.
Distinct representations of olfactory information in different cortical centres . Nature.
2011; ; 472 : :213.-216. 4.
Mombaerts
P
,
Wang
F
,
Dulac
C
, et al.
Visualizing an olfactory sensory map . Cell.
1996; ; 87 : :675.-686. 5.
Sakano
H
. Neural map formation in the mouse olfactory system . Neuron.
2010; ; 67 : :530.-542. 6.
Rochefort
N
. Organisation dendritique et caractéristiques fonctionnelles des afférences visuelles sur les neurones corticaux . Med Sci (Paris).
2010; ; 26 : :1009.-1012. 7.
Callaway
EM
. Transneural circuit tracing with neurotropic viruses . Curr Opin Neurobiol.
2008; ; 18 : :617.-623. 8.
Poo
C
,
Isaacson
JS
. Odor representations in olfactory cortex : ‘sparse’ coding, global inhibition and oscillations . Neuron.
2009; ; 62 : :850.-861. 9.
Kobayakawa
K
,
Kobayakawa
R
,
Matsumoto
H
, et al.
Innate versus learned odour processing in the mouse olfactory bulb .
Nature
.
2007; ; 450 : :503.-508. |