| |
| Med Sci (Paris). 2011 December; 27(12): 1106–1111. Published online 2011 December 23. doi: 10.1051/medsci/20112712017.La famille des protéine phosphatases PP2A Une cible stratégique pour les virus et pour la transformation tumorale Angélique N. Godet,1 Julien Guergnon,1,2** Amandine Galioot,1 Pierre-Barthélémy Falanga,1 Jean-Hervé Colle,3*** Xavier Cayla,4**** and Alphonse Garcia1* 1Laboratoire E3 phosphatases, unité signalisation moléculaire et activation cellulaire (SMAC), Institut Pasteur, 25, rue du Docteur Roux, 75015Paris, France 2Inserm UMR-S 945, Laboratoire infection et immunité, Université Pierre et Marie Curie, 91, boulevard de l’Hôpital, 75013Paris, France 3Unité de biologie des populations lymphocytaires, Institut Pasteur, 25, rue du Docteur Roux, 75015Paris, France 4Neurobiologie intégrative de la reproduction, UMR 6175 Inra-CNRS-Université de Tours-Haras nationaux, centre Inra de Tours, PRC, 37380Nouzilly, France |
La phosphorylation des protéines - un processus dynamique et réversible qui résulte de l’action coordonnée et antagoniste des enzymes qui phosphorylent - les protéine kinases - et qui déphosphorylent - les protéine phosphatases - représente un mécanisme clé pour la régulation de nombreuses voies de signalisation cellulaires. Environ 30 % des protéines sont phosphorylées sur les résidus d’acides aminés sérine/thréonine (ser/thr) par de nombreuses ser/thr kinases qui sont elles-mêmes spécifiquement régulées. La déphosphorylation des résidus ser/thr requiert un nombre restreint de sous-unités catalytiques de ser/thr phosphatases qui sont en revanche capables d’interagir avec une multitude de sous-unités régulatrices d’origine cellulaire ou virale, ce qui permet de générer une diversité d’holoenzymes. Au cours de la dernière décennie, différents travaux ont permis de mieux appréhender la régulation structurale et fonctionnelle des PP2A. Dans ce contexte, le ciblage des protéines PP2A par les protéines virales permet une meilleure compréhension des mécanismes de transformation cellulaire et pourrait offrir des pistes pour développer de nouvelles approches thérapeutiques contre le cancer. |
Structure et régulation des holoenzymes de PP2A La famille des phosphatases PP2A regroupe plusieurs holoenzymes qui jouent un rôle critique dans plusieurs processus cellulaires fondamentaux dont la régulation de la transcription, le contrôle du cycle cellulaire et du cytosquelette, de la survie cellulaire et du processus de transformation tumorale [
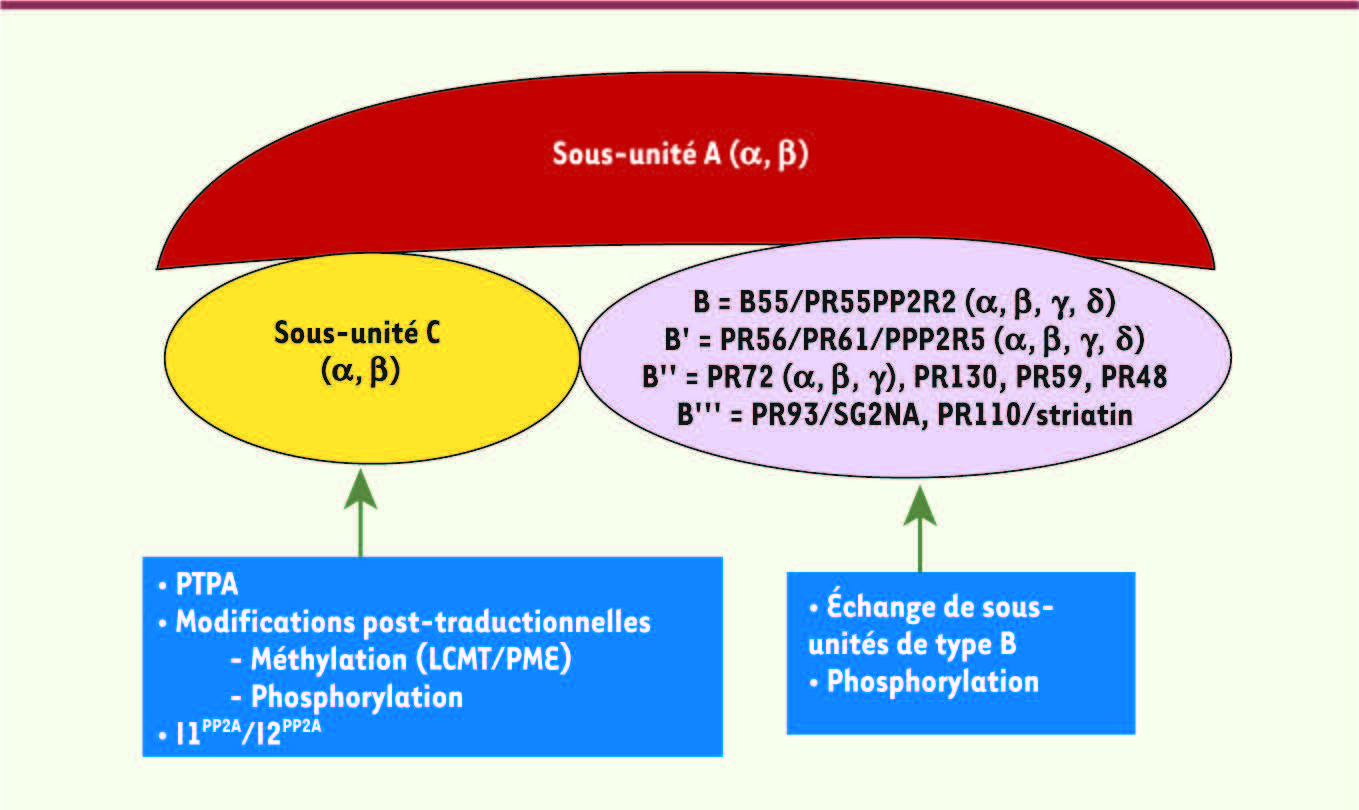
1]. Dans cette famille d’enzymes, les sous-unités catalytique (C) et structurale (A) sont liées de façon constitutive. L’hétérodimère AC qui est aussi appelé le « core » est capable de s’associer à diverses sous-unités régulatrices de type B (B) et de former une enzyme fonctionnelle. La combinaison du core AC avec les différentes sous-unités de type B engendre un répertoire de nombreux holoenzymes qui est déterminant pour la spécificité et pour la régulation de l’activité de type 2A (Figure 1) [
2]. Outre les sous-unités variables de type B, un nombre croissant de protéines cellulaires peut interagir avec une ou plusieurs sous-unités de PP2A pour s’associer à un holoenzyme spécifique. Plus de cinquante partenaires cellulaires ont ainsi été identifiés comme formant des complexes stables avec PP2A - des protéine kinases, des protéines du cytosquelette, des récepteurs et des facteurs de transcription - pour contrôler les principales voies de signalisation intracellulaire (Hox, Wnt, Ras, etc.) [
3].
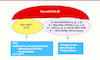 | Figure 1.
Structure des holoenzymes de PP2A. La famille des PP2A est constituée de plusieurs holoenzymes différentes. La sous-unité catalytique PP2A C, qui n’a jamais été retrouvée de façon isolée, est habituellement associée à la sous-unité structurale A ou, alternativement, à la protéine Tap42/α4. Les sous-unités A et C sont exprimées de manière constitutive alors que les sous-unités variables de type B (B/B'/B''/B''') inductibles sont impliquées dans la localisation subcellulaire de l’enzyme. Des modifications post-traductionnelles telles que la phosphorylation et la méthylation des sous-unités catalytiques peuvent aussi moduler l’activité des PP2A dans la cellule. En particulier, la méthylation réversible, résultant de l’action coordonnée et antagoniste d’une leucine carboxyl méthyltransférase (LCMT) et d’une phosphatase méthylestérase (PME-1) spécifiques de PP2A C, régule la liaison des sous-unités variables de type B. De plus, la liaison de PTPA par le complexe inactif PP2A-PME-1 induit un changement conformationnel qui conduit à la formation d’un holoenzyme trimérique [ 1]. |
|
Des protéines codées par différents virus peuvent s’associer à PP2A pour déréguler les signaux de survie cellulaires Les diverses protéines virales qui sont répertoriées dans le
Tableau I
(voir aussi [
4–
16]) peuvent s’associer à des protéines PP2A et former des complexes fonctionnels plurimoléculaires capables de détourner la signalisation cellulaire en provoquant soit l’inhibition de PP2A, ce qui en général active la survie de l’hôte infecté, soit son activation, ce qui induit l’apoptose de l’hôte. Par exemple, les virus transformants à ADN de la famille des papovae codent pour des protéines comme la protéine transformante moyen T du virus polyome et les antigènes petit t des virus polyome ou SV40. Ces protéines virales sont capables de se substituer à certaines sous-unités régulatrices de type B pour interagir directement avec le core AC afin de réguler la réplication virale et la transformation cellulaire [
13,
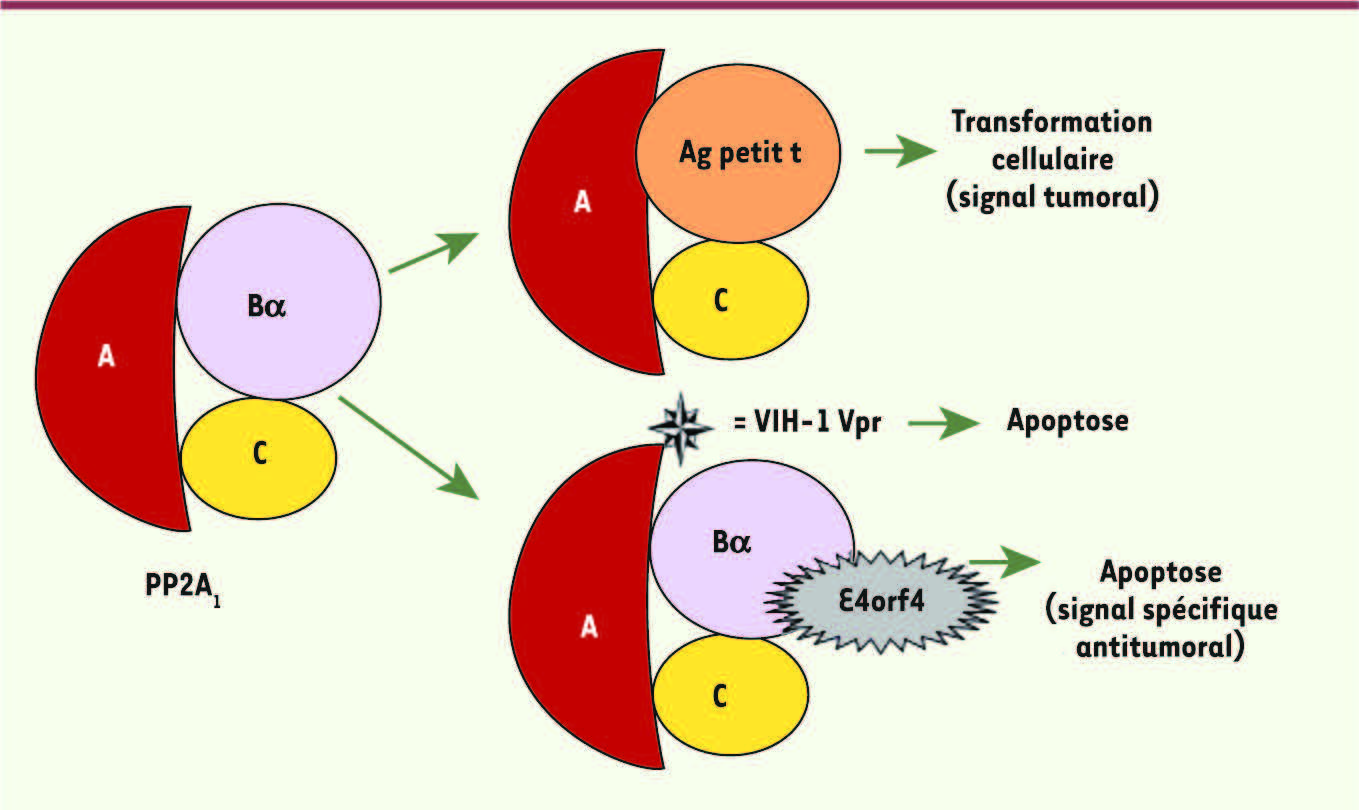
14]. Alternativement, et en contraste avec les antigènes de papovae, la protéine adénovirale E4orf4 se lie avec la sous-unité Bα de l’holoenzyme trimérique ABαC appelée PP2A1 pour induire l’apoptose des cellules transformées ou infectées par les adénovirus (Figure 2) [4]. Par ailleurs, nous avons récemment montré que la séquence carboxy-terminale de la protéine Vpr du VIH (virus de l’immunodéficience humaine), qui lie la sous-unité A de l’holoenzyme PP2A1, est un nouveau domaine biologiquement actif permettant de faire pénétrer la protéine Vpr entière et d’induire l’apoptose de différents types cellulaires [
10].
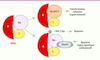 | Figure 2.
La protéine phosphatase PP2A1 : une cible des protéines virales. L’holoenzyme trimérique PP2A 1 est une cible élective de certaines protéines virales contenant une centaine d’acides aminés. Ces petites protéines virales sont, grâce leur association avec PP2A 1, capables de fournir des signaux de prolifération cellulaire ou d’entrée en apoptose. Par exemple, les protéines transformantes, moyen T et petit t des virus polyome ou petit t de SV40, peuvent former des complexes trimériques actifs avec le core AC, en se substituant à la sous-unité régulatrice Bα [ 14]. De façon différente, la protéine virale E4orf4 induit l’apoptose des cellules transformées ou infectées par les adénovirus, grâce à sa liaison avec la sous-unité Bα de l’holoenzyme PP2A 1 [ 4], alors que la protéine Vpr du VIH-1 interagit avec la sous-unité A de PP2A 1 pour induire une apoptose de différentes cellules [ 10]. |
Tableau I.
|
Virus
|
Protéine
|
Effets biologiques
|
Réf.
|
| Adénovirus |
E4orf4 |
Se lie à la sous-unité Bα de PP2A1
|
[4] |
|
|
Le complexe E4orf4-PP2A est requis pour induire l’apoptose |
|
| BKV |
Antigène petit t |
Se lie aux sous-unités A et C |
[
5] |
|
|
Rôle potentiel dans l’oncogenèse |
|
| EBV |
EBNA-LP |
La forme tronquée EBNA-LP interagit avec PP2Ac pour inhiber l’apoptose |
[
6] |
|
|
Rôle potentiel dans la persistance de l’EBV |
|
| JCV |
Agnoprotéine |
Se lie à PP2Ac |
[
7] |
|
|
Coprécipite avec l’antigène petit t et PP2A |
|
| JCV |
Antigène petit t |
Se lie au dimère AC |
[
8] |
|
|
Coprécipite avec PP2Ac et l’agnoprotéine et inhibe sa déphosphorylation par PP2A |
|
| VHC |
NS5A |
Se lie au dimère A/C et stimule l’activité PP2A pour inhiber la signalisation de l’IFN-α |
[
9] |
|
| VIH-1 |
Vpr |
Se lie à la sous-unité A de l’holoenzyme PP2A1
|
[10] |
|
|
Régule l’arrêt du cycle et l’apoptose |
|
| HPV |
E7 |
Se lie au dimère A/C et inhibe la déphosphorylation d’Akt/PKB, ce qui active la voie de survie PI3K/AKT |
[
11] |
|
| MCV |
Antigène petit t |
La liaison à PP2A favorise la replication |
[
12] |
|
| Polyoma |
Antigène moyen t |
Se lie au dimère A/C |
[13] |
|
|
Stimule l’activité tyrosine phosphatase de PP2A et favorise la transformation |
|
| Polyoma |
Antigène petit t |
Se lie au dimère A/C |
[14] |
|
|
Active c-src et PI3K ce qui favorise la transformation |
|
| SV40 |
Antigène petit t |
Se lie au dimère A/C et déplace des sous-unités B |
[13, 14] |
|
|
Inhibe l’activité PP2A |
|
| HTLV-1 |
Tax |
Le transactivateur Tax est associé dans un complexe tripartite avec IKKγ pour inhiber PP2A et maintenir actif le complexe Tax-PP2A-IKK |
[
15] |
|
|
West Nile
|
West Nile capsideprotein (WNVC) |
Se lie à la protéine I2PP2A, ce qui stimule l’activité PP2A |
[16] |
Protéines virales décrites comme pouvant s’associer avec PP2A. Certaines protéines oncogènes codées par une douzaine de virus différents (à ADN ou ARN) interagissent avec des PP2A pour induire la transformation cellulaire. C’est le cas des virus transformant à ADN de la famille des papovae et des papillomae, du rétrovirus HTLV-1. D’autres protéines qui lient PP2A provoquent l’apoptose des cellules, c’est le cas de la protéine E4orf4 codée par l’adénovirus ou de la protéine Vpr codée par le VIH-1. BKV : virus de la sous-famille des polyomavirus, identifié dans l’urine d’un patient - dont les initiales étaient BK - ayant subi une greffe de rein ; EBV : virus d’Epstein -Barr ; JCV : John Cunningham virus, appartient à la famille des Papovaviridae humains, sous-famille des polyomavirus ; HTLV-1 : human T leukemia virus ; HPV : human papillomavirus ; IFN-α : interféron-α ; IKKγ : inhibitor of kappaB kinase gamma ; MCV : molluscum contagiosum virus ; VHC : virus de l’hépatite C ; VIH-1 : virus de l’immunodéficience humaine. |
|
La dérégulation de PP2A est associée au développement de certains processus tumoraux PP2A régule de nombreuses voies de signalisation comme Wnt, PI3K/Akt, et c-Myc, qui sont impliquées dans le processus de transformation tumorale [3]. Plusieurs mécanismes impliquant des mutations génétiques des sous-unités de PP2A [3], la dérégulation de la méthylation de la sous-unité PP2Ac [
17] ou la surexpression d’inhibiteurs spécifiques [
18] aboutissent à l’inhibition de PP2A (Figure 3A). En particulier, divers travaux ont permis l’identification de plusieurs protéines oncogéniques comme le facteur CIP2A (cancerous inhibitor of PP2A), un inhibiteur spécifique de PP2A qui est surexprimé dans divers types de cancer humains et qui, en inhibant PP2A, empêche la déphosphorylation de c-Myc et prévient ainsi sa dégradation [18,
19]. La surexpression de CIP2A est aussi induite par la protéine oncogénique CagA d’Helicobacter pylori, l’agent étiologique du cancer gastrique [
20]. Par ailleurs, SET/(I2PP2A), un autre inhibiteur de PP2A qui est surexprimé en présence de l’oncogène BCR/ABL1, est impliqué dans la leucémie myéloïde chronique [
21]. D’autres inhibiteurs cellulaires endogènes comme la protéine α4 sont surexprimés dans des cancers humains et contribuent au développement du processus tumoral [
22]. De façon remarquable, des protéines virales transformantes peuvent inhiber PP2A pour induire le processus tumoral en mimant l’effet des inhibiteurs cellulaires de PP2A (Figure 3B) [1].
 | Figure 3.
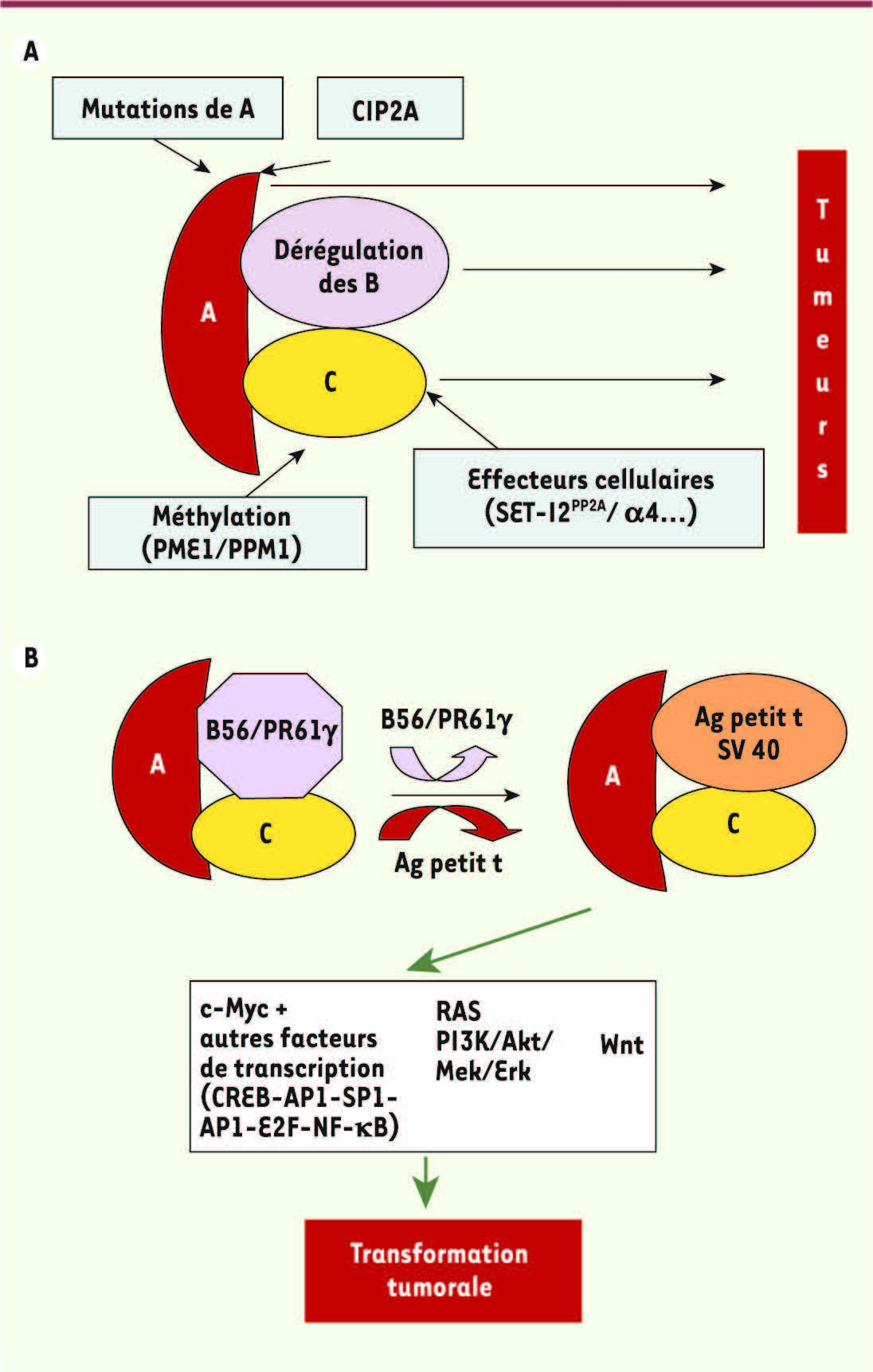
L’inhibition de PP2A induit un signal tumoral. A. PP2A régule négativement des signaux anti-apoptotiques comme la voie de signalisation PI3K/Akt. Ceux-ci, à la suite de l’inhibition de PP2A, sont activés dans la transformation tumorale [ 3]. Parmi les mécanismes impliquant l’inhibition de PP2A dans le processus de transformation tumorale, on trouve : 1. Des mutations génétiques de la sous-unité structurale A diminuant l’activité PP2A qui ont été caractérisées dans plusieurs types de cancers humains [ 3]. 2. La troncation de la sous-unité régulatrice PR61/B’γ qui induit la radiorésistance et active le processus métastatique [ 2]. 3. La dérégulation de la méthylation de PP2A [ 17] et la surexpression d’inhibiteurs spécifiques de PP2A comme SET, CIP2A ou α4 [ 18, 19]. B. PP2A l’antigène petit t de SV40 (Ag petit t) : un exemple de la dérégulation des signaux de survie contrôlés par PP2A qui provoque la transformation tumorale. L’inhibition de PP2A par l’antigène petit t de SV40 déplace la sous-unité B′/B56/PR61γ, ce qui a pour conséquence d’activer les voies de signalisation PI3K/Akt, Wnt, et c-Myc impliquées dans les processus tumoraux [ 1]. |
|
La dérégulation de PP2A par les virus : du processus tumoral aux perspectives thérapeutiques Les virus disposent d’un petit génome codant pour un nombre restreint de protéines capables de cibler des effecteurs cellulaires importants dont PP2A. Lors des deux dernières décennies, des études basées sur l’interaction fonctionnelle de PP2A avec des protéines virales ont permis d’identifier des voies de signalisation critiques pour la biologie des virus et pour l’induction des processus tumoraux. En particulier, l’identification d’oncoprotéines virales (l’antigène petit t de SV40) a permis de caractériser un mécanisme précis impliquant l’inhibition de PP2A dans un processus de transformation tumorale (Figure 3B) [2]. Par ailleurs, l’identification de protéines virales proapoptotiques, comme la protéine adénovirale E4orf4 ou la protéine Vpr du VIH-1 (
Figure 2
et [10]), a suggéré de nouvelles pistes pour identifier des signalisations antiapoptotiques et antitumorales. De façon intéressante, la protéine E4orf4 codée par les adénovirus provoque l’apoptose des cellules infectées, ce qui permettrait de libérer les nouveaux virions, mais elle entraîne aussi la mort des cellules cancéreuses sans affecter les cellules normales [4]. Les étapes précoces de l’infection par des adénovirus se caractérisent par la transcription de gènes viraux précoces (appelés E1) codant pour des protéines oncogéniques qui activent la division cellulaire (E1A) et inactivent p53 et la machinerie apoptotique (E1B55K et E1B19K). L’infection par l’adénovirus favorise donc la réplication de l’ADN viral tout en créant un contexte cellulaire similaire à celui d’une cellule transformée dans laquelle les mécanismes apoptotiques, par exemple ceux que contrôle p53, sont inhibés. Dans ces conditions, l’induction de l’apoptose des cellules cancéreuses, qui requiert une interaction spécifique de la protéine E4orf4 avec la sous-unité Bα de l’holoenzymze PP2A1
(Figure 2), ne nécessite pas la présence d’un gène p53 fonctionnel [
23]. Le signal contrôlé par E4orf4 et par PP2A1 représente donc une cible d’action très prometteuse pour un développement potentiel d’une chimiothérapie non toxique [
24]. Dans ce sens, une première approche a tenté de reproduire le signal antitumoral de E4orf4, et a montré que le transfert de l’ADNc de E4orf4 par électroporation inhibe la croissance du mélanome murin B16. Cependant, cet effet ne se révèle pas suffisamment efficace pour un traitement thérapeutique [
25]. Par ailleurs, une approche pharmacologique antitumorale basée sur la dérégulation, par des petites molécules chimiques ou peptidiques, de complexes fonctionnels associés à PP2A a été proposée. Par exemple, l’utilisation de FTY720, un immunosuppresseur qui active PP2A et inhibe la voie de survie PI3K/Akt, a été proposée dans le traitement de la leucémie myéloïde [
26]. Dans ce contexte, l’inhibition de PP2A par l’antigène petit t de SV40 contrecarre l’effet d’activation de PP2A par le FTY720 et maintient l’activité d’Akt [
27]. Ce résultat illustre bien un des prérequis de ces approches : les agents pharmacologiques doivent avoir une très haute affinité pour les sous-unités de PP2A qui sont ciblées, de façon à pouvoir contrecarrer efficacement la liaison à PP2A d’oncogènes cellulaires ou viraux. Dans ce contexte, nous avons proposé une approche thérapeutique appelée drug phosphatase technology, ou DPT, basée sur l’inhibition de processus pathologiques par transfert intracellulaire de peptides pénétrants mimant des sites d’interaction avec des protéines de la famille des protéine phosphatases PP1/PP2A (Figure 4) [
28]. En particulier, nous avons caractérisé DPT-5, un peptide pénétrant contenant, à l’instar d’E4orF4, une séquence d’interaction (dans ce cas issue de l’antigène CD28) avec la sous-unité Bα de PP2A1, qui induit l’apoptose des cellules humaines [28]. Plus récemment, nous avons montré qu’un peptide DPT contenant un site de liaison de la protéine E4orf4 de chien qui interagit avec la sous-unité structurale Bα de PP2A1 provoque l’apoptose des cellules tumorales humaines sans affecter les cellules saines (Galioot et al., en préparation).
 | Figure 4.
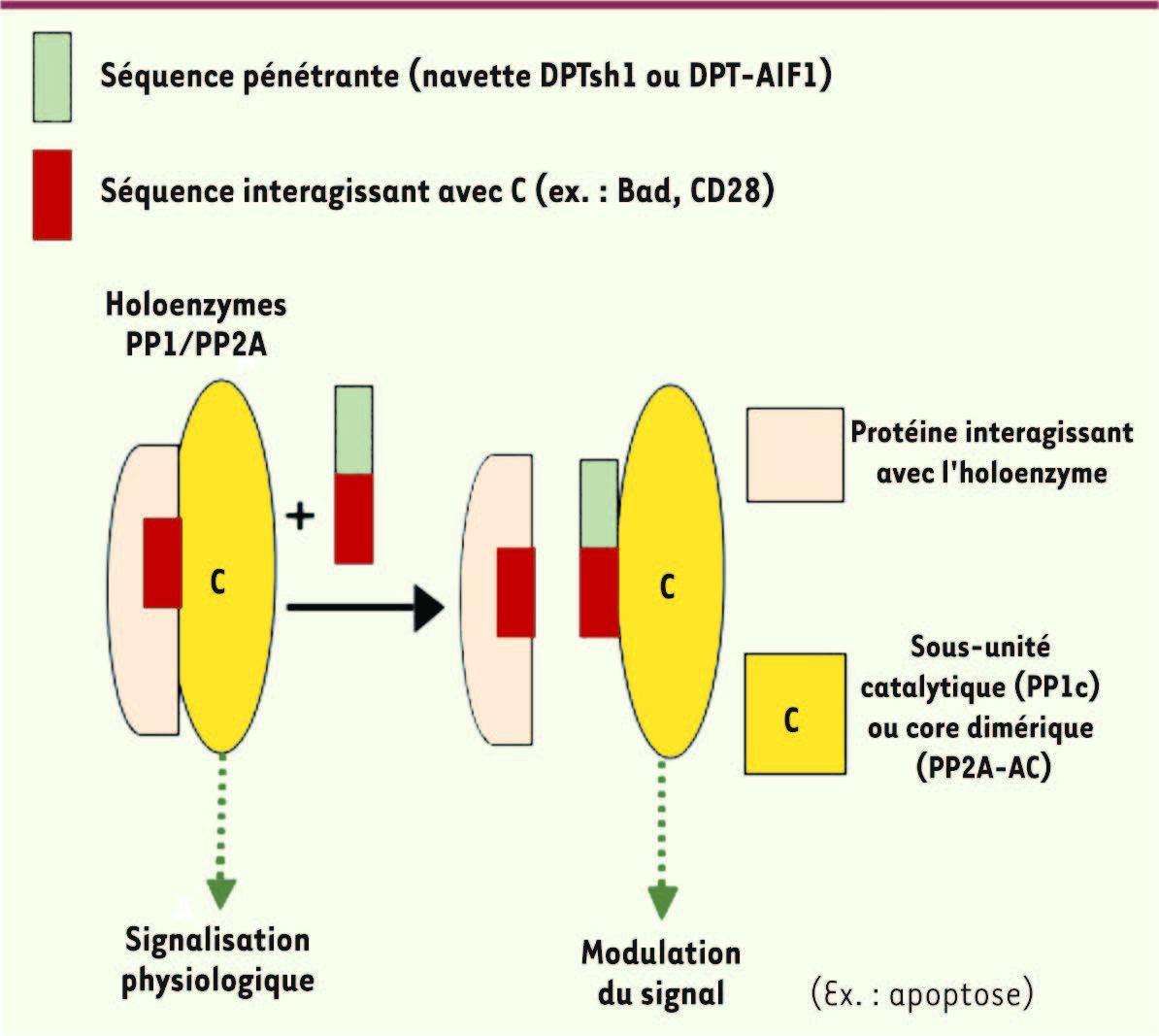
Le concept DPT : dérégulation ciblée et spécifique des protéine phosphatases PP1/PP2A pour induire l’apoptose de la cellule tumorale. Nous avons caractérisé un nouveau peptide pénétrant de localisation cytoplasmique qui mime la séquence du site de liaison de la protéine CK2α avec la sous-unité A de PP2A. Ce peptide appelé DPTsh1 est une navette non toxique qui permet d’introduire dans les cellules en culture des séquences apoptotiques impliquées dans l’interaction avec PP1/PP2A. En particulier, une séquence d’interaction de la protéine apoptotique Bad avec PP1c, ou de l’antigène CD28 avec PP2A 1, provoquent l’apoptose des cellules humaines [ 28]. Plus récemment, nous avons caractérisé DPT-AIF 1, une nouvelle séquence pénétrante, issue du domaine carboxy-terminal de la protéine apoptotique AIF ( apoptosis inducing factor) qui se lie à la protéine PP1c pour induire l’apoptose. DPT-AIF 1, qui contient le motif (RK)-x (0,1)-V/I-x-F-x-x-(RK)-x-(RK) présent également dans une dizaine de protéines impliquées dans la survie des cellules, est une nouvelle signature apoptotique permettant l’association avec PP1. Ce motif pourrait être utilisé pour concevoir de nouvelles molécules peptidiques au potentiel thérapeutique [
29]. |
En conclusion, le ciblage des protéine phosphatases PP2A par des protéines virales apparaît comme une stratégie importante pour le contrôle des processus infectieux et tumoraux. L’inhibition de PP2A par les protéines virales codées par des virus transformants de type papovae s’oppose à l’activation de PP2A par des protéines virales proapoptotiques (E4orf4 ; VIH-1 Vpr). L’identification de nouvelles protéines virales utilisant le système PP2A pour déréguler les cellules permettrait une meilleure caractérisation des mécanismes de transformation cellulaire. L’étude approfondie de ces mécanismes et la conception de molécules capables de contrecarrer les signaux tumoraux restent un défi pour la recherche biomédicale. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient l’Institut Pasteur et l’Inra qui ont soutenu leur recherche.
|
Footnotes |
1.
Sablina
AA
,
Hector
M
,
Colpaert
N
,
Hahn
WC
. Identification of PP2A complexes and pathways involved in cell transformation . Cancer Res.
2010; ; 70 : :10474.–10484. 2.
Janssens
V
,
Jozef Goris
J
,
Van Hoof
C
. PP2A: the expected tumor suppressor . Curr Opin Genet Dev.
2005; ; 15 : :34.–41. 3.
Eichhorn
PJ
,
Creyghton
MP
,
Bernards
R
. Protein phosphatase 2A regulatory subunits and cancer . Biochim Biophys Acta.
2009; ; 1795 : :1.–15. 4.
Shtrichman
R
,
Sharf
R
,
Barr
H
, et al.
Induction of apoptosis by adenovirus E4orf4 protein is specific to transformed cells and requires an interaction with protein phosphatase 2A . Proc. Natl Acad Sci USA.
1999; ; 96 : :10080.–10085. 5.
Rundell
K
,
Major
EO
,
Lanpert
M
. Association of cellular 56000- and 32000-molecular-weight protein with BK virus and polyoma virus t-antigens . J Virol.
1981; ; 37 : :1090.–1093. 6.
Garibal
J
,
Hollville
E
,
Bell
AI
, et al.
Truncated form of the Epstein-Barr virus protein EBNA-LP protects against caspase-dependent apoptosis by inhibiting protein phosphatase 2A . J Virol.
2007; ; 81 : :598.–607. 7.
Sariyer
IK
,
Khalili
K
,
Safak
M
. Dephosphorylation of JC virus agnoprotein by protein phosphatase 2A: inhibition by small t antigen . Virology.
2008; ; 375 : :64.–79. 8.
Bollag
B
,
Hofstetter
CA
,
Reviriego-Mendoza
MM
,
Frisque
RJ
. JC virus small t antigen binds phosphatase PP2A and Rb family proteins, is required for efficient viral DNA replication activity . PLoS One.
2010; ; 5 : :e10606.. 9.
Georgopoulou
U
,
Tsitoura
P
,
Kalamvoki
M
,
Mavromara
P
. The protein phosphatase 2A represents a novel cellular target for hepatitis C virus NS5A protein . Biochimie.
2006; ; 88 : :651.–662. 10.
Godet
AN
,
Guergnon
J
,
Croset
A
, et al.
PP2A1 binding, cell transducing and apoptotic properties of Vpr77–92 : a new functional domain of HIV-1 Vpr proteins . PLoS One.
2010; ; 5 : :e13760.. 11.
Pim
D
,
Massimi
P
,
Dilworth
SM
,
Banks
L
. Activation of the protein kinase B pathway by the HPV-16 E7 oncoprotein occurs through a mechanism involving interaction with PP2A . Oncogene.
2005; ; 24 : :830.–838. 12.
Kwun
HJ
,
Guastafierro
A
,
Shuda
M
, et al.
The minimum replication origin of Merkel cell polyomavirus has a unique large T-antigen loading architecture and requires small T-antigen expression for optimal replication . J Virol.
2009; ; 83 : :12118.–12128. 13.
Benjamin
TL
. Polyoma virus: old findings and new challenges . Virology.
2001; ; 289 : :167.–173. 14.
Dilworth
SM
. Polyoma virus middle T antigen and its role in identifying cancer-related molecules . Nat Rev Cancer.
2002; ; 2 : :951.–956. 15.
Hong
S
,
Wang
LC
,
Gao
X
, et al.
Heptad repeats regulate protein phosphatase 2a recruitment to I-kappaB kinase gamma/NF-kappaB essential modulator and are targeted by human T-lymphotropic virus type 1 tax . J Biol Chem.
2007; ; 282 : :12119.–12126. 16.
Hunt
TA
,
Urbanowski
MD
,
Kakani
K
, et al.
Interactions between the West Nile virus capsid protein and the host cell-encoded phosphatase inhibitor, I2PP2A
. Cell Microbiol.
2007; ; 9 : :2756.–2766. 17.
Guénin
S
,
Schwartz
L
,
Morvan
D
, et al.
PP2A activity is controlled by methylation and regulates oncoprotein expression in melanoma cells: a mechanism which participates in growth inhibition induced by chloroethylnitrosourea treatment . Int J Oncol.
2008; ; 32 : :49.–57. 18.
Junttila
MR
,
Puustinen
P
,
Niemela
M
, et al.
CIP2A inhibits PP2A in human malignancies . Cell.
2007; ; 130 : :51.–62. 19.
Come
C
,
Laine
A
,
Chanrion
M
, et al.
CIP2A is associated with human breast cancer aggressivity . J Clin Cancer Res.
2009; ; 15 : :5092.–5100. 20.
Zhao
D
,
Liu
Z
,
Ding
J
, et al.
Helicobacter pylori CagA upregulation of CIP2A is dependent on the Src and MEK/ERKpathways . J Med Microbiol.
2010; ; 59 : :259.–265. 21.
Neviani
P
,
Santhanam
R
,
Trotta
R
, et al.
The tumor suppressor PP2A is functionally inactivated in blast crisis CML through the inhibitory activity of the BCR/ABL-regulated SET protein . Cancer Cell.
2005; ; 8 : :355.–368. 22.
Chen
LP
,
Lai
YD
,
Li
DC
, et al.
α4 is highly expressed in carcinogen-transformed human cells and primary human cancers . Oncogene.
2011; ; 20 : :2943.–2953. 23.
Marcellus
RC
,
Chan
H
,
Paquette
D
, et al.
Induction of p53-independent apoptosis by the adenovirus E4orf4 protein requires binding to the Balpha subunit of protein phosphatase 2A . J Virol.
2000; ; 74 : :7869.–7887. 24.
Robert
A
,
Miron
MJ
,
Champagne
C
, et al.
Distinct cell death pathways triggered by the adenovirus early region 4 ORF 4 protein . J Cell Biol.
2002; ; 158 : :519.–528. 25.
Mitrus
I
,
Missol-Kolka
E
,
Plucienniczak
A
,
Szala
S
. Tumour therapy with genes encoding apoptin and E4orf4 . Anticancer Res.
2005; ; 25 : :1087.–1090. 26.
Neviani
P
,
Santhanam
R
,
Oaks
JJ
, et al.
FTY720, a new alternative for treating blast crisis chronic myelogenous leukemia and Philadelphia chromosome-positive acute lymphocytic leukemia . J Clin Invest.
2007; ; 117 : :2408.–2421. 27.
Matsuoka
Y
,
Nagahara
Y
,
Ikekita
M
,
Shinomiya
T
. A novel immunosuppressive agent FTY720 induced Akt dephosphorylation in leukemia cells . Br J Pharmacol.
2003; ; 138 : :1303.–1312. 28.
Guergnon
J
,
Dessauge
F
,
Dominguez
V
, et al.
Use of penetrating peptides interacting with PP1/PP2A proteins as a general approach for a drug phosphatase technology . Mol Pharmacol.
2006; ; 69 : :1115.–1124. 29.
Godet
AN
,
Guergnon
J
,
Maire
V
, et al.
The combinatorial PP1-binding consensus motif (R/K)x (0, 1)V/IxFxx(R/K)x(R/K) is a new apoptotic signature . PloS One.
2010; ; 5 : :e9981.. |