Lors du développement des circuits nerveux et du système vasculaire, l’embryon devient une véritable carte qui indique les positions et les chemins à suivre pour permettre la croissance orientée des axones et des vaisseaux sanguins.
Les neurones se connectent entre eux en suivant de façon très précise les voies délimitées par des molécules attractives et répulsives, qui guident les axones un peu comme les panneaux de signalisation nous guident sur les routes. La découverte des principes généraux sous-jacents au câblage du système nerveux en développement a fourni les bases génétiques et moléculaires permettant de comprendre comment un ensemble relativement restreint de signaux de guidage suffit à l’assemblage de réseaux nerveux très complexes.
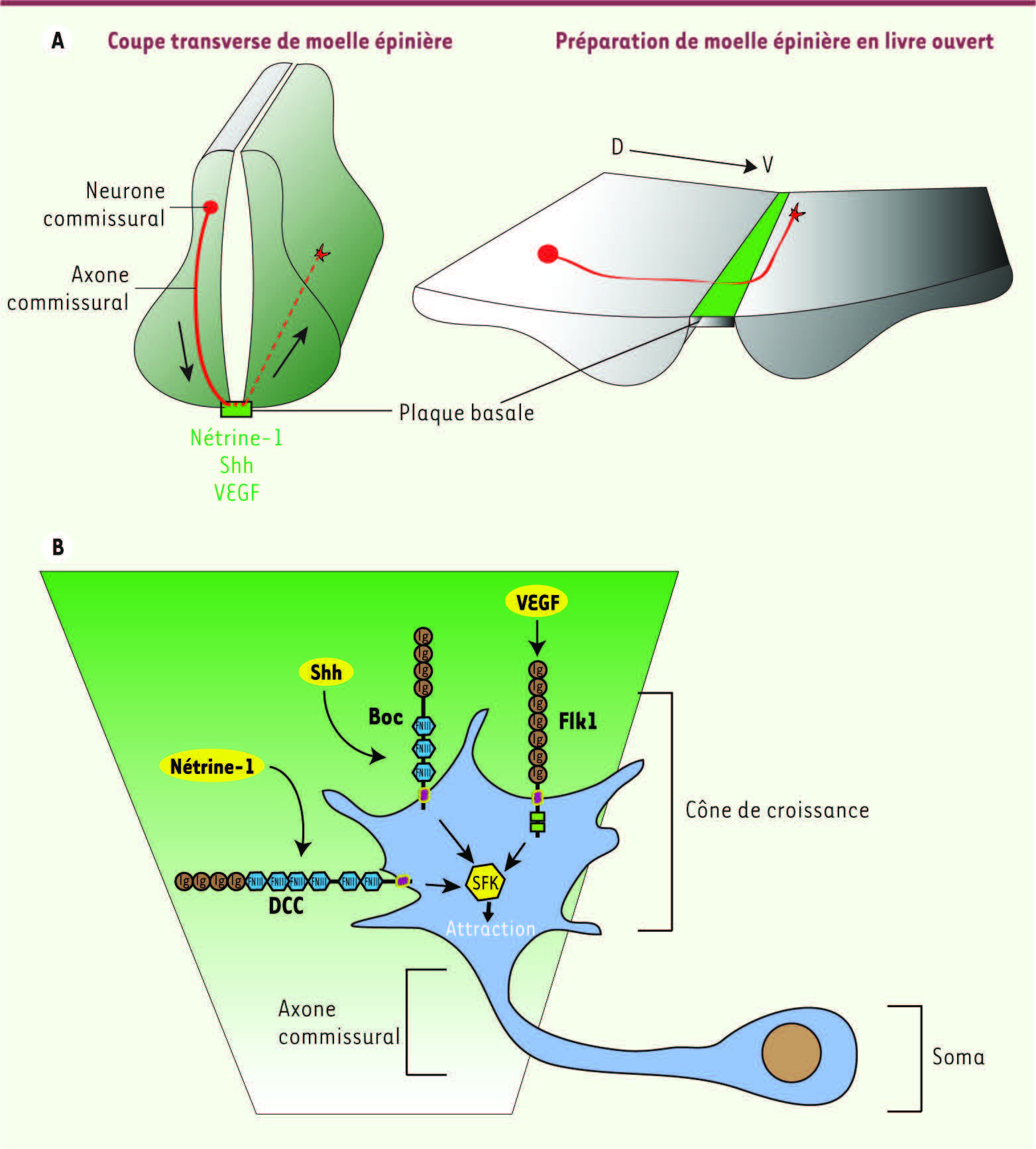
Dans la moelle épinière, il a ainsi été montré que deux composés diffusibles, la nétrine-1 et Sonic hedgehog (Shh) collaborent pour attirer les axones des neurones commissuraux vers la plaque basale de la moelle épinière (Figure 1) [ 1, 2]). La nétrine-1 et Shh sont sécrétées par la plaque basale, tandis que les récepteurs pour ces molécules, DCC (deleted in colorectal cancer) et Boc (brother of Cdon), respectivement, sont localisés à la surface des axones. Lorsque ces récepteurs sont inactivés, la plupart des axones ne parviennent plus à rejoindre la plaque basale (cible) et se perdent dans les colonnes motrices [ 3– 5].
| Figure 1
Guidage axonal par VEGF dans la moelle épinière. A. Représentations de la moelle épinière en développement. À gauche, une coupe transverse de la moelle épinière. Les corps cellulaires des neurones commissuraux (en rouge) sont localisés dans la partie dorsale (en haut) (D) de la moelle épinière. Ils envoient leur axone vers la plaque basale qui exprime le VEGF, la nétrine-1 et Shh. Ces molécules diffusibles forment des gradients (en vert). À droite, une préparation en « livre ouvert » de la moelle épinière permet de visualiser le croisement de la plaque basale par les axones commissuraux (en rouge). B. Illustration de la signalisation attractive au niveau du cône de croissance d’un neurone commissural. Les gradients de VEGF, Shh et nétrine-1 sont schématisés en vert. Le cône de croissance, qui exprime les récepteurs Flk1, Boc et DCC à sa surface, peut « lire » ce gradient et réoriente la trajectoire de l’axone commissural dans cette direction. Les trois récepteurs convergent pour activer les kinases de la famille Src (SFK), ce qui conduit au remaniement du cytosquelette et au processus attractif. |
Toutefois, lorsque les signalisations de ces deux molécules sont abolies, certains axones arrivent tout de même à rejoindre leur cible [2]. Cette observation suggérait qu’un troisième acteur était mis en jeu pour attirer les axones commissuraux vers la plaque basale.
Nos travaux ont montré que, contre toute attente, ce n’est pas une molécule classique du système nerveux qui joue ce rôle d’attractant. En effet, c’est en collaborant avec l’équipe du Dr P. Carmeliet, spécialiste des facteurs qui influencent la formation des vaisseaux sanguins, que nous avons récemment identifié le VEGF (vascular endothelial growth factor) comme un troisième intervenant coordonnant la trajectoire des axones commissuraux [ 6]. Ce facteur de croissance des cellules endothéliales vasculaires était un très bon candidat pour jouer ce rôle puisqu’il est exprimé au bon endroit (la plaque basale) et au bon moment (au 11e jour embryonnaire chez la souris, lors de la croissance des axones commissuraux). Pour mettre en évidence son rôle, nous avons montré que le VEGF est bel et bien sécrété par la plaque basale. Ensuite, en inactivant génétiquement soit le gène codant pour le VEGF, soit celui codant pour son récepteur Flk1, nous avons observé des défauts de guidage des axones commissuraux. Enfin, en filmant en temps réel des cultures de neurones commissuraux [ 7], nous avons observé que l’ajout de VEGF induisait l’attraction des axones vers la source de VEGF [6], démontrant que l’effet de cette molécule sécrétée était bien direct, et non indirect via le remodelage des vaisseaux sanguins. De plus, nous avons cherché à définir par quelle voie moléculaire le signal du VEGF était relayé pour induire l’attraction axonale. Ainsi, en bloquant l’activité des kinases de la famille Src (SFK), nous avons observé que le VEGF perdait son effet attractif. Cette famille de kinases est aussi requise pour transmettre les effets attractifs de la nétrine-1 [ 8] et de Shh [ 9]. L’activité des SFK est donc la condition requise pour le guidage axonal commissural, conférant à ces kinases une position centrale dans l’intégration du signal attractif.
En parallèle, le rôle attractif du VEGF a également été identifié dans le système visuel [ 10]. Dans ce système, il y a deux populations de cellules ganglionnaires de la rétine (CGR) qui projettent vers le cerveau. Une partie envoie des axones du côté ipsilatéral. Ceux-ci sont repoussés par le chiasma, et l’autre partie envoie les axones controlatéraux, qui croisent la ligne médiane du chiasma pour rejoindre la partie controlatérale du cerveau. L’expression du VEGF au niveau du chiasma optique guide les axones controlatéraux en les attirant. Cet effet attractif ne dépend pas du récepteur Flk1, comme dans la moelle épinière, mais met en jeu le récepteur neuropiline-1, qui est exprimé spécifiquement à la surface des axones controlatéraux. Il est curieux d’observer que, dans ce système, la nétrine-1 n’est pas présente à ce niveau. La voie Shh, quant à elle, guide de façon répulsive les axones ipsilatéraux qui expriment spécifiquement le récepteur Boc [ 11]. Il sera intéressant de voir si les CGR transmettent ces signaux par le biais des SFK, et si des spécificités dans les voies moléculaires en aval des récepteurs peuvent expliquer les effets ambivalents (attraction versus répulsion) et le recrutement de différents récepteurs (Flk-1 et neuropiline-1) dans les systèmes visuel et spinal.
Chez l’homme, plusieurs études ont commencé à identifier des mutations dans les gènes responsables du guidage axonal au niveau de la ligne médiane [ 12]. La découverte du rôle du VEGF comme molécule attractive à ce niveau aidera non seulement à mieux comprendre ces conditions, mais permettra aussi d’ouvrir de nouvelles portes quant à l’élaboration de stratégies visant à promouvoir le rebranchement conjoint des circuits nerveux et sanguins lors de lésions ou de maladies dégénératives.