| |
| Med Sci (Paris). 2011 December; 27(12): 1056–1057. Published online 2011 December 23. doi: 10.1051/medsci/20112712006.Structure atomique de deux anesthésiques généraux liés à leur cible principale
Les récepteurs-canaux pentamériques Hugues Nury,1,2 Marc Delarue,1 and Pierre-Jean Corringer2* 1Unité de dynamique structurale des macromolécules, CNRS, URA 2185, Institut Pasteur, 25, rue du Docteur Roux, F-75015Paris Cedex 15, France 2Groupe récepteurs-canaux, CNRS, URA 2182, Institut Pasteur, 25, rue du Docteur Roux, F-75015Paris Cedex 15, France MeSH keywords: Anesthésiques généraux, administration et posologie, composition chimique, métabolisme, Cristallographie aux rayons X, Systèmes de délivrance de médicaments, Humains, Modèles biologiques, Modèles moléculaires, Structure moléculaire, Liaison aux protéines, Structure quaternaire des protéines, Récepteurs GABA-A |
Les anesthésiques généraux ont été découverts au début du XIXe siècle et rapidement utilisés pour les opérations chirurgicales. À ce titre, leur découverte a révolutionné la pratique médicale. Actuellement, ils sont couramment employés : un individu est anesthésié en moyenne sept fois dans sa vie dans les pays développés. Les anesthésiques généraux comptent parmi les molécules les plus dangereuses utilisées en médecine, et une discipline entière leur est consacrée, l’anesthésiologie. Leurs effets secondaires, leur toxicité et les problèmes cognitifs à long terme qu’ils peuvent provoquer continuent néanmoins de compliquer leur utilisation [
1].
 | Figure 1.
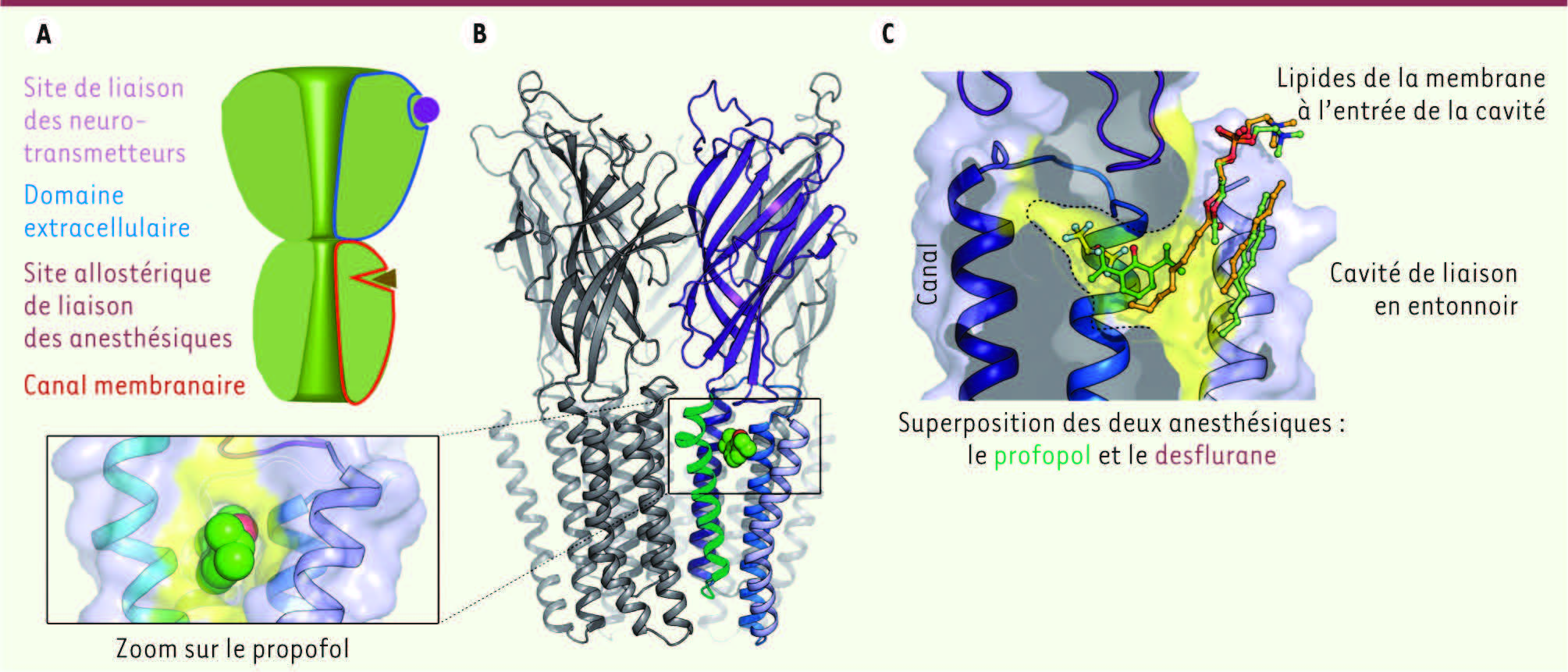
Structure des récepteurs-canaux pentamériques. A. Architecture des récepteurs-canaux pentamériques. B. Structure cristallographique de GLIC en complexe avec le propofol (en vert). Une des cinq sous-unités composant la protéine est colorée en bleu. C. Vue en coupe de la cavité de liaison des anesthésiques généraux. Les deux anesthésiques sont superposés pour montrer leur position relative. |
Paradoxalement, le mécanisme d’action des anesthésiques généraux reste mal connu. Ce sont des molécules de faible poids moléculaire à caractère amphiphile. Citons l’éther éthylique et ses dérivés modernes utilisés en médicine, l’isoflurane, le desflurane et le sévoflurane ; le chloroforme, l’éthanol et le propofol, ainsi que les gaz nobles comme le xénon. Les anesthésiques généraux sont administrés sous forme de gaz, à l’exception du propofol qui est injecté par voie intraveineuse. Au début du xx
e siècle, la faible spécificité chimique des anesthésiques généraux, ainsi que la corrélation entre leur solubilité dans l’huile d’olive et leur puissance anesthésique avaient conduit Meyer et Overton à proposer une hypothèse « lipidique » pour leur action. Selon celle-ci, les anesthésiques généraux, via leur partition dans les membranes du cerveau, produiraient des modifications biophysiques générales (changement de fluidité, courbure, épaisseur, etc.) produisant l’anesthésie. De multiples exceptions à cette règle, et de nombreuses études pharmacologiques in vitro et chez des souris génétiquement modifiées, ont depuis montré l’existence de cibles protéiques majeures des anesthésiques généraux : les canaux ioniques. De façon générale, les anesthésiques généraux potentialisent les canaux inhibiteurs (anioniques) et inhibent les canaux excitateurs (cationiques) pour provoquer une dépression de l’activité neuronale. Parmi les canaux ioniques, les cibles majeures des anesthésiques généraux sont les récepteurs GABAA, qui assurent l’essentiel de la transmission inhibitrice dans le cerveau. Nous savons que les anesthésiques généraux se lient à ces récepteurs pour favoriser leur activation (potentiation). Leur site de liaison est distinct de celui qu’utilise l’activateur endogène qui est le neurotransmetteur GABA (acide γ-amino butyrique). Un tel type de site est nommé « allostérique » [
2], et son identification est une condition nécessaire pour comprendre le mécanisme d’action des anesthésiques généraux. |
Structure atomique d’un homologue bactérien des récepteurs-canaux pentamériques Les récepteurs GABAA font partie de la famille des récepteurs-canaux pentamériques, qui inclut également les récepteurs nicotiniques de l’acétylcholine. Tous les récepteurs de la famille partagent une structure tridimensionnelle (3D) similaire : ce sont des protéines enchâssées dans la membrane des cellules, et qui forment un canal ionique permettant l’entrée ou la sortie d’ions (Figure 1A). L’ouverture du canal est contrôlée par la liaison du neurotransmetteur (GABA ou acétylcholine). Lors de notre recherche d’un prototype de cette famille qui se prêterait aux approches structurales, nous avons découvert un ancêtre de la famille dans une cyanobactérie archaïque : Gloeobacter violaceus. Cette bactérie exprime un homologue nommé GLIC, qui forme un complexe homopentamérique fonctionnant comme un canal activé par les protons [
3]. L’origine bactérienne de GLIC nous a permis de le produire en grande quantité et de le cristalliser en trois dimensions pour résoudre sa structure par diffraction des rayons X [
4]. La structure est de bonne qualité avec une résolution de 2,9 Å. Elle révèle l’architecture de la protéine : chaque monomère est replié en sandwich au niveau extracellulaire et en quatre hélices α au niveau transmembranaire. Le canal ionique est clairement visible au niveau de l’axe de symétrie de la protéine. De nombreux arguments montrent que la structure du pore est compatible avec une conformation de type canal ouvert. Le canal a un diamètre de 12 Å au niveau extracellulaire, qui diminue progressivement jusqu’à une constriction du coté cytoplasmique qui réduit le diamètre à 5 Å, taille qui coïncide avec le filtre de sélectivité des ions. |
Site pharmacologique et mécanisme d’action des anesthésiques généraux En collaboration avec James M. Sonner (University of California, San Francisco, États-Unis), nous avons montré que la sensibilité aux anesthésiques généraux est une propriété universelle de ces protéines puisque l’homologue bactérien GLIC est inhibé de façon allostérique par la grande majorité des anesthésiques généraux à des concentrations identiques à celles qui sont utilisées en clinique. GLIC est particulièrement sensible aux anesthésiques volatils et possède en ce sens une pharmacologie proche des récepteurs nicotiniques qui sont également inhibés par les anesthésiques généraux [
5]. Ces observations nous ont naturellement conduits à étudier les sites de liaison des anesthésiques généraux sur GLIC. Nous avons résolu la structure cristallographique de GLIC en complexe avec le desflurane (volatil, inhalé) et le propofol (administré par voie intraveineuse) à 3,2 Å [
6]. Ces deux composés se lient au niveau d’une même cavité qui préexiste en l’absence d’anesthésiques généraux. La cavité de liaison se situe dans la partie haute du domaine transmembranaire, derrière la porte (gate) du canal (Figure 1B). Elle a une forme d’entonnoir largement ouvert sur la membrane et qui se rétrécit progressivement vers l’intérieur de la protéine. Le propofol, qui est une molécule relativement volumineuse, se lie à l’entrée de la poche, alors que le desflurane, qui est plus petit et plus flexible, se lie plus en profondeur (Figure 1C). Nous avons également montré, avec C. Van Renterghem (Institut Pasteur) que des mutations au niveau d’acides aminés contactant les anesthésiques généraux dans la structure cristallographique changeaient profondément leur capacité à inhiber GLIC. Ce qui démontre que la cavité identifiée est bien celle qui est impliquée dans la modulation allostérique. Enfin, des expériences de dynamique moléculaire réalisés avec M. Baaden (Institut de biologie physico-chimique, Paris) confirment que les anesthésiques généraux restent liés à leur site de liaison, mais montrent également qu’ils sont soumis à des fluctuations et réorientations importantes dans la poche. |
Ces données identifient pour la première fois le site de deux anesthésiques généraux dans la structure d’un membre de la famille des récepteurs-canaux qui sont leur cible principale. Ce travail indique que les anesthésiques généraux sont maintenus dans leur site allostérique principalement par des interactions de van der Waals, qu’ils sont très mobiles dans ce site et que leur liaison est associée à une réorganisation significative des lipides proches de la protéine. Ce travail permet de mieux comprendre le mécanisme d’action des anesthésiques généraux, via leur liaison à une cavité située à l’interface entre domaines extracellulaire et transmembranaire, et qui se tient juste derrière la porte du canal. La connaissance de cette poche permettra également dans le futur de concevoir de nouveaux effecteurs allostériques à fort potentiel thérapeutique. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Franks
N
. General anaesthesia: from molecular targets to neuronal pathways of sleep and arousal . Nat Rev Neurosci.
2008; ; 9 : :370.–386. 2.
Changeux
JP
,
Edelstein
SJ
. Allosteric mechanisms of signal transduction . Science.
2005; ; 308 : :1424.–1428. 3.
Bocquet
N
,
Prado de Carvalho
L
,
Cartaud
J
. et al.
A prokaryotic proton-gated ion channel from the nicotinic acetylcholine receptor family . Nature.
2007; ; 445 : :116.–119. 4.
Bocquet
N
,
Nury
H
,
Baaden
M
, et al.
X-ray structure of a pentameric ligand-gated ion channel in an apparently open conformation . Nature.
2009; ; 457 : :111.–114. 5.
Weng
Y
,
Yang
L
,
Corringer
PJ
,
Sonner
JM
. Anesthetic sensitivity of the Gloeobacter violaceus proton-gated ion channel . Anesth Analg.
2010; ; 110 : :59.–63. 6.
Nury
H
,
Van Renterghem
C
,
Weng
Y
. et al.
X-ray structures of general anesthetics bound to a pentameric ligand-gated ion channel . Nature.
2011; ; 469 : :428.–431. |