| |
| Med Sci (Paris). 2011 November; 27(11): 1019–1024. Published online 2011 November 30. doi: 10.1051/medsci/20112711020.Le printemps de l’immunité innée couronné à Stockholm Prix Nobel de Médecine 2011 : Bruce A. Beutler, Jules A. Hoffmann et Ralph M. Steinman Jean-Luc Imler1* and Dominique Ferrandon1 1CNRS UPR9022, Institut de biologie moléculaire et cellulaire, Université de Strasbourg, 15, rue René Descartes, 67084Strasbourg Cedex, France |
Les récepteurs Toll doivent leur nom à un gène de la drosophile, Toll, qui signifie super ou fantastique en allemand vernaculaire. Le nom fut choisi par Christiane Nusslein-Volhard (elle-même colauréate du Prix Nobel de physiologie ou médecine en 1995 pour ses travaux de génétique sur le développement embryonnaire de la drosophile) pour qualifier les phénotypes causés par les mutations d’un gène impliqué dans la différenciation de l’axe dorso-ventral de l’embryon : alors que les mutations de certains allèles du gène Toll (mutations perte de fonction) causent un phénotype dorsalisé de l’embryon (l’embryon ne produit que des structures dorsales, même en position ventrale), d’autres (mutations gain de fonction) produisent une ventralisation spectaculaire [
1]. En fait, il s’est avéré que le récepteur Toll est doublement fantastique : il joue aussi un rôle clé dans la réponse immunitaire chez la mouche adulte, et ses homologues chez les mammifères ont une fonction primordiale dans l’immunité innée. Il est vraisemblable que la fonction originelle des récepteurs Toll chez l’ancêtre commun des métazoaires, vivant il y a près de 750 millions d’années, était immunitaire.
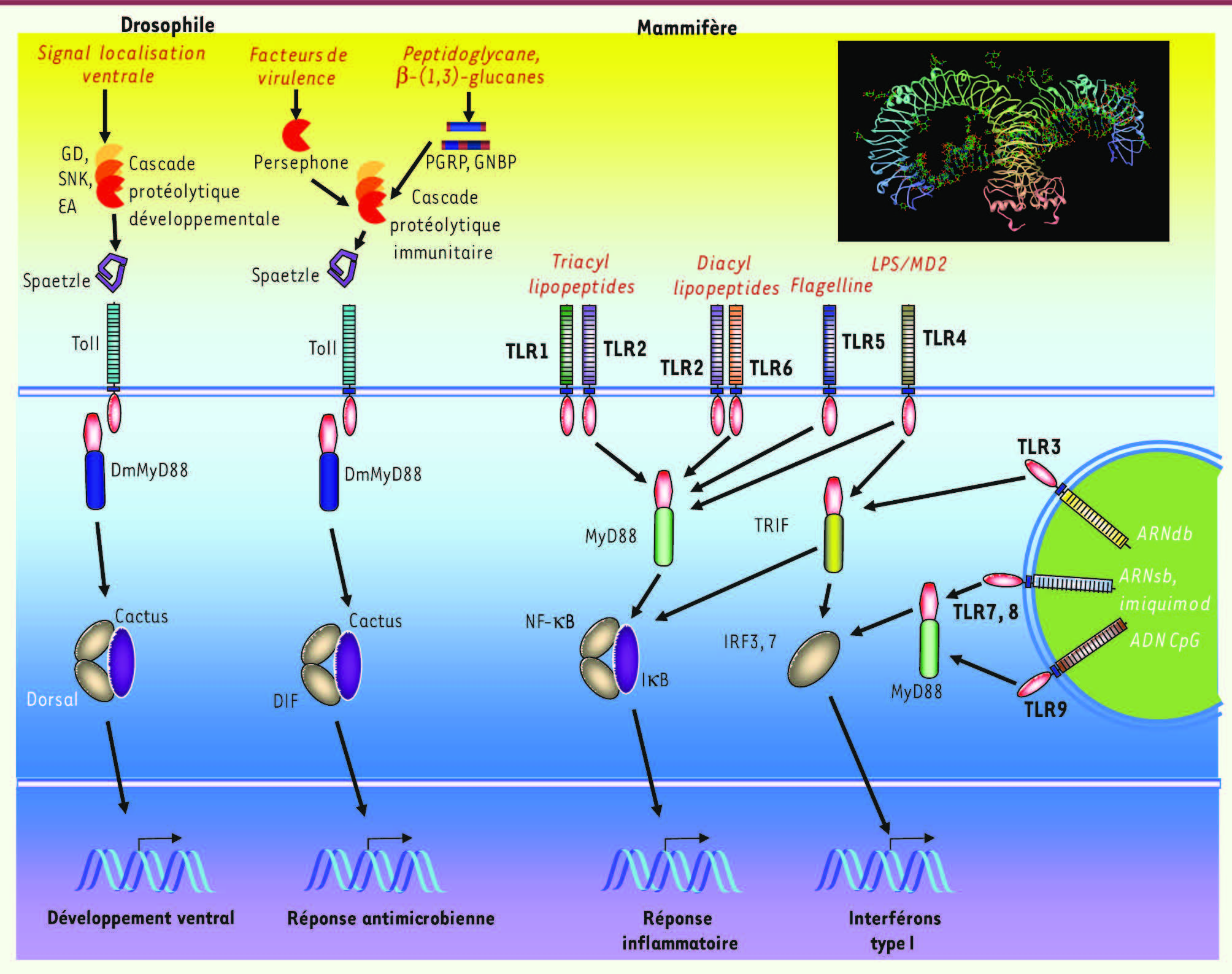
 | Figure 1
Les fonctions des récepteurs Toll chez la drosophile et les mammifères. Chez la drosophile, Toll joue un rôle dans la détermination de l’axe dorso-ventral de l’embryon et dans la réponse immunitaire. Dans les deux cas, Toll est activé par une cytokine apparentée aux neurotrophines, Spaetzle, et régule l’activité de facteurs de transcription de la famille NF-κB (Dorsal et DIF). Spaetzle est activée par clivage protéolytique, en réponse à la détection d’un signal développemental ou d’une infection (non-soi ou danger infectieux). Chez les mammifères, les Toll-like receptors sont activés par la reconnaissance de molécules microbiennes soit à la surface de la cellule, soit dans les endosomes. Médaillon : structure des ectomaines de deux TLR. |
L’immunité innée représente la première et souvent la seule ligne de défense contre les infections chez tous les animaux, vertébrés et invertébrés, et permet de contenir la plupart des infections. En outre, les cytokines et les molécules de costimulation induites par la réponse immunitaire innée jouent un rôle critique dans l’induction et l’orientation du type de réponse immunitaire adaptative chez les mammifères. Charles Janeway, malheureusement décédé en 2003, fut le premier à saisir l’importance de ce concept et à reconnaître que la réponse immunitaire à une infection implique non seulement des déterminants antigéniques, mais aussi des caractéristiques ou formes moléculaires (patterns) partagées par les agents infectieux mais absentes des cellules de l’hôte [
2]. Ses travaux ont conduit à une renaissance de l’étude de l’immunité innée chez les mammifères depuis une vingtaine d’années. |
Pattern recognition receptor : du concept à la découverte des Toll- like receptors
L’hypothèse des pattern recognition receptors
Dans un article de 1989, C. Janeway a insisté sur le fait que, en plus du signal apporté par l’interaction du récepteur de l’antigène avec son ligand spécifique, les lymphocytes avaient besoin d’un deuxième signal, provenant des cellules présentatrices de l’antigène, pour être activés. En effet, bien que capable de générer des anticorps susceptibles de reconnaître n’importe quel épitope, le système immunitaire adaptatif est incapable d’en déterminer l’origine, microbienne et donc potentiellement dangereuse ou inoffensive car non infectieuse. C. Janeway postula l’existence de récepteurs particuliers portés par les cellules présentatrices de l’antigène, les pattern recognition receptors ou PRR. Ceux-ci auraient été sélectionnés au cours de l’évolution pour leur capacité à reconnaître les molécules microbiennes. Comme ces récepteurs devaient être limités en nombre et codés par la lignée germinale (à la différence des récepteurs de l’antigène de l’immunité adaptative, formés par des réarrangements de gènes et des mutations spécifiquement dans le génome des cellules T et B), il proposa que les molécules reconnues par les PRR devaient remplir les trois propriétés suivantes : (1) être absentes de l’hôte, de façon à permettre une discrimination soi versus non-soi ; (2) être partagées par de nombreux microorganismes, de façon à permettre la reconnaissance d’une large gamme de microbes par un petit nombre de récepteurs; (3) être essentielles à la survie du micro-organisme, de façon à éviter la survenue de mutations permettant d’échapper à la reconnaissance [ 2]. On peut citer comme exemples de patterns microbiens les lipopolysaccharides (LPS) présents dans la membrane externe de toutes les bactéries à Gram négatif, les ARN double brin qui se forment dans le cytosol lors de la réplication de la plupart des virus, le peptidoglycane, les lipopeptides ou encore les motifs d’ADN CpG non méthylés bactériens ou viraux. On savait à l’époque que la plupart de ces molécules étaient capables d’induire des cascades de signalisation activant les facteurs de transcription de la famille NF-κB et conduisant à l’inflammation, mais on ignorait la nature des récepteurs impliqués. En dépit de l’intérêt manifesté pour le concept des PRR, la quête de ces récepteurs demeura longtemps infructueuse, à tel point qu’une théorie alternative fut proposée par P. Matzinger en 1994 : cette théorie postule que la reconnaissance de signaux de danger, plutôt que la reconnaissance du non-soi, joue un rôle primordial dans l’induction de la réponse immunitaire [
3]. Cependant, c’est de travaux portant sur un organisme dépourvu de réponse adaptative qu’est venue l’indication essentielle qui a permis d’identifier les premiers PRR des mammifères. Peptides antibactériens et Toll, l’importance du modèle drosophile La détermination du rôle critique joué par les récepteurs Toll est venue d’un ensemble d’études sur l’immunité de la mouche du vinaigre, Drosophila melanogaster [
33]. Chez de nombreuses espèces d’insectes, les infections déclenchent la sécrétion dans l’hémolymphe (l’équivalent du sang) d’une batterie de puissants peptides antimicrobiens. Initialement caractérisés par Hans Boman et ses collègues à Stockholm en 1981 chez le papillon Hyalophora cecropia (qui a donné son nom à la cécropine, le premier peptide antimicrobien identifié) [
4], ces peptides participent également à la défense de l’hôte chez les plantes et les mammifères (par exemple, les défensines α et β, les cathélicidines). L’analyse des promoteurs inductibles des gènes codant ces peptides, menée en parallèle sur la cécropine par H. Boman et ses collègues, et la diptéricine, un nouveau peptide identifié chez les insectes diptères (le groupe auquel appartient la drosophile) par Jules Hoffmann et ses collègues [
5,
34], révélèrent l’importance de motifs d’ADN fortement similaires aux sites de fixation décrits pour les facteurs de transcription de la famille NF-κB [
6,
7]. Ce résultat spectaculaire, qui pour la première fois indiquait que des mécanismes conservés au cours de l’évolution pouvaient être impliqués dans le contrôle de l’immunité innée chez les mammifères et les insectes, et que la drosophile pouvait représenter un modèle utile pour identifier les PRR, fut à l’origine d’un programme de recherche collaboratif soutenu par le Human frontier scientific program, et impliquant en particulier les laboratoires de Jules Hoffmann à Strasbourg (France) et Charlie Janeway à New-Haven ( Yale University, États-Unis) [
8]. À cette époque, le seul gène NF-κB connu chez la drosophile était dorsal, qui code le facteur de transcription activé par Toll sur la face ventrale de l’embryon. Curieusement, cependant, l’induction de la diptéricine n’est pas affectée dans les mouches mutantes Dorsal [
9]. Les choses s’éclaircirent lorsqu’un nouveau marqueur de la réponse immunitaire fut ajouté dans ces études, le gène codant le peptide antifongique drosomycine, découvert à Strasbourg en 1994 [
10]. En effet, des études génétiques montrèrent que l’induction du gène Drosomycine est contrôlée par un facteur de transcription proche de Dorsal, baptisé DIF (Dorsal-related immunity factor), et dont l’activité est régulée par la voie Toll [
11,
12]. Un troisième membre de la famille NF-κB chez la drosophile, Relish, contrôle l’expression de la Diptéricine en réponse à l’activation de l’autre voie de signalisation de la réponse immunitaire, la voie IMD (immune deficiency) [
13,
14]. La découverte de TLR4 chez l’homme Le résultat le plus marquant obtenu par le groupe de Strasbourg était que les mouches mutantes pour le gène Toll, dans lesquelles l’induction du gène Drosomycine est fortement réduite, présentaient une forte susceptibilité aux infections fongiques et succombaient rapidement à une infection par le champignon opportuniste Aspergillus fumigatus [ 11]. Lorsque cette découverte fut présentée dans le cadre de la collaboration entre les laboratoires de Strasbourg et de Yale, elle déclencha immédiatement la recherche d’orthologues de Toll chez les mammifères, et le premier Toll humain fut décrit par Ruslan Medzhitov et Charlie Janeway en 1997 [
15]. Ce travail se limitait cependant à la démonstration qu’une version constitutivement active d’un homologue humain de Toll pouvait induire l’expression de cytokines et de la molécule de costimulation CD80 dans des cellules transfectées. Les données cruciales montrant que les Toll-like receptors (TLR) jouent un rôle important dans la réponse aux infections et établissant le lien entre ces récepteurs et la détection de ligands microbiens furent obtenues par Bruce Beutler et ses collaborateurs. Bruce Beutler avait purifié et cloné le tumor necrosis factor (TNF) lors de ses premiers travaux scientifiques commencés après des études de médecine [
16]. Il avait par la suite développé des inhibiteurs recombinants du TNF qui ont conduit au développement de l’Etanercept, utilisé dans le traitement de maladies auto-immunes telles que les polyarthrites rhumatoïdes ou le psoriasis [
17,
35]. Ses études ont porté par la suite sur les mécanismes conduisant à l’induction du TNF, en particulier par le LPS. En effet, celui-ci déclenche une réponse inflammatoire qui peut aboutir à un choc septique à l’origine de nombreux décès [
18]. Les souris des souches C3H/HeJ et C57BL/10ScCr, qui sont insensibles au LPS, étaient particulièrement intéressantes. Bruce Beutler a alors entrepris le clonage positionnel du gène impliqué dans la résistance au LPS chez ces souris. Après des années d’efforts, ayant cartographié génétiquement le gène muté dans une région de 2,6 Mb, il n’a pas hésité à séquencer cette région sur ses propres deniers, ses crédits de recherche étant épuisés. Ce séquençage révéla la présence d’un gène apparenté à Toll dans la région, TLR4. En outre, des mutations inactivant le gène furent identifiées dans les deux souches C3H/HeJ et C57BL/10ScCr [
19]. Ce résultat indiqua que TLR4 joue un rôle essentiel dans la reconnaissance du LPS, faisant de ce récepteur jusque-là orphelin le premier bona fide PRR. C’est ce travail remarquable qui vient d’être récompensé par le Comité Nobel. La création et la caractérisation du phénotype de souris mutantes pour les récepteurs TLR2 et TLR4 par le groupe de Shizuo Akira à l’université d’Osaka confirmèrent un an plus tard que les TLR pouvaient induire NF-κB dans les cellules de mammifères en réponse à différents types de molécules microbiennes [
20]. Dès lors, le décor était planté pour une étude approfondie du rôle des TLR dans la détection des patterns microbiens. |
Structure et fonction des Toll-like receptors
Nous savons à présent que les TLR, au nombre d’une dizaine chez les mammifères, fonctionnent à la membrane plasmique, comme le récepteur du LPS TLR4, ou à partir des endosomes [
21,
36] (Figure 1). À la membrane plasmique, TLR2 est associé à TLR6 ou TLR1 pour reconnaître les lipopeptides di- ou tri-acylés, respectivement (Figure 1). TLR5 détecte, lui, une protéine microbienne, la flagelline. Plus précisément, TLR5 reconnaît un motif peptidique essentiel pour la construction du flagelle bactérien, ce qui explique qu’il soit difficile pour la bactérie de muter cette séquence afin d’échapper à la reconnaissance par le TLR. Dans le compartiment endosomal, d’autres TLR détectent les acides nucléiques : TLR3 interagit avec les ARN double brin, TLR7 et TLR8 reconnaissent les ARN simple brin riches en U, et TLR9 reconnaît les motifs d’ADN CpG non méthylés. Ces TLR jouent un rôle essentiel dans la détection des infections virales, comme le montre la susceptibilité aux encéphalites herpétiques d’enfants déficients en TLR3. Plusieurs TLR s’associent à des corécepteurs pour interagir avec leur ligand. C’est notamment le cas de la protéine fixant les lipides MD2 et de la protéine à répétitions riches en leucine CD14 qui s’associent à TLR4 pour reconnaître le LPS, ou du récepteur scavenger CD36 qui s’associe à TLR2 pour détecter les lipopeptides. En résumé, les TLR forment une famille de PRR, interagissant avec de nombreuses molécules microbiennes et induisant une réponse immunitaire innée [21]. La façon dont les TLR peuvent accommoder une palette de ligands aussi divers que des lipides, des protéines et des acides nucléiques est longtemps restée mystérieuse. En effet, tous les TLR ont la même organisation structurale, avec un ectodomaine composé de répétitions riches en leucine (LRR) et un domaine cytoplasmique de 150 acides aminés environ homologue à celui du récepteur de l’interleukine-1 (domaine TIR pour Toll/IL-1R). Comme tous les domaines LRR, l’ectodomaine des TLR forme une structure caractéristique en forme de fer à cheval. L’analyse structurale de quelques membres de la famille des TLR a montré une étonnante versatilité dans les interactions avec les ligands. Dans le cas de TLR1 et TLR2, les chaînes acyl des lipopeptides se logent dans des cavités hydrophobes situées sur la face convexe des deux sous-unités, induisant ainsi leur rassemblement. Dans le cas de TLR4, le ligand est un complexe formé par le LPS et la protéine globulaire MD2, qui abrite le lipide A du LPS dans une cavité hydrophobe. Le complexe se loge dans la surface concave du fer à cheval, interagissant avec les acides aminés de l’extrémité amino-terminale et la région centrale de l’ectodomaine de TLR4. Finalement, dans le cas de TLR3, la double hélice d’ARN interagit avec deux sites distincts proches des extrémités amino- et carboxy-terminales de l’ectodomaine [
22]. Bien que l’image qui se dégage de ces analyses structurales soit celle d’une grande diversité dans les stratégies d’interaction avec leur ligand, dans tous les cas les ligands induisent un rapprochement des extrémités carboxy-terminales des ectodomaines, qui déclenche la signalisation intracellulaire [
23]. |
TLR : de la biologie fondamentale aux applications Depuis le début des années 2000, le nombre de publications sur les récepteurs Toll-like a explosé. Même si il reste des zones d’ombre, par exemple en ce qui concerne le détail structural des interactions entre TLR5, TLR7, TLR9 et leurs ligands respectifs, l’interaction entre les TLR et les signaux de danger qui les activent, ou encore la régulation de la localisation subcellulaire des TLR et son impact sur la signalisation, nous avons aujourd’hui une vision assez complète de la fonction et de la régulation des récepteurs Toll/TLR [23]. Il est en particulier clair que les implications dans le domaine biomédical de ces travaux, au départ très fondamentaux, sont nombreuses. Le rôle des TLR dans la résistance aux infections chez l’homme a pu être établi dans le cas de TLR3, pour lequel des mutations perte de fonction prédisposent aux encéphalites herpétiques [
24]. Des mutations dans d’autres TLR ou dans des molécules impliquées dans la signalisation TLR (partagée avec les récepteurs de la famille de l’IL-1) sont associées à d’autres types d’infection, en particulier les bactéries à Gram positif [
25]. Ces exemples restent limités en nombre, ce qui peut s’expliquer par une redondance d’une part entre les TLR euxmêmes (une bactérie pouvant par exemple activer TLR4, TLR5 et TLR9) et d’autre part entre les TLR et d’autres PRR comme les NLR (nod-like receptor) [
26] ou les RLR (rig-1 like receptor) [
27]. Au-delà d’une meilleure compréhension des mécanismes de résistance/susceptibilité aux infections, les travaux sur les TLR ouvrent également des perspectives thérapeutiques dans au moins quatre domaines : l’immunothérapie, la vaccinologie, le contrôle de l’inflammation et l’auto-immunité. Dans le domaine de l’immunothérapie, la stimulation de l’immunité innée par le biais d’agonistes des TLR peut donner des résultats intéressants dans le cas de pathologies infectieuses ou de cancers. L’ALDARA ou imiquimod, un agoniste de TLR7 commercialisé par 3M est ainsi utilisé pour traiter les verrues génitales liées au virus du papillome humain, ou dans certaines applications anticancéreuses [
28]. Dans le domaine des vaccins, il est maintenant avéré que la stimulation des TLR joue un rôle important pour l’induction de la réponse immunitaire adaptative [
29]. Ces résultats ouvrent des perspectives intéressantes pour le développement de nouveaux adjuvants basés sur des agonistes de TLR [
30]. Une des motivations ayant conduit Bruce Beutler à l’identification du locus lps était de comprendre pourquoi les souris mutantes ne produisent pas de TNF et ne développent pas de choc septique lorsqu’elles sont stimulées avec des doses élevées de LPS. Le choc septique représente une cause de mortalité importante dans les pays industrialisés et il est maintenant avéré que dans un certain nombre de pathologies, comme la grippe, l’ampleur de la réponse inflammatoire (le fameux cytokine storm) occupe une place prépondérante dans la gravité des symptômes. Le développement d’antagoniste des TLR ou des molécules de signalisation agissant en aval pourrait permettre de juguler ces effets toxiques et de limiter les dégâts collatéraux causés par une inflammation trop forte [28]. Finalement, une activation inappropriée des TLR, en particulier des TLR endosomaux TLR7 et 9, semble jouer un rôle critique dans le déclenchement des maladies auto-immunes comme le lupus. En effet, des TLR peuvent aussi se lier à des composants du soi qui normalement ne sont pas exposés [
31]. |
Les travaux sur les récepteurs Toll ont été à l’origine de la renaissance de l’étude de l’immunité innée et ont engendré un champ de recherche particulièrement actif, par exemple sur les récepteurs intracellulaires et leur rôle dans le déclenchement de l’inflammation pathologique par l’intermédiaire des « inflammasomes » [
32]. Des progrès sont attendus dans la compréhension des mécanismes de reconnaissance des parasites par l’immunité innée. Il est vraisemblable que l’immunité innée sera la clé de la compréhension de l’allergie en permettant d’expliquer pourquoi telle molécule, par exemple une protéase, est allergénique. Un autre pan de recherche prometteur est celui de la tolérance aux infections, c’est-à-dire la capacité qu’a l’organisme à subir et réparer les dommages causés soit par l’infection, soit par sa propre réponse immunitaire. Quant aux insectes, ils ont encore beaucoup à nous apprendre, d’une part sur la manière dont ils servent de vecteurs pour des maladies humaines, et, plus fondamentalement, sur la nature moléculaire des interactions entre un organisme et les microbes, qu’ils soient commensaux, mutualistes ou pathogènes [
37,
38] (→). (→) Voir l’éditorial de F. Renaud, page 919 de ce numéro, et la synthèse de F. Vavre et P. Mavingui, page 953 de ce numéro.
|
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Nous remercions pour toutes les discussions stimulantes et les bons moments passés autour de Jules Hoffmann nos collègues, présents et anciens, qui ont contribué à l’étude des mécanismes de défense antimicrobienne chez la drosophile, en particulier Bruno Lemaitre, Julien Royet, Philippe Bulet, Danièle Hoffmann, Marie Meister, Marie Lagueux, Elena Levashina, Jean-Luc Dimarcq, Charles Hetru et Jean-Marc Reichhart. Nous remercions aussi C. Hetru pour son aide dans la réalisation de la figure.
|
1.
Anderson
KV
,
Bokla
L
,
Nusslein-Volhard
C
. Establishment of dorsal-ventral polarity in the Drosophila embryo: the induction of polarity by the Toll gene product . Cell.
1985; ; 42 : :791.–798. 2.
Janeway
C
. Evolution and revolution in immunology . Cold Spring Harbor Symposia Quant Biol.
1989; ; 54 : :1.–13. 3.
Matzinger
P
. Tolerance, danger, and the extended family . Annu Rev Immunol.
1994; ; 12 : :991.–1045. 4.
Steiner
H
,
Hultmark
D
,
Engstrom
A
, et al.
Sequence and specificity of two antibacterial proteins involved in insect immunity . Nature.
1981; ; 292 : :246.–248. 5.
Dimarcq
JL
,
Keppi
E
,
Dunbar
B
, et al.
Insect immunity. Purification and characterization of a family of novel inducible antibacterial proteins from immunized larvae of the dipteran Phormia terranovae and complete amino-acid sequence of the predominant member, diptericin A . Eur J Biochem.
1988; ; 171 : :17.–22. 6.
Engstrom
Y
,
Kadayalil
L
,
Sun
S
, et al.
kB-like motifs regulate the induction of immune genes in Drosophila . J Mol Biol.
1993; ; 232 : :327.–333. 7.
Kappler
C
,
Meister
M
,
Lagueux
M
, et al.
Insect immunity. Two 17bp repeats nesting a kB-related sequence confer inducibility to the diptericin gene and bind a polypeptide in bacteria-challenged Drosophila . EMBO J.
1993; ; 12 : :1561.–1568. 8.
Hoffmann
JA
,
Kafatos
FC
,
Janeway
CA
,
Ezekowitz
RA
. Phylogenetic perspectives in innate immunity .
Science
.
1999; ; 284 : :1313.–1318. 9.
Reichhart
J
,
Georgel
P
,
Meister
M
, et al.
Expression and nuclear translocation of the rel/NF-kB-related morphogen dorsal during the immune response of Drosophila . CR Acad Sci (Paris).
1993; ; 316 : :1218.–1224. 10.
Fehlbaum
P
,
Bulet
P
,
Michaut
L
, et al.
Insect immunity: septic injury of Drosophila induces the synthesis of a potent antifungal peptide with sequence homology to plant antifungal peptides . J Biol Chem.
1994; ; 269 : :33159.–33163. 11.
Lemaitre
B
,
Nicolas
E
,
Michaut
L
, et al.
The dorsoventral regulatory gene cassette spätzle/Toll/cactus controls the potent antifungal response in Drosophila adults . Cell.
1996; ; 86 : :973.–983. 12.
Rutschmann
S
,
Jung
A
,
Hetru
C
, et al.
The Rel protein DIF mediates the Toll-dependent antifungal response in Drosophila
. Immunity.
2000; ; 12 : :569.–580. 13.
Hedengren
M
,
Asling
B
,
Dushay
M
, et al.
Relish, a central factor in the control of humoral but not cellular immunity in Drosophila
. Mol Cell.
1999; ; 4 : :1.–20. 14.
Lemaitre
B
,
Kromer-Metzger
E
,
Michaut
L
, et al.
A recessive mutation, immune deficiency (imd), defines two distinct control pathways in the Drosophila host defense . Proc Natl Acad Sci USA.
1995; ; 92 : :9365.–9369. 15.
Medzhitov
R
,
Preston-Hurlburt
P
,
Janeway
C
. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity . Nature.
1997; ; 388 : :394.–397. 16.
Beutler
B
,
Greenwald
D
,
Hulmes
JD
, et al.
Identity of tumour necrosis factor and the macrophage-secreted factor cachectin . Nature.
1985; ; 316 : :552.–554. 17.
Peppel
K
,
Crawford
D
,
Beutler
B
. A tumor necrosis factor (TNF) receptor-IgG heavy chain chimeric protein as a bivalent antagonist of TNF activity . J Exp Med.
1991; ; 174 : :1483.–1489. 18.
Cerami
A
,
Beutler
B
. The role of cachectin/TNF in endotoxic shock and cachexia . Immunol Today.
1988; ; 9 : :28.–31. 19.
Poltorak
A
,
He
X
,
Smirnova
I
, et al.
Defective LPS signaling in C3H/HeJ and C57BL/10ScCr mice: mutations in Tlr4 gene . Science.
1998; ; 282 : :2085.–2088. 20.
Takeuchi
O
,
Hoshino
K
,
Kawai
T
, et al.
Differential roles of TLR2 and TLR4 in recognition of gram-negative and gram-positive bacterial cell wall components . Immunity.
1999; ; 11 : :443.–451. 21.
Kawai
T
,
Akira
S
. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors . Nat Immunol.
2010; ; 11 : :373.–384. 22.
Jin
MS
,
Lee
JO
. Structures of the toll-like receptor family and its ligand complexes . Immunity.
2008; ; 29 : :182.–191. 23.
Takeuchi
O
,
Akira
S
. Pattern recognition receptors and inflammation . Cell.
2010; ; 140 : :805.–820. 24.
Zhang
SY
,
Jouanguy
E
,
Ugolini
S
, et al.
TLR3 deficiency in patients with herpes simplex encephalitis . Science.
2007; ; 317 : :1522.–1527. 25.
Casanova
JL
,
Abel
L
,
Quintana-Murci
L
. Human TLRs and IL-1Rs in host defense: natural insights from evolutionary, epidemiological, and clinical genetics . Annu Rev Immunol.
2011; ; 29 : :447.–491. 26.
Philpott
DJ
,
Girardin
SE
. Nod-like receptors: sentinels at host membranes . Curr Opin Immunol.
2011; ; 22 : :428.–434. 27.
Yoneyama
M
,
Fujita
T
. Structural mechanism of RNA recognition by the RIG-I-like receptors . Immunity.
2008; ; 29 : :178.–181. 28.
Keogh
B
,
Parker
AE
. Toll-like receptors as targets for immune disorders . Trends Pharmacol Sci.
2011; ; 32 : :435.–442. 29.
Kasturi
SP
,
Skountzou
I
,
Albrecht
RA
, et al.
Programming the magnitude and persistence of antibody responses with innate immunity . Nature.
2011; ; 470 : :543.–547. 30.
Coffman
RL
,
Sher
A
,
Seder
RA
. Vaccine adjuvants: putting innate immunity to work . Immunity.
2010; ; 33 : :492.–503. 31.
Green
NM
,
Marshak-Rothstein
A
. Toll-like receptor driven B cell activation in the induction of systemic autoimmunity . Semin Immunol.
2011; ; 23 : :106.–112. 32.
Schroder
K
,
Tschopp
J
. The inflammasomes . Cell.
2010; ; 140 : :821.–832. 33.
Imler
JL
,
Reichhart
JM
. Immunité innée : deux récepteurs pour détecter l’ADN bactérien . Med Sci (Paris).
2001; ; 17 : :510.–512. 34.
Hoffmann
JA
,
Dimarcq
JL
,
Bulet
P
. Les peptides antibactériens inductibles des insectes . Med Sci (Paris).
1992; ; 8 : :432.–439. 35.
Sibilia
J
. Protéine de fusion ou anticorps monoclonal: quel biomédicament choisir dans une maladie inflammatoire . Med Sci (Paris).
2009; ; 25 : :1033.–1038. 36.
Delneste
Y
,
Beauvillain
C
,
Jeannin
P
. Immunité naturelle : structure et fonction des Toll-like receptors
. Med Sci (Paris).
2007; ; 23 : :67.–73. 37.
Vavre
F
,
Mavingui
P
. Les bactéries symbiotiques d’arthropodes et de nématodes : de nouvelles alliées dans le contrôle des maladies infectieuses . Med Sci (Paris).
2011; ; 27 : :953.–958. 38.
Renaud
F
. Vivre avec les pathogènes au XXIe siècle . Med Sci (Paris).
2011; ; 27 : :919.–920. |