| |
| Med Sci (Paris). 2011 November; 27(11): 993–999. Published online 2011 November 30. doi: 10.1051/medsci/20112711016.Le tissu adipeux Un nouveau terrain de jeu pour les cellules immunitaires Élise Dalmas,1 Joan Tordjman,1 Michèle Guerre-Millo,1 and Karine Clément1,2,3* 1Inserm U872, équipe 7, Université Pierre et Marie Curie-Paris 6, Centre de recherche des Cordeliers, 15, rue de l’École de médecine, F-75006Paris, France 2Assistance publique-Hôpitaux de Paris, Hôpital de la Pitié-Salpêtrière, département de nutrition et d’endocrinologie, Paris, F-75013France 3ICAN, Institut cardiométabolique et nutrition |
En 2003, deux équipes américaines décrivent une accumulation de macrophages dans le tissu adipeux de souris obèses et chez l’homme, en relation avec l’augmentation de l’indice de masse corporelle [
1,
2]. Les macrophages du tissu adipeux sont considérés comme une source majeure de facteurs pro-inflammatoires, ce qui leur confère un rôle potentiellement délétère au niveau local et systémique. Cependant, ces cellules sont particulièrement versatiles et peuvent adopter un profil anti-inflammatoire, ce qui ne permet pas d’exclure leur contribution physiologique à l’homéostasie du tissu adipeux. Depuis quelques années, la présence d’autres cellules immunitaires dans le tissu adipeux a été rapportée par plusieurs équipes, principalement dans les modèles murins d’obésité, mais également chez l’homme. Dans cette synthèse, nous montrons que ces invités inattendus, acteurs de l’immunité innée et adaptative, participent à la biologie du tissu adipeux et à ses altérations au cours du développement de l’obésité. |
Pourquoi le tissu adipeux est-il enflammé ? L’intervention de nombreux facteurs est évoquée, mais il reste difficile d’établir clairement le ou les événements à l’origine de l’inflammation dans le tissu adipeux. Les adipocytes eux-mêmes sont capables de produire de nombreuses biomolécules pro- ou anti-inflammatoires. L’accroissement de la taille des adipocytes, qui caractérise l’état obèse, altère leur profil de sécrétion et induit un statut pro-inflammatoire, alors que les signaux impliqués ne sont pas clairement définis. La répartition caractéristique des macrophages en couronne autour d’adipocytes présentant des signes de mort cellulaire [
3] (Figure 1) suggère l’intervention de facteurs attractants spécifiques. Dans le tissu adipeux, des signaux exogènes comme les acides gras ou les lipopolysaccharides (LPS) d’origine bactérienne induisent une réponse inflammatoire en activant le récepteur TLR4 (toll like receptor 4) et les voies de signalisation intracellulaires associées, principalement la voie NFκB [
4]. Localement, les adipocytes inflammatoires, dont l’activité lipolytique est élevée, libèrent des acides gras qui stimulent la voie TLR4/NFκB dans les macrophages, contribuant ainsi à une boucle paracrine délétère entre les deux types cellulaires [
5]. Dans ce contexte, l’inhibition de TLR4 par des facteurs tels que ATF3, facteur de transcription de la famille ATF/CREB, ou CTRP-3 (C1q/TNF[tumor necrosis factor]-related protein-3), membre de la famille C1q/TNF, pourrait représenter une cible thérapeutique pour contrôler l’inflammation du tissu adipeux [5,
6]. Récemment, un rôle anti-inflammatoire des acides gras omega 3 agissant via le récepteur GPR120 des macrophages a été identifié ; cette nouvelle approche reste à explorer [
7]. Parmi d’autres facteurs, l’hypoxie tissulaire, cause classique d’attraction des macrophages dans certaines tumeurs et dans la plaque d’athérome, pourrait aussi intervenir dans le déclenchement de l’inflammation du tissu adipeux chez les sujets obèses [
8]. Le stress du réticulum endoplasmique [
44] et le stress oxydant [
45] seraient aussi susceptibles d’intervenir dans l’inflammation locale. Les interactions entre ces différents types de stress cellulaire et les biomolécules de l’inflammation ouvrent tout un champ d’explorations au cours de l’évolution de l’obésité.
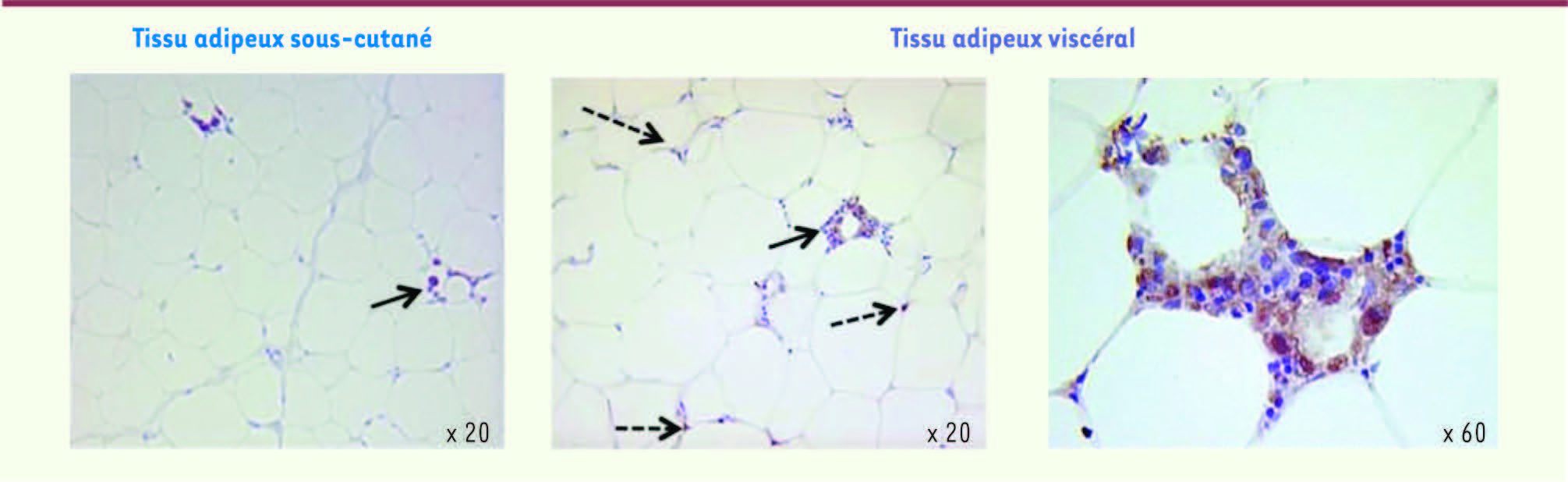
 | Figure 1.
Aspect microscopique des macrophages dans le tissu d’un sujet obèse. Des biopsies chirurgicales de tissu adipeux sous-cutané et viscéral ont été traitées par un anticorps spécifique des macrophages. Les flèches pleines indiquent les macrophages disposés en couronne autour d’un adipocyte ; les flèches pointillées indiquent les macrophages disposés à l’intersection des adipocytes dans le parenchyme. |
|
Lutte d’influence entre les cellules immunitaires dans le tissu adipeux L’inflammation intervient dans le tissu adipeux alors qu’aucun microorganisme pathogène n’a été clairement identifié à ce jour, ce qui permet de la qualifier d’inflammation « stérile ». Plusieurs observations chez la souris rendue obèse par un régime hyperlipidique (DIO, diet-induced obesity) sont en faveur de l’intervention d’antigènes non microbiens. Ainsi, l’infiltration précoce et transitoire de neutrophiles suggère qu’une inflammation « aiguë » précède l’apparition des macrophages dans ce modèle [
9]. Des cellules NKT (natural killer T), capables de reconnaître des antigènes glycolipidiques, colonisent également le tissu adipeux dans les premières phases de l’obésité, étape qui semble nécessaire à l’infiltration macrophagique [
10]. Dans un modèle murin (souris KitW-sh/W-sh
)1, l’absence de mastocytes réduit l’accumulation de macrophages dans le tissu adipeux. Comment ces cellules surtout impliquées dans l’allergie contribuent au processus inflammatoire du tissu adipeux reste à clarifier [
11]. Des lymphocytes, particulièrement des lymphocytes T, ont également été détectés dans le tissu adipeux chez la souris et chez l’homme (
Tableau I
). Des études cinétiques dans le modèle DIO révèlent que les lymphocytes T précèdent les macrophages dans le tissu adipeux [
12,
13]. De plus, les lymphocytes T CD4+ isolés du tissu adipeux de souris DIO expriment un répertoire TCR restreint, suggérant qu’ils puissent reconnaître un - ou des - antigènes d’origine adipeuse [
14].
Tableau I.
| Système immunitaire |
Cellules de l’immunité |
Marqueurs1
|
Effet de l’obésité |
Références |
| Type cellulaire |
Phénotype |
|
Inné
|
Macrophages |
|
CD68, CD14, F4/80 |
↑ |
[1-3,
23,
38,
40] |
|
M12
|
CD40, CD11c, CD86, Mincle |
↑ |
[
17,
27,
32,
33,
35,
36] |
|
M22
|
CD206, CD163, CD209 |
↑ ↔ |
[17, 27, 32] |
|
Mixte M1 M2 |
|
↑ |
[
29-
31] |
| Neutrophiles |
|
NIMP-R-14 |
↑ |
[9] |
| Mastocytes |
|
Tryptase, chymase |
↑ |
[11] |
|
Interface
|
NKT |
|
CD3 et CD56, NK1.1 |
↑ |
[10] |
|
Adaptatif
|
Lymphocytes T |
|
CD3 |
↑ |
[13-
16] |
|
Cytotoxiques |
CD3 et CD8 |
↑ |
[13, 14, 16] |
|
Auxiliaires |
CD3 et CD4 |
↑ ↓ |
[13, 14, 16] |
|
TH1 |
CD3 et CD4 et IFNγ |
↑ |
[14] |
|
TH2 |
CD3 et CD4 et Gata3 |
↔ |
[14] |
|
Treg
|
CD3 et CD4 et Foxp3, CD25 |
↓ |
[13-
15] |
Les cellules de l’immunité dans le tissu adipeux.
1Sélection de marqueurs couramment utilisés. 2Marqueurs d’activation M1 ou M2 associés aux marqueurs de macrophages, CD68 ou CD14 chez l’homme et F4/80 chez les rongeurs. |
On distingue plusieurs profils de mobilisation des lymphocytes T dans le tissu adipeux dans l’obésité : le nombre de lymphocytes T cytotoxiques (CD8+) augmente alors que celui des lymphocytes T anti-inflammatoires Th2 (CD4+GATA3+) et Treg (Foxp3+) diminue [13–15]. L’importance physiopathologique de ces changements est illustrée par le fait que l’inactivation des T CD8+ [13] ou l’induction des lymphocytes Th2 ou des Treg [14, 15] diminue l’inflammation dans le tissu adipeux des souris DIO. Chez l’homme, une étude montre l’augmentation des lymphocytes T CD8+ et lymphocytes CD4+ avec le degré d’adiposité dans le tissu adipeux [16]. L’ensemble de ces observations suggèrent l’existence d’un jeu complexe d’influence entre les différents acteurs cellulaires de l’immunité innée (neutrophiles, mastocytes), adaptative (lymphocytes) ou à l’interface des deux systèmes (NKT). Ces différents protagonistes semblent agir séquentiellement ou de concert pour favoriser in fine l’accumulation de macrophages dans le tissu adipeux par des mécanismes encore mal connus. Un enjeu majeur de ces études reste l’identification du ou des facteurs capables de déclencher une réponse immunitaire dans le tissu adipeux au cours des phases d’évolution de l’obésité humaine. |
D’où viennent les macrophages du tissu adipeux ? Les études de transplantation de moelle osseuse chez la souris ont clairement montré que les monocytes circulants sont les précurseurs de la majorité des macrophages présents dans le tissu adipeux [2], ce qui a été confirmé par des expériences de marquage des monocytes in vivo [17]. Plusieurs sous-populations de monocytes ont été décrites chez la souris et chez l’homme. Leur devenir dépend de leur phénotype, d’une part, et du microenvironnement dans lequel elles vont se différencier en macrophages, d’autre part. Chez la souris, les monocytes Gr1+Ly-6Chigh, équivalents des monocytes classiques CD14+CD16- chez l’homme, seraient les précurseurs des macrophages pro-inflammatoires du tissu adipeux [
18,
19]. Chez l’homme, des premiers travaux ont révélé que les cellules mononucléées circulantes expriment un statut pro-inflammatoire chez les sujets obèses [
20]. Plus récemment, une étude clinique indique que la fréquence d’une sous-population de monocytes CD14dimCD16+ récemment identifiée est augmentée chez des sujets en surpoids [
21]. Cette souspopulation monocytaire pourrait contribuer préférentiellement à l’accumulation des macrophages dans le tissu adipeux. Les mécanismes cellulaires et moléculaires qui favorisent le recrutement des monocytes via leur diapédèse à travers l’endothélium vasculaire sont peu explorés dans le tissu adipeux. Plusieurs molécules chémoattractantes peuvent intervenir, et un rôle important du système MCP-1/CCR2 (monocyte chemotactic protein 1 et son récepteur CCR2) dans l’accumulation des macrophages du tissu adipeux a été suggéré par l’étude de modèles murins [
22]. Les adipocytes eux-mêmes produisent des facteurs solubles qui augmentent la diapédèse monocytaire et stimulent la production de protéines d’adhésion, dont PECAM-1 (platelet endothelial cell adhesion molecule) et ICAM-1 (intercellular adhesion molecule) exprimées sur les cellules endothéliales [23]. Nos travaux montrent que la cytokine CCL5 (alias RANTES [regulated upon activation, normal T cell expressed and secreted]) pourrait contribuer à ce processus [
24]. Il s’avère que les cellules endothéliales sont plus inflammatoires dans le tissu adipeux viscéral que dans le tissu adipeux superficiel, ce qui pourrait favoriser le recrutement des monocytes dans les tissus profonds [
25]. Clairement, d’autres études sont nécessaires pour définir le spectre complet des facteurs contribuant à la diapédèse des monocytes et à l’activation endothéliale dans le tissu adipeux au cours de l’obésité. |
Les macrophages du tissu adipeux : un phénotype variable et complexe Il existe un large spectre phénotypique de macrophages, mais on distingue surtout deux catégories suivant une classification qui s’apparente à celle des lymphocytes Th1/Th2 : les macrophages M1 activés par la voie classique et les macrophages M2 qui utilisent une voie alterne d’activation [
46]. Comme pour d’autres types cellulaires, cette classification repose en partie sur l’expression de marqueurs dont la spécificité reste souvent imprécise (Tableau I). Les macrophages M1 sont stimulés par le LPS, l’interféron-γ et le TNF-α et produisent des cytokines pro-inflammatoires comme l’IL(interleukine)-6 et l’IL-1. Les macrophages M2 sont induits par l’IL-4 et IL-13 et, via la production de facteurs tels que l’IL-10 et le TGF-β (transforming growth factor), ont un effet anti-inflammatoire. À ces phénotypes sont associées des fonctions distinctes : élimination des pathogènes et induction d’inflammation pour les macrophages M1, angiogenèse et réparation tissulaire pour les macrophages M2. Qu’en est-il dans le tissu adipeux ? L’injection d’un marqueur spécifique des monocytes chez la souris a permis de montrer que l’obésité (modèle DIO) provoque le recrutement de macrophages M1, qui sont ceux qui s’organisent en couronne autour des adipocytes [
26]. Ces macrophages sont chargés en gouttelettes lipidiques, qui témoignent de leur activité de phagocytose des lipides [1, 3]. En l’absence d’obésité, des macrophages résidents sont également détectés dans le tissu adipeux. Ils présentent un phénotype de type M2 et leur nombre n’est pas ou peu modifié dans l’obésité [26, 27]. Une étude cinétique dans le modèle DIO suggère une situation plus complexe : l’accumulation de macrophages de type M1 se poursuit jusqu’à 16 semaines de régime puis diminue au profit de macrophages de type M2, sans que l’on sache s’il s’agit d’un recrutement ou d’une repolarisation de ces macrophages in situ [
28]. De plus, une troisième population de phénotype intermédiaire M1/M2 a été identifiée dans le tissu adipeux de souris DIO ; elle pourrait constituer un groupe de cellules en cours de repolarisation [29]. Dans le tissu adipeux humain, les macrophages sont essentiellement de phénotype mixte intermédiaire entre les états de polarisation M1 et M2 [
30, 31]. Dans une population de sujets massivement obèses, nous avons observé une augmentation du nombre des cellules positives pour le marqueur CD40 et un nombre constant de cellules exprimant des marqueurs de type M2 (CD206 [mannose receptor] et CD163 [membre de la famille des scavenger receptors]) par rapport à des sujets témoins, suggérant que l’obésité favorise l’accumulation de macrophages de type M1 [32]. Une caractérisation plus précise montre que, comme chez la souris, les macrophages disposés en couronne autour des adipocytes présentent un phénotype de type M1, alors que les macrophages interstitiels ont un phénotype orienté M2 [33,
34]. Chez l’homme, cependant, il est impossible de distinguer les macrophages recrutés des macrophages résidents. Les lipides activateurs de la voie TLR4/NFκB [35] ou l’accumulation de lipides dans les macrophages eux-mêmes [36] favorisent la polarisation M1 dans le tissu adipeux des souris DIO. De manière surprenante, l’augmentation de la capacité de stockage des triglycérides dans les macrophages via la surexpression de la diacylglycérol acyltransférase 1 (DGAT1) les rend résistants à une activation M1 [
37]. Ce phénotype s’explique par le fait que les triglycérides seraient moins pro-inflammatoires que certaines autres espèces lipidiques dans les macrophages. L’ensemble de ces travaux chez la souris et chez l’homme révèlent la complexité et l’aspect évolutif du phénotype des macrophages du tissu adipeux dans l’obésité (Figure 2), une situation certainement associée à des aspects fonctionnels qui restent à clarifier.
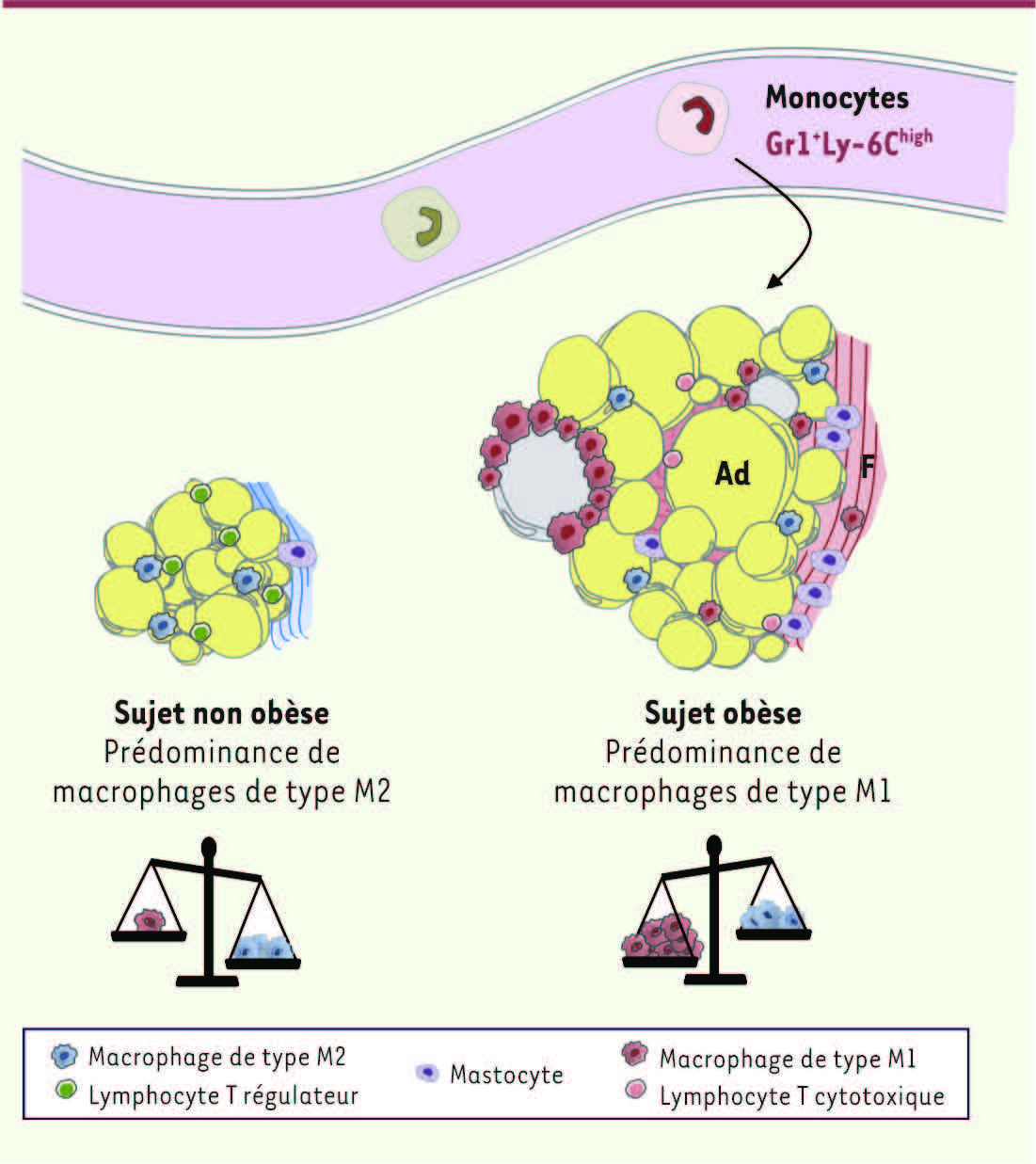
 | Figure 2.
Altérations cellulaires et structurales du tissu adipeux induites par l’obésité. Chez les souris non obèses, les macrophages résidents ont un phénotype de type M2. Des lymphocytes Treg sont présents, particulièrement dans les tissus profonds. Dans le modèle DIO, l’obésité induit le recrutement de monocytes inflammatoires de phénotype Gr1 +Ly-6C high, qui seraient les précurseurs de macrophages de type M1. Ces macrophages recrutés sont disposés en couronne autour d’adipocytes présentant des caractéristiques de mort cellulaire. Les mécanismes impliqués sont divers et complexes et pourraient mettre en jeu la contribution d’autres cellules de l’immunité, dont les lymphocytes cytotoxiques. La présence d’une fibrose a été décrite principalement dans le tissu adipeux humain (voir
Figure 3). Plusieurs types cellulaires sont associés aux zones fibrotiques, dont des macrophages et des mastocytes. Ad : adipocytes ; F : fibrose. |
|
Les macrophages du tissu adipeux : amis ou ennemis ? La question du rôle des macrophages dans les complications métaboliques de l’obésité s’est rapidement posée. Dans les modèles murins, l’abondance des macrophages peut être modifiée dans le tissu adipeux par des moyens pharmacologiques ou via des manipulations génétiques ciblées, ce qui a permis d’établir l’importance de ces cellules dans l’induction d’une insulinorésistance. Chez l’homme, en revanche, cette relation reste plutôt controversée. Certaines études rapportent une relation inverse entre la sensibilité à l’insuline et l’expression de marqueurs de macrophages dans le tissu adipeux, particulièrement dans le tissu adipeux viscéral [38]. La présence accrue de macrophages en couronne a également été associée à l’altération de la sensibilité à l’insuline [
39]. À l’inverse, nos travaux ne permettent pas d’établir de relation entre l’abondance des macrophages et les paramètres sanguins de l’homéostasie glucidique chez des sujets très obèses [40]. L’association entre l’abondance d’une fraction minoritaire de macrophages de phénotype mixte et l’insulinorésistance a été rapportée, suggérant qu’une analyse précise des phénotypes pourrait permettre de distinguer des types de macrophages plus délétères que d’autres [33]. Bien que fortement soupçonné, un lien entre l’accumulation macrophagique et l’augmentation du risque cardiovasculaire n’a pu être établi chez l’homme. En revanche, nos études cliniques dans une large population de sujets massivement obèses révèlent que la gravité de l’histopathologie hépatique (stéatose et fibrose inflammatoire) est liée à l’ampleur de l’accumulation macrophagique dans le tissu adipeux viscéral, indépendamment du statut glycémique [40]. Les facteurs qui relaient les signaux pro-inflammatoires du tissu adipeux viscéral vers le foie sont en cours d’identification. Les macrophages peuvent-ils contribuer à maintenir l’homéostasie du tissu adipeux face aux changements du bilan énergétique ? Une étude cinétique au cours de la perte de poids chez la souris DIO permet de répondre en partie à cette question. En effet, contrairement à l’hypothèse initiale, une accumulation importante de macrophages a été observée dans le tissu adipeux lors des phases précoces d’une restriction calorique, au moment où la lipolyse adipocytaire est stimulée. Ces macrophages exercent une activité de phagocytose des lipides sans déclencher d’inflammation, et contribuent ainsi à restaurer localement l’homéostasie lipidique [
41]. D’autres observations chez la souris suggèrent que la présence de macrophages pourrait contribuer à contenir l’hypertrophie adipocytaire. Cette possibilité est évoquée pour rendre compte du phénotype des souris déficientes pour le gène CCR2, qui code pour le récepteur de MCP1 : elles présentent une diminution du nombre des macrophages associée à une augmentation du diamètre adipocytaire [26]. Il faut noter que les adipocytes étant les seules cellules de l’organisme capables de stocker efficacement et sans dommage l’excès d’apport calorique sous forme de triglycérides, la limitation de leur expansion peut se révéler plus néfaste que bénéfique en favorisant les dépôts ectopiques dans d’autres organes non spécialisés tels que le foie. |
La fibrose, une nouvelle conséquence de l’inflammation du tissu adipeux Associé à une inflammation chronique, le remodelage de la matrice extracellulaire peut aboutir à une accumulation anormale d’éléments matriciels qui caractérise la fibrose. C’est effectivement ce qui se produit dans le tissu adipeux humain, où nous avons détecté récemment la présence de dépôts fibrotiques en amas denses ou en travées [
42]. Chez le sujet obèse, il existe également de la fibrose péricellulaire entourant les adipocytes (Figure 3). Les macrophages sont considérés comme des régulateurs majeurs de la fibrose dans différents tissus où ils exercent des rôles pro- ou antifibrotiques suivant leur phénotype. In vitro, le milieu conditionné de macrophages M1 activés par le LPS ou isolés du tissu adipeux de sujets obèses confère un phénotype profibrotique aux préadipocytes humains [
43]. Ces observations suggèrent un rôle plutôt profibrotique des macrophages du tissu adipeux chez les sujets obèses.
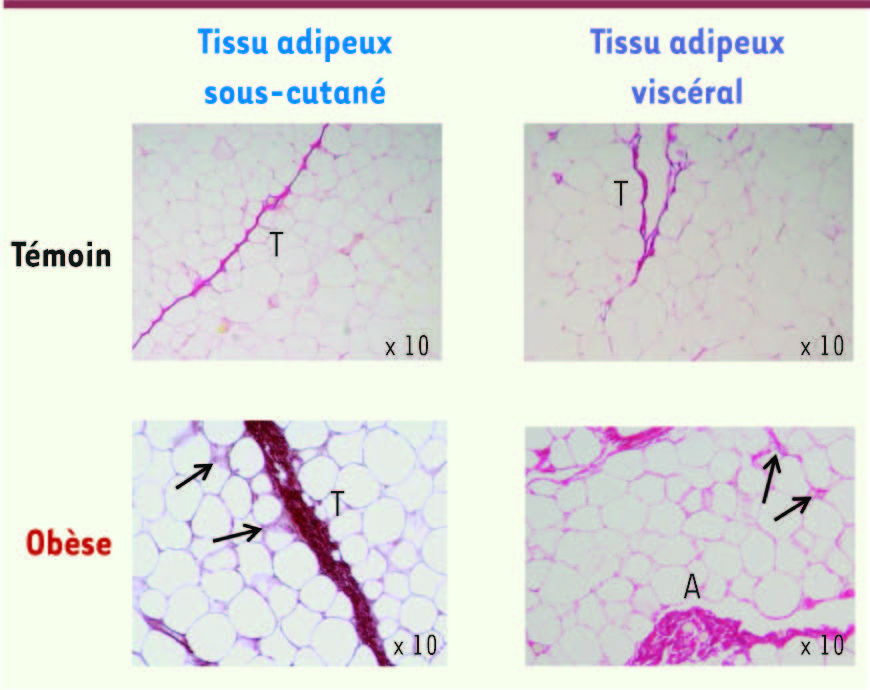
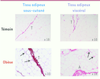 | Figure 3.
Aspect microscopique des dépôts de fibrose dans le tissu adipeux humain. Des biopsies chirurgicales de tissu adipeux sous-cutané et viscéral ont été marquées au rouge picrosirius (marqueur des collagènes) pour révéler les zones fibrotiques. A : amas ; T : travée. Les flèches localisent la fibrose péricellulaire présente uniquement chez les sujets obèses. |
Quelles sont les conséquences de la présence de fibrose dans le tissu adipeux ? Dans notre étude chez des sujets obèses, nous observons que plus la quantité de fibrose est faible, plus les sujets perdent de la masse grasse en réponse à la chirurgie gastrique. La présence de fibrose en excès pourrait altérer le remodelage du tissu adipeux et potentiellement les adaptations métaboliques qui interviennent au cours de la perte de poids rapide et drastique induite dans ce modèle [42]. Élucider les acteurs cellulaires et moléculaires de la fibrose et ses conséquences locales ou systémiques est un nouveau défi dans le domaine de l’obésité. |
Dans l’obésité, le tissu adipeux blanc est la cible d’un remaniement cellulaire et structural majeur dont les composants ne sont probablement pas encore tous identifiés. Les types cellulaires et les signaux impliqués sont multiples et complexes, créant localement un microenvironnement pro-inflammatoire qui favorise le recrutement de macrophages et la formation de fibrose. La cinétique de ces altérations est également mal connue au cours des différentes phases du développement de l’obésité. Bien que partiellement réversibles, certaines de ces altérations persistent après une perte de poids. L’identification des mécanismes potentiellement protecteurs, tels que la neutralisation immunologique de certains types de lymphocytes ou encore le contrôle transcriptionnel de l’inflammation, pourrait ouvrir de nouvelles perspectives thérapeutiques visant à contenir l’inflammation dans le tissu adipeux. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient la Commission Européenne (6th framework program Hepadip; 7th framework programs ADAPT, FLIP) et la Région île-de-France (CODDIM) qui soutiennent financièrement leur recherche dans le domaine de l’obésité et de l’inflammation.
|
Footnotes |
-
Xu
H
,
Barnes
GT
,
Yang
Q
, et al.
Chronic inflammation in fat plays a crucial role in the development of obesity-related insulin resistance . J Clin Invest.
2003; ; 112 : :1821.–1830.
-
Weisberg
SP
,
McCann
D
,
Desai
M
, et al.
Obesity is associated with macrophage accumulation in adipose tissue . J Clin Invest.
2003; ; 112 : :1796.–1808.
-
Cinti
S
,
Mitchell
G
,
Barbatelli
G
, et al.
Adipocyte death defines macrophage localization and function in adipose tissue of obese mice and humans . J Lipid Res.
2005; ; 46 : :2347.–2355.
-
Shi
H
,
Kokoeva
MV
,
Inouye
K
, et al.
TLR4 links innate immunity and fatty acid-induced insulin resistance . J Clin Invest.
2006; ; 116 : :3015.–3025.
-
Suganami
T
,
Yuan
X
,
Shimoda
Y
, et al.
Activating transcription factor 3 constitutes a negative feedback mechanism that attenuates saturated fatty acid/toll-like receptor 4 signaling and macrophage activation in obese adipose tissue . Circ Res.
2009; ; 105 : :25.–32.
-
Kopp
A
,
Bala
M
,
Buechler
C
, et al.
C1q/TNF-related protein-3 represents a novel and endogenous lipopolysaccharide antagonist of the adipose tissue . Endocrinology.
2010; ; 151 : :5267.–5278.
-
Oh da
Y
,
Talukdar
S
,
Bae
EJ
, et al.
GPR120 is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulin-sensitizing effects . Cell.
2010; ; 142 : :687.–698.
-
Ye
J
. Emerging role of adipose tissue hypoxia in obesity and insulin resistance . Int J Obes (Lond).
2009; ; 33 : :54.–66.
-
Elgazar-Carmon
V
,
Rudich
A
,
Hadad
N
,
Levy
R
. Neutrophils transiently infiltrate intra-abdominal fat early in the course of high-fat feeding . J Lipid Res.
2008; ; 49 : :1894.–1903.
-
Ohmura
K
,
Ishimori
N
,
Ohmura
Y
, et al.
Natural killer T cells are involved in adipose tissues inflammation and glucose intolerance in diet-induced obese mice . Arterioscler Thromb Vasc Biol.
2010; ; 30 : :193.–199.
-
Liu
J
,
Divoux
A
,
Sun
J
, et al.
Genetic deficiency and pharmacological stabilization of mast cells reduce diet-induced obesity and diabetes in mice . Nat Med.
2009; ; 15 : :940.–945.
-
Kintscher
U
,
Hartge
M
,
Hess
K
, et al.
T-lymphocyte infiltration in visceral adipose tissue: a primary event in adipose tissue inflammation and the development of obesity-mediated insulin resistance . Arterioscler Thromb Vasc Biol.
2008; ; 28 : :1304.–1310.
-
Nishimura
S
,
Manabe
I
,
Nagasaki
M
, et al.
CD8+ effector T cells contribute to macrophage recruitment and adipose tissue inflammation in obesity . Nat Med.
2009; ; 15 : :914.–920.
-
Winer
S
,
Chan
Y
,
Paltser
G
, et al.
Normalization of obesity-associated insulin resistance through immunotherapy . Nat Med.
2009; ; 15 : :921.–929.
-
Feuerer
M
,
Herrero
L
,
Cipolletta
D
, et al.
Lean, but not obese, fat is enriched for a unique population of regulatory T cells that affect metabolic parameters . Nat Med.
2009; ; 15 : :930.–939.
-
Duffaut
C
,
Zakaroff-Girard
A
,
Bourlier
V
, et al.
Interplay between human adipocytes and T lymphocytes in obesity: CCL20 as an adipochemokine and T lymphocytes as lipogenic modulators . Arterioscler Thromb Vasc Biol.
2009; ; 29 : :1608.–1614.
-
Lumeng
CN
,
Deyoung
SM
,
Bodzin
JL
,
Saltiel
AR
. Increased inflammatory properties of adipose tissue macrophages recruited during diet-induced obesity . Diabetes.
2007; ; 56 : :16.–23.
-
Tsou
CL
,
Peters
W
,
Si
Y
, et al.
Critical roles for CCR2 and MCP-3 in monocyte mobilization from bone marrow and recruitment to inflammatory sites . J Clin Invest.
2007; ; 117 : :902.–909.
-
Westcott
DJ
,
Delproposto
JB
,
Geletka
LM
, et al.
MGL1 promotes adipose tissue inflammation and insulin resistance by regulating 7/4hi monocytes in obesity . J Exp Med.
2009; ; 206 : :3143.–3156.
-
Ghanim
H
,
Aljada
A
,
Hofmeyer
D
, et al.
Circulating mononuclear cells in the obese are in a proinflammatory state . Circulation.
2004; ; 110 : :1564.–1571.
-
Rogacev
KS
,
Ulrich
C
,
Blomer
L
, et al.
Monocyte heterogeneity in obesity and subclinical atherosclerosis . Eur Heart J.
2010; ; 31 : :369.–376.
-
Sell
H
,
Eckel
J
. Monocyte chemotactic protein-1 and its role in insulin resistance . Curr Opin Lipidol.
2007; ; 18 : :258.–262.
-
Curat
CA
,
Miranville
A
,
Sengenes
C
, et al.
From blood monocytes to adipose tissue-resident macrophages: induction of diapedesis by human mature adipocytes . Diabetes.
2004; ; 53 : :1285.–1292.
-
Keophiphath
M
,
Rouault
C
,
Divoux
A
, et al.
CCL5 promotes macrophage recruitment and survival in human adipose tissue . Arterioscler Thromb Vasc Biol.
2010; ; 30 : :39.–45.
-
Villaret
A
,
Galitzky
J
,
Decaunes
P
, et al.
Adipose tissue endothelial cells from obese human subjects: differences among depots in angiogenic, metabolic, and inflammatory gene expression and cellular senescence . Diabetes.
2010; ; 59 : :2755.–2763.
-
Lumeng
CN
,
Bodzin
JL
,
Saltiel
AR
. Obesity induces a phenotypic switch in adipose tissue macrophage polarization . J Clin Invest.
2007; ; 117 : :175.–184.
-
Fujisaka
S
,
Usui
I
,
Bukhari
A
, et al.
Regulatory mechanisms for adipose tissue M1 and M2 macrophages in diet-induced obese mice . Diabetes.
2009; ; 58 : :2574.–2582.
-
Strissel
KJ
,
Stancheva
Z
,
Miyoshi
H
, et al.
Adipocyte death, adipose tissue remodeling, and obesity complications . Diabetes.
2007; ; 56 : :2910.–2918.
-
Shaul
ME
,
Bennett
G
,
Strissel
KJ
, et al.
Dynamic, M2-like remodeling phenotypes of CD11c+ adipose tissue macrophages during high-fat diet : induced obesity in mice . Diabetes.
2010; ; 59 : :1171.–1181.
-
Zeyda
M
,
Farmer
D
,
Todoric
J
, et al.
Human adipose tissue macrophages are of an anti-inflammatory phenotype but capable of excessive pro-inflammatory mediator production . Int J Obes (Lond).
2007; ; 31 : :1420.–1428.
-
Bourlier
V
,
Zakaroff-Girard
A
,
Miranville
A
, et al.
Remodeling phenotype of human subcutaneous adipose tissue macrophages . Circulation.
2008; ; 117 : :806.–815.
-
Aron-Wisnewsky
J
,
Tordjman
J
,
Poitou
C
, et al.
Human adipose tissue macrophages: m1 and m2 cell surface markers in subcutaneous and omental depots and after weight loss . J Clin Endocrinol Metab.
2009; ; 94 : :4619.–4623.
-
Wentworth
JM
,
Naselli
G
,
Brown
WA
, et al.
Pro-inflammatory CD11c+CD206+ adipose tissue macrophages are associated with insulin resistance in human obesity . Diabetes.
2010; ; 59 : :1648.–1656.
-
Spencer
M
,
Yao-Borengasser
A
,
Unal
R
, et al.
Adipose tissue macrophages in insulin resistant subjects are associated with collagen VI, fibrosis and demonstrate alternative activation . Am J Physiol Endocrinol Metab.
2010; ; 299 : :E1016.–E1027.
-
Ichioka
M
,
Suganami
T
,
Tsuda
N
, et al.
Increased expression of macrophage-inducible C-type lectin in adipose tissue of obese mice and humans . Diabetes.
2011; ; 60 : :819.–826.
-
Prieur
X
,
Mok
CY
,
Velagapudi
VR
, et al.
Differential lipid partitioning between adipocytes and tissue macrophages modulates macrophage lipotoxicity and m2/m1 polarization in obese mice . Diabetes.
2011; ; 60 : :797.–809.
-
Koliwad
SK
,
Streeper
RS
,
Monetti
M
, et al.
DGAT1-dependent triacylglycerol storage by macrophages protects mice from diet-induced insulin resistance and inflammation . J Clin Invest.
2010; ; 120 : :756.–767.
-
Harman-Boehm
I
,
Bluher
M
,
Redel
H
, et al.
Macrophage infiltration into omental versus subcutaneous fat across different populations: effect of regional adiposity and the comorbidities of obesity . J Clin Endocrinol Metab.
2007; ; 92 : :2240.–2247.
-
Apovian
CM
,
Bigornia
S
,
Mott
M
, et al.
Adipose macrophage infiltration is associated with insulin resistance and vascular endothelial dysfunction in obese subjects . Arterioscler Thromb Vasc Biol.
2008; ; 28 : :1654.–1659.
-
Tordjman
J
,
Poitou
C
,
Hugol
D
, et al.
Association between omental adipose tissue macrophages and liver histopathology in morbid obesity: influence of glycemic status . J Hepatol.
2009; ; 51 : :354.–362.
-
Kosteli
A
,
Sugaru
E
,
Haemmerle
G
, et al.
Weight loss and lipolysis promote a dynamic immune response in murine adipose tissue . J Clin Invest.
2010; ; 120 : :3466.–3479.
-
Divoux
A
,
Tordjman
J
,
Lacasa
D
, et al.
Fibrosis in human adipose tissue: composition, distribution, and link with lipid metabolism and fat mass loss . Diabetes.
2010; ; 59 : :2817.–2825.
-
Keophiphath
M
,
Achard
V
,
Henegar
C
, et al.
Macrophage-secreted factors promote a profibrotic phenotype in human preadipocytes . Mol Endocrinol.
2009; ; 23 : :11.–24.
-
Foufelle
F
,
Ferré
P
. La réponse UPR : son rôle physiologique et physiopathologique . Med Sci (Paris).
2007; ; 23 : :291.–296.
-
Migdal
C
,
Serres
M
. Espèces réactives de l’oxygène et stress oxydant . Med Sci (Paris).
2011; ; 27 : :405.–412.
-
Mege
JL
,
Capo
C
. La polarisation des macrophages, le nœud gordien des infections bactériennes ?
Med Sci (Paris).
2010; ; 26 : :83.–88.
|