| |
| Med Sci (Paris). 2011 November; 27(11): 935–938. Published online 2011 November 30. doi: 10.1051/medsci/20112711007.Les cellules souches redonnent de la couleur à la peau Une nouvelle source de mélanocytes pour la recherche clinique des pathologies pigmentaires Xavier Nissan,1 Gilles Lemaitre,1 Marc Peschanski,1 and Christine Baldeschi1* 1Inserm/UEVE UMR-861, ISTEM, AFM, Institut des cellules souches pour le traitement et l’étude des maladies monogéniques; 5, rue Henri Desbruères, 91030Évry Cedex, France MeSH keywords: Différenciation cellulaire, Phénomènes chronobiologiques, physiologie, Développement embryonnaire, Humains, Mélanocytes, cytologie, Modèles biologiques, Troubles de la pigmentation, thérapie, Cellules souches pluripotentes, Peau, embryologie, Pigmentation de la peau, Transplantation de cellules souches, méthodes, utilisation |
Plus qu’une simple enveloppe, la peau est un organe à part entière. Elle protège les autres organes des agressions extérieures en formant une solide barrière continue. L’une de ses principales fonctions est d’éviter la déshydratation en assurant le maintien de la température corporelle et en protégeant le corps des agressions chimiques, des infections et des rayons UV (ultraviolets). Cette dernière tâche est principalement assurée par un type cellulaire spécialisé localisé dans la couche basale de l’épiderme, les mélanocytes, qui représentent 5 % des cellules de l’épiderme. Les mélanocytes ont pour principales fonctions de produire et de libérer de la mélanine pour protéger les kératinocytes, des effets mutagènes des rayons UV du spectre solaire ainsi que de pigmenter l’épiderme de manière uniforme. Il existe de nombreuses pathologies associées à une atteinte de la pigmentation dont l’origine peut être génique, telles que l’albinisme ou le syndrome de Griscelli, ou non, telle que le vitiligo. |
La thérapie cellulaire de l’hypopigmentation Des stratégies de greffe cellulaire sont actuellement à l’étude, pour l’essentiel dans le vitiligo. Cette approche de greffe autologue consiste à utiliser comme ressource biologique les zones normalement pigmentées en dehors des régions affectées. Son but est de reconstituer le compartiment mélanocytaire du tissu épidermique. Dans certains cas, ce sont les mélanocytes épidermiques qui sont préalablement isolés puis cultivés pour en augmenter le nombre avant d’être réinjectés sur des petites surfaces de la peau. Dans d’autres, il s’agit plus simplement d’autogreffes épidermiques. Une fois greffés, les mélanocytes migrent, progressant de manière centrifuge à partir de l’implant pigmenté vers la peau lésionnelle, et permettent la repigmentation dans des délais variant de 3 à 6 mois. La thérapie cellulaire de l’hypopigmentation par autogreffe est donc aujourd’hui une réalité clinique. Elle présente toutefois des limites qui en réduisent assez nettement l’intérêt. L’autogreffe, tout d’abord, n’est pertinente que s’il existe des régions non atteintes, ce qui est le cas du vitiligo mais pas de nombreuses autres pathologies, notamment d’origine génétique. Les techniques provoquent d’autre part l’épuisement des sites donneurs. Or, la durée de vie des mélanocytes adultes après leur implantation semble limitée à moins d’un an, ce qui restreint les possibilités de traitement tant en surface qu’en nombre de réapplications [
1]. La mise en place de stratégies alternatives fondées sur des approches allogéniques apparaît donc nécessaire, et le concept d’une production de cellules thérapeutiques en laboratoire à partir de cellules souches pluripotentes est bien évidemment à l’ordre du jour. Il n’est pas utile de rappeler aux lecteurs de médecine/sciences que les cellules souches pluripotentes - qu’elles soient d’origine embryonnaire ou induites par reprogrammation génique - possèdent deux propriétés fondamentales, l’autorenouvellement illimité et la capacité de se différencier dans n’importe lequel des types cellulaires de l’organisme. Ainsi, on peut envisager, à condition d’identifier le protocole de différenciation adapté, de produire à la demande à partir de cellules souches pluripotentes des populations homogènes et fonctionnelles de mélanocytes que l’on pourrait ensuite appliquer - et réappliquer en tant que de besoin - aux patients (sous réserve de compatibilité immunitaire, bien sûr). À ce jour trois laboratoires avaient effectivement réussi à identifier des mélanocytes dans la descendance de cellules souches embryonnaires murines [
2] ou humaines [
3], et, très récemment, de cellules iPS (induced pluripotent stem cells) humaines [
4]. Ces protocoles ne permettaient toutefois pas d’obtenir des populations homogènes massives de mélanocytes parce qu’ils passaient obligatoirement par une étape de formation de corps embryoïdes, dans lesquels les mélanocytes sont extrêmement minoritaires et doivent être sélectionnés parmi les cellules représentatives de tous les feuillets embryonnaires qui y coexistent. L’apport de cytokines comme l’endothéline 3, Wnt3a et le SCF (stem cell factor) permettait de pousser la différenciation dans le lignage mélanocytaire mais au prix d’un passage accéléré à une différenciation terminale peu propice à l’amplification cellulaire. Notre équipe vient d’identifier un protocole de différenciation séquentiel qui permet de différencier des cellules souches pluripotentes, sans passage par l’étape de formation des corps embryoïdes, en une population pure et homogène de mélanocytes, capables de produire de la mélanine et de s’intégrer dans la couche basale d’un épiderme pluristratifié [
5]. |
Un protocole de différenciation fondé sur la chronobiologie de l’ontogenèse Comme nous l’avions fait avec succès pour la différenciation kératinocytaire, nous avons fondé notre étude sur l’analyse de données publiées décrivant les mécanismes moléculaires impliqués dans le développement embryonnaire du lignage mélanocytaire. C’est ainsi que nous nous sommes intéressés à la voie des BMP (bone morphogenic proteins), l’un des éléments-clés de la différenciation des crêtes neurales dont dérivent les mélanoblastes, précurseurs des mélanocytes [
6] (Figure 1). La différenciation des mélanoblastes en mélanocytes - qui se traduit par l’acquisition de la morphologie dendritique et de la synthèse de mélanine - se produit chez l’homme entre la 8e et la 14e semaine de gestation. Elle s’effectue sous le contrôle des voies Wnt/β-caténine [
7] et Notch [
8] et de certains gènes plus ou moins spécifiques, souvent révélés par des pathologies génétiques dans lesquelles leur déficience aboutit à un phénotype mélanocytaire. Citons MITF (microphthalmia-associated transcription factor), PAX3 (paired box 3), SOX10 (sex determining region Y-box 10), ou encore les cytokines citées plus haut et leurs récepteurs.
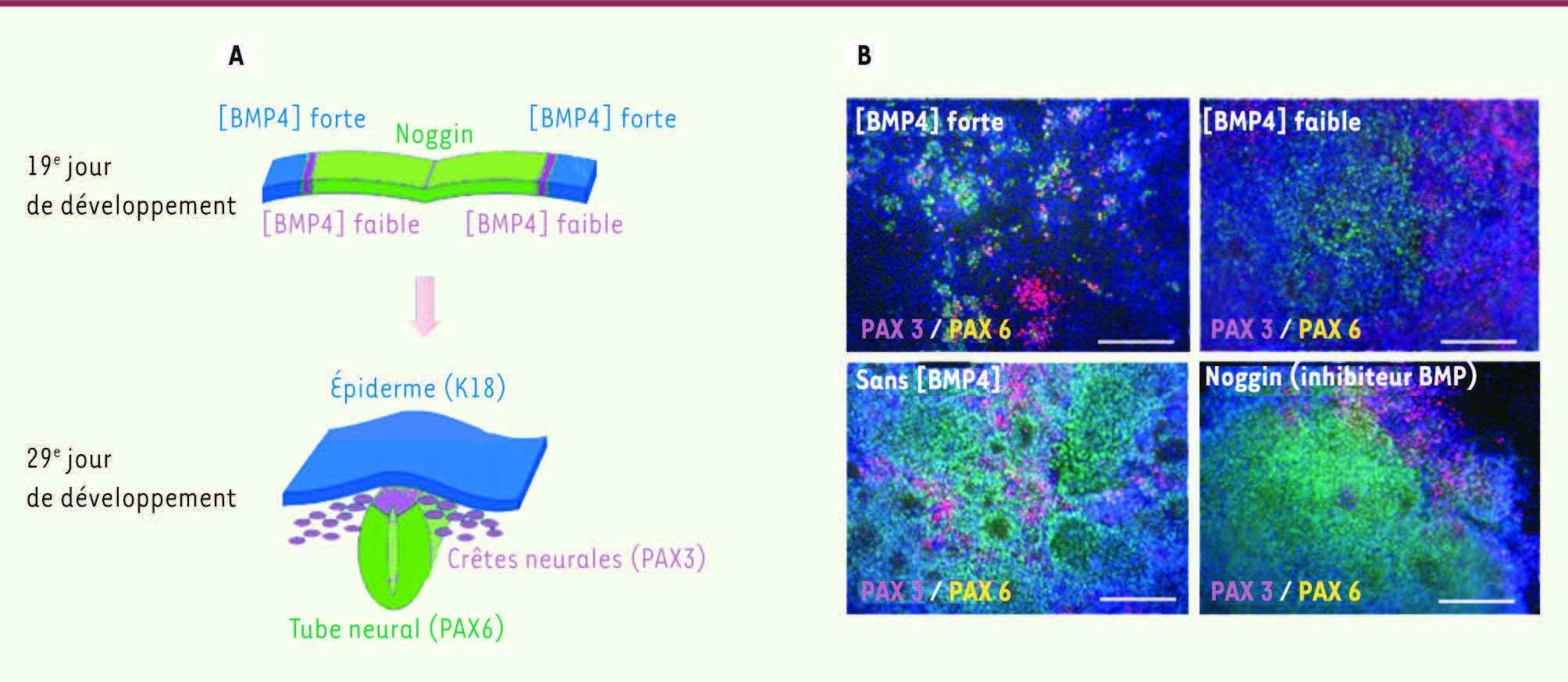
 | Figure 1
Rôle de la voie des BMP dans l’engagement neurectodermique des cellules souches pluripotentes. Au cours du développement embryonnaire (entre le 19e et le 29e jour de gestation chez l’homme), principalement sous l’effet d’un gradient d’activation de la voie des BMP, les cellules du neurectoderme se différencient pour former le tube neural, l’épiderme primitif et les crêtes neurales qui sont à l’origine des mélanoblastes, eux-mêmes précurseurs des mélanocytes (A). Nos travaux ont donc consisté à mettre en place un protocole permettant de mimer cette transition in vitro pour favoriser la différenciation de cellules souches pluripotentes en cellules des crêtes neurales, précurseurs des mélanocytes (B). Pour cela, nous avons suivi l’expression de différents marqueurs tels que PAX3 (marqueur des crêtes neurales) et PAX6 (marqueur des précurseurs neuraux) en fonction de différents traitements par BMP4. Comme c’est le cas in vivo, nous avons ainsi mis en évidence que les cellules exposées à une concentration forte de BMP4 (≥ 0,5 nM) s’engageaient dans le lignage épidermique alors que les cellules traitées par un inhibiteur de cette voie de signalisation (Noggin) s’engageaient préférentiellement dans le lignage neural. Sur la base de ces résultats, nous avons ensuite identifié une concentration de BMP4 (0,02 nM) permettant de potentialiser la différenciation en cellules de la crête neurale jusqu’à obtenir une proportion de 36 % de cellules de ce type. |
Nous avons adapté le protocole mis en place pour obtenir des kératinocytes et étudié l’effet de modifications des concentrations de BMP4 : une forte concentration (5 à 0,5 nM) est requise pour obtenir les dérivés épidermiques, alors que les dérivés neuraux centraux n’en ont pas besoin (< 0,4 nM). Comme nous l’espérions, des concentrations intermédiaires de BMP4 (2 à 0,4 nM) nous ont permis d’enrichir nos cultures - au-delà de 60 jours de différenciation - en cellules pigmentées. Ces cellules arboraient deux phénotypes : pavimenteux pour la majorité, bipolaire et allongé pour les autres. Des analyses moléculaires systématiques nous ont permis d’identifier les premières comme des cellules de l’épithélium pigmenté rétinien, les secondes comme des mélanocytes. Après dissection des îlots pigmentés dans la culture d’origine, nous avons réensemencé les cellules dans un milieu sélectif favorable à la culture des mélanocytes humains et, après quelques semaines, avons ainsi sélectionné une population de cellules qui présentaient un phénotype similaire à celui des mélanocytes adultes humains en culture primaire. Les cellules obtenues, respectivement nommées mel-hESC (mélanocytes dérivés de cellules hES) et mel-iPSC (mélanocytes dérivées de cellules iPS) peuvent être cryopréservées à volonté et maintiennent leur phénotype sans entrer en sénescence jusqu’à 12 passages (au moins 36 cycles de réplication) [5]. Elles présentent un profil d’expression génique similaire à celui des mélanocytes adultes humains, en particulier pour tous les gènes-clés de la mélanogenèse (MITF, TYRP1 [tyrosinase-related protein 1]) et du transport de mélanosomes (Rab27a, SILV [silver locus product], S100) (Figure 2) [
10]. L’analyse par microscopie électronique, effectuée par l’équipe du Dr Graça Raposo à l’Institut Curie (Paris), nous a permis de confirmer que ces mélanocytes dérivés de cellules souches pluripotentes sont capables de produire de la mélanine et de la transférer à des kératinocytes au sein d’organites spécifiques de ce type cellulaire, les mélanosomes. Nous avons ensuite confirmé ces résultats fonctionnels en reconstruisant des épidermes in vitro à partir de kératinocytes basaux et de mélanocytes ainsi obtenus, et démontré leur capacité à se positionner correctement dans la couche basale en étendant leurs prolongements dans les couches sus-jacentes. Finalement, ces cellules ont démontré leur capacité à produire de la mélanine en réponse à une stimulation par l’alpha-MSH (alpha-melanocyte-stimulating hormone), un des facteurs-clés régulant physiologiquement la mélanogenèse.
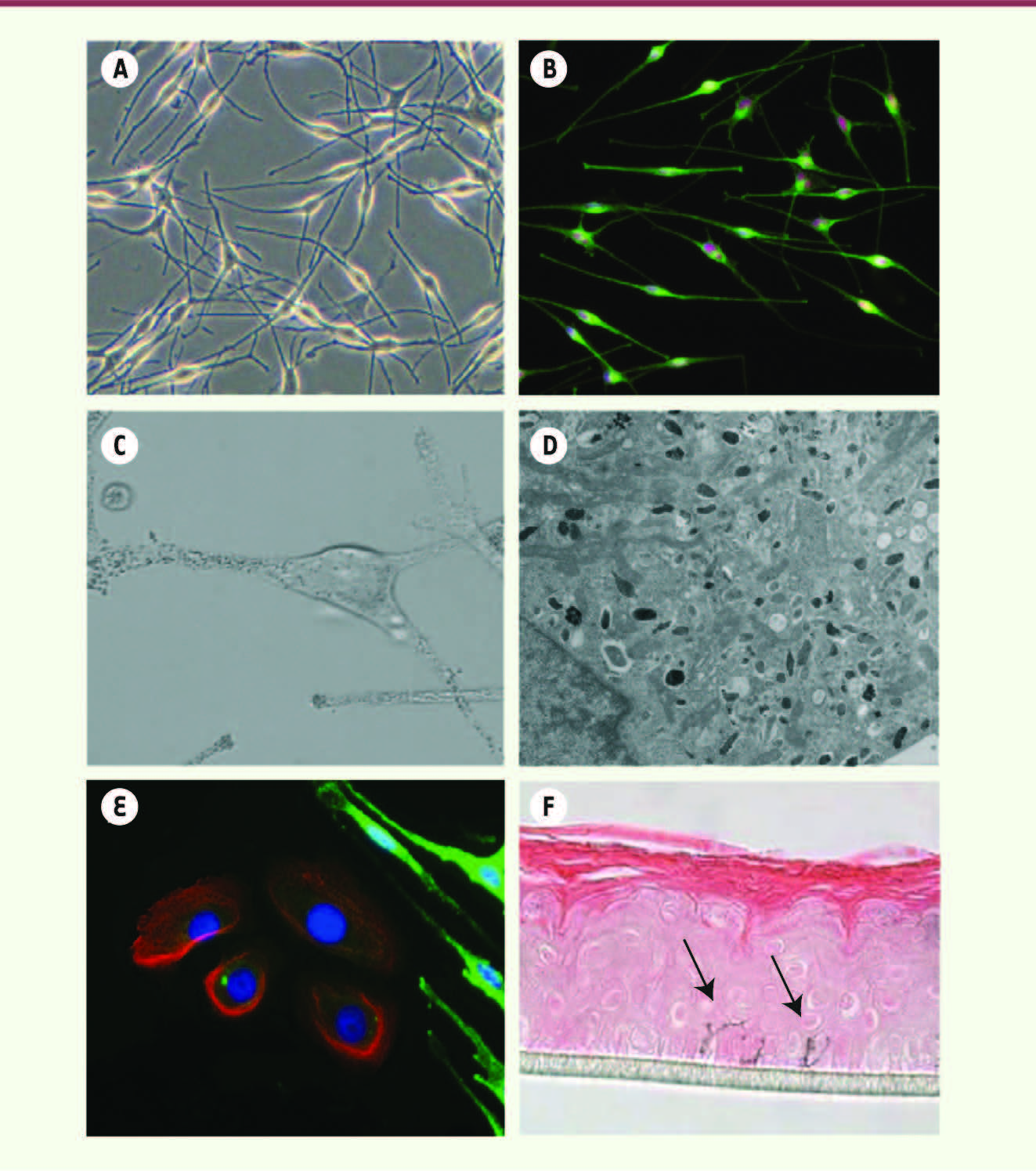
 | Figure 2
Caractérisation moléculaire et fonctionnelle des mélanocytes dérivés de cellules souches pluripotentes. Notre protocole permet de différencier des cellules souches pluripotentes humaines (cellules hES et iPS) en mélanocytes après 40 à 60 jours de traitement par différents agents pharmacologiques et cytokines, incluant BMP4, mimant les signaux impliqués dans la formation de ce lignage au cours du développement embryonnaire humain. Une fois le processus de différenciation terminé, les cellules dont la morphologie est similaire à celle des mélanocytes adultes en culture sont isolées et caractérisées (A). Nos travaux démontrent que ces cellules expriment les marqueurs caractéristiques des mélanocytes, tels que TYRP1 et SLUG (B), qu’elles produisent de la mélanine au sein de mélanosomes matures (C et D) et que ces mélanosomes peuvent dans un second temps être transférés à des kératinocytes (cellules exprimant la protéine K14) avec lesquels elles sont cocultivées (E). Finalement nous avons mis en évidence la fonctionnalité de ces cellules par la génération d’épidermes reconstruits in vitro : ces mélanocytes dérivés de cellules souches pluripotentes pouvaient se localiser, comme c’est le cas physiologiquement, au niveau de la couche basale de l’épiderme (flèches) (F). |
|
Une nouvelle source de mélanocytes pour le traitement de pathologies liées à des troubles de la pigmentation La mise au point d’un protocole permettant de produire en laboratoire des mélanocytes en quantité souhaitée ouvre potentiellement la voie à des approches de thérapie cellulaire dont l’échelle pourrait effectivement répondre aux besoins. Le passage de la preuve de concept à l’application clinique requiert cependant de relever de nombreux défis. Le premier est celui du changement d’échelle. Il faut pour cela développer les outils nécessaires à la production industrielle de ces cellules dans des conditions compatibles avec leur utilisation clinique. Le second est celui de la sécurité du geste, qui se décline au moins selon deux axes, la tolérance immunitaire et le risque tumoral. Ces risques, inhérents à tout protocole de greffe allogénique, ont déjà donné lieu à de nombreuses investigations. Notre équipe avait ainsi montré que les dérivés kératinocytaires des cellules hES présentent un niveau faible d’expression des antigènes HLA I (human leukocyte antigen class I) et nul de HLA II, laissant espérer une réponse de l’hôte contre le greffon limitée voire nulle [
9]. En ce qui concerne les risques de tumorigenicité, il est important de souligner que la FDA (Food and drug administration, l’agence réglementaire américaine) vient d’accepter trois essais cliniques fondés sur des dérivés de lignées de cellules souches embryonnaires humaines. Les deux sociétés de biotechnologie impliquées (Geron et Advanced Cell Technology) ont donc été convaincantes dans leurs démonstrations du faible impact envisageable de la capacité de cellules pluripotentes résiduelles à développer un tératome. En parallèle, la reprogrammation de cellules iPS à partir de cellules de patients et leur différenciation mélanocytaire offrent la possibilité d’étudier, de comprendre et par la suite de corriger des défauts moléculaires liés à des troubles de la pigmentation pour lesquels il n’existe à ce jour pas de modèle in vitro. |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Ce travail a été cofinancé par l’Association française contre les myopathies (AFM) et l’Institut national de la santé et de la recherche médicale (Inserm), et a bénéficié de soutiens complémentaires de l’Université d’Évry Val d’Essonne (UEVE) et de Genopole.
|
1.
Abu Tahir
M
,
Pramod
K
,
Ansari
SH
,
Ali
J
. Current remedies for vitiligo . Autoimmun Rev.
2010; ; 9 : :516.–520. 2.
Yamane
T
,
Hayashi
S
,
Mizoguchi
M
, et al.
Derivation of melanocytes from embryonic stem cells in culture . Dev Dyn.
1999; ; 216 : :450.–458. 3.
Fang
D
,
Leishear
K
,
Nguyen
TK
, et al.
Defining the conditions for the generation of melanocytes from human embryonic stem cells . Stem Cells.
2006; ; 24 : :1668.–1677. 4.
Ohta
S
,
Imaizumi
Y
,
Okada
Y
, et al.
Generation of human melanocytes from induced pluripotent stem cells . PLoS One.
2011; ; 6 : :e16182.. 5.
Nissan
X
,
Larribere
L
,
Saidani
M
, et al.
Functional melanocytes derived from human pluripotent stem cells engraft into pluristratified epidermis . Proc Natl Acad Sci USA.
2011; ; 108 : :14861.–14866. 6.
Thomas
AJ
,
Erickson
CA
. The making of a melanocyte: the specification of melanoblasts from the neural crest . Pigment Cell Melanoma Res.
2008; ; 21 : :598.–610. 7.
Jin
EJ
,
Erickson
CA
,
Takada
S
,
Burrus
LW
. Wnt and BMP signaling govern lineage segregation of melanocytes in the avian embryo . Dev Biol.
2001; ; 233 : :22.–37. 8.
Moriyama
M
,
Osawa
M
,
Mak
SS
, et al.
Notch signaling via Hes1 transcription factor maintains survival of melanoblasts and melanocyte stem cells . J Cell Biol.
2006; ; 173 : :333.–339. 9.
Guenou
H
,
Nissan
X
,
Larcher
F
, et al.
Human embryonic stem-cell derivatives for full reconstruction of the pluristratified epidermis: a preclinical study . Lancet.
2009; ; 374 : :1745.–1753. 10.
Delevoye
C
,
Giordano
F
,
van Niel
G
,
Raposo
G
. La biogenèse des mélanosomes : l’échiquier de la pigmentation . Med Sci (Paris).
2011; ; 27 : :153.–162. 11.
Ménasché
G
,
Ménager
M
,
Le Deist
F
,
Fischer
A
,
de Saint Basile
G
. Défaut d’exocytose des granules lytiques : plusieurs causes, un même effet . Med Sci (Paris).
2006; ; 22 : :733.–738. |