| |
| Med Sci (Paris). 2011 October; 27(10): 859–865. Published online 2011 October 21. doi: 10.1051/medsci/20112710014.La différenciation du sexe Acquis et perspectives Maëlle Pannetier1 and Éric Pailhoux1* 1Inra, UMR1198-Biologie du développement et de la reproduction, Bâtiment J. Poly, 78350, Jouy-en-Josas, France |
Le sexe chez nos « anciens » Depuis l’antiquité, les hommes s’interrogent sur les mécanismes impliqués dans le développement d’un enfant mâle ou femelle. La question généralement posée est la suivante : qui détient la supériorité ? La terre qui reçoit la semence ou la semence qui fertilise la terre ? Anaxagore1, et d’autres naturalistes disent que le sperme vient du mâle et que la femelle ne fournit que le lieu. Si le sperme provient du testicule droit, il produira des garçons, s’il provient du testicule gauche, des filles. Pour d’autres, comme Empédocle2, la différenciation se fait dans la matrice. D’après lui, les germes qui pénètrent dans un utérus chaud deviennent mâles, et femelles dans un utérus froid. Ces différences de température sont attribuées au flux menstruel, suivant qu’il est plus froid ou plus chaud, plus ancien ou plus récent. Aristote, un siècle plus tard, ajoutera de la métaphysique aux théories de l’histoire naturelle dont il est le fondateur. C’est selon lui le mâle qui a la part essentielle dans la génération ; il est porteur du principe divin et transmet l’Humanité. La femelle dénuée de semence n’apporte à la génération qu’une matière brute. Par ailleurs, le principe de matière introduit la corruption et la mort dans l’univers et il est cause, aussi, de monstruosité. La monstruosité s’applique au cas où l’engendré n’est pas de même espèce que le « générateur »3 [
1]. Une simple dissemblance peut constituer une monstruosité : c’est ainsi que la femelle engendrée au lieu d’un mâle est un monstre. « Le tout premier écart du type génétique est la naissance d’une femelle au lieu d’un mâle » (Aristote) [
2]. La femelle est un mâle mutilé, le résultat d’une défaillance du principe mâle. Aristote a beau affirmer que ce monstre qu’est la femelle est nécessaire pour sauvegarder la différence de sexes, la femme n’en est pas moins présentée comme un échec de l’humanité [1]. De nombreux siècles se sont écoulés avant que les données génétiques mettent en évidence l’existence de chromosomes sexuels X et Y chez les mammifères, ainsi que le caractère déterminant du chromosome Y dans la différenciation testiculaire [
3,
4]. Le déterminisme du sexe a lieu dès la fécondation lors de la mise en commun du patrimoine génétique des gamètes mâle et femelle déterminant le sexe génétique de l’embryon. Cette détermination sexuelle va permettre l’engagement vers une voie de différenciation testiculaire (XY) ou ovarienne (XX). En fonction du sexe gonadique, le sexe phénotypique se met alors en place. Ce sont essentiellement les hormones testiculaires qui sont à l’origine du choix de la différenciation du sexe externe : la testostérone et l’AMH (anti-müllerian hormone). Il est à noter qu’en l’absence de gonade, une différenciation génitale externe de type femelle est observée, que l’individu soit XX ou XY. Ce simple constat a ainsi conduit Alfred Jost à considérer le sexe femelle comme un sexe par défaut [
5]. Comme les gonades sont issues d’une ébauche gonadique « bipotentielle », Alfred Jost en a déduit que la présence du testicule était nécessaire au développement du morphotype masculin. La détermination du sexe phénotypique est donc équivalente à celle du testicule. Face à ce machisme millénaire, ce n’est que très récemment que plusieurs équipes de recherche ont mis en évidence des processus actifs de différenciation de la gonade femelle qui se protège par ailleurs des facteurs mâles en inhibant leur expression tout au long du développement jusqu’à l’âge adulte [
6,
7]. L’ovaire a donc, depuis peu, cessé d’être un testicule par défaut, recouvrant enfin ses lettres de noblesse, et il suscite depuis un intérêt grandissant dans le domaine de recherche consacré à la compréhension des acteurs de la détermination et de la différenciation du sexe. Plusieurs modèles d’études ont servi cette réhabilitation : la souris, l’homme, mais aussi certaines espèces d’animaux domestiques comme la chèvre. Ces analyses ont par ailleurs pointé des différences manifestes entre le modèle de référence qu’est la souris et les espèces humaine ou caprine notamment lors des processus morphogénétiques de différenciation ovarienne et en matière de sensibilité au dosage génique. |
Processus morphogénétiques de la différenciation gonadique Chez les mammifères, les premiers stades de la vie fœtale sont caractérisés par la différenciation d’ébauches gonadiques à partir des mésonéphros (reins embryonnaires transitoires). Les cellules germinales primordiales d’origine extra-embryonnaire vont ensuite rapidement coloniser le territoire gonadique, appelé crête génitale. Plusieurs gènes ont été identifiés comme jouant un rôle crucial dans la formation des crêtes génitales, dont en particulier WT1 (Wilms’ tumor gene 1) [
8] et SF1 (steroidogenic factor 1) [
9]. Ces gènes interviennent dans la prolifération, la différenciation et la survie des cellules somatiques de la gonade [
10]. Leur invalidation chez la souris conduit à une agénésie gonadique. Au début de leur formation, les gonades sont dites « bipotentielles » car elles ont la capacité de suivre une voie de différenciation mâle ou femelle, en fonction des facteurs exprimés. On considère schématiquement que les gonades indifférenciées sont composées de deux lignées cellulaires somatiques différentes en plus de la lignée germinale. Chaque lignée somatique présente une double potentialité, et ce sont les gènes impliqués dans la détermination du sexe qui vont orienter ces lignées cellulaires vers une voie de différenciation donnée
(Figure 1)
. On distingue ainsi : (1) la lignée des cellules de soutien, qui est à l’origine des cellules de Sertoli chez le mâle et des cellules folliculaires (granulosa) chez la femelle. Ces cellules sont dites de soutien car elles vont permettre la croissance et la maturation des cellules germinales ; (2) la lignée des cellules stéroïdogènes, qui évoluera en cellules de Leydig chez le mâle et en cellules des thèques chez la femelle [
11].
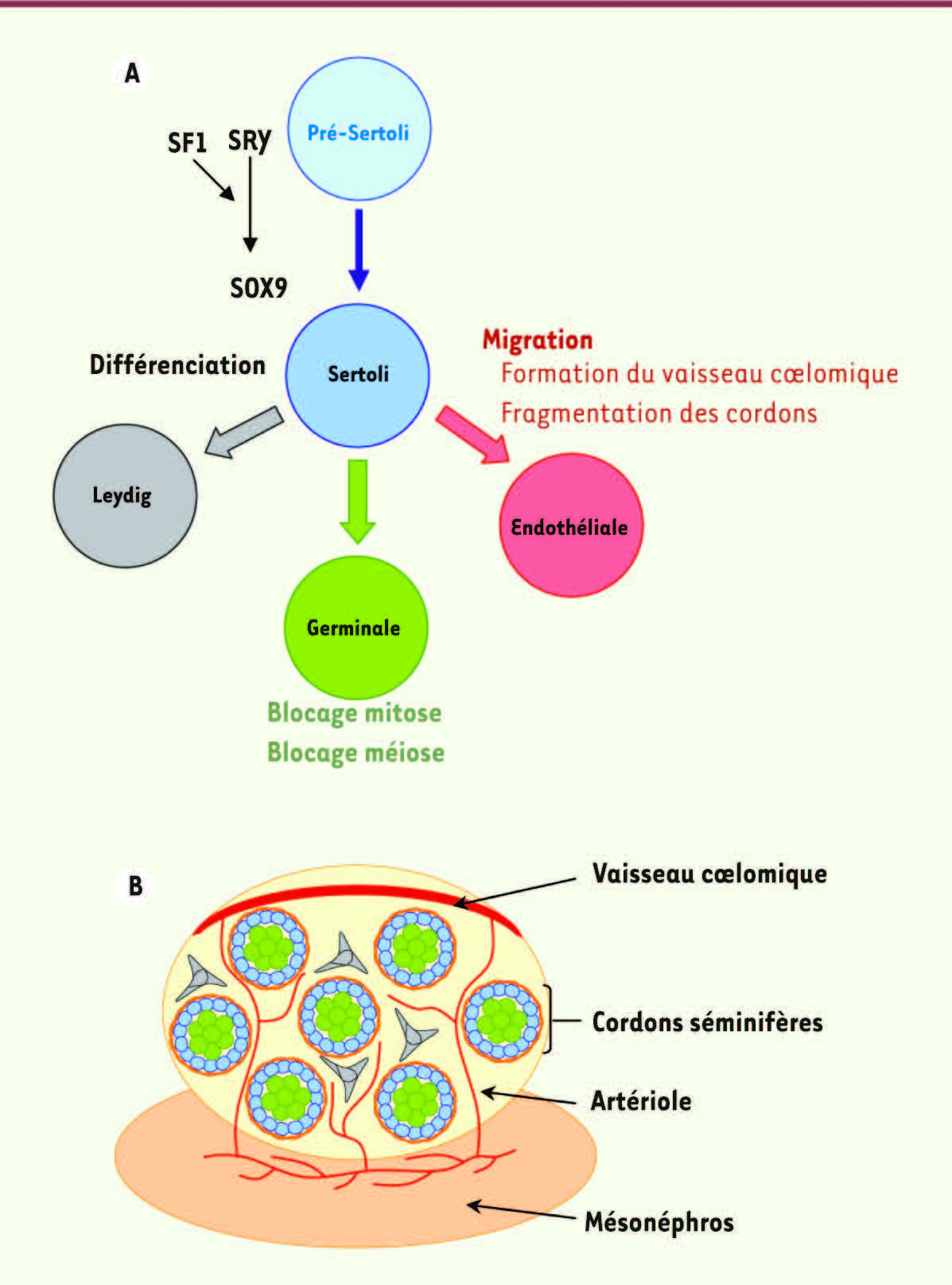
 | Figure 1.
Origine commune des cellules composant le testicule et l’ovaire. Trois principaux types cellulaires peuvent être distingués dans les gonades en cours de différenciation : les cellules de soutien, les cellules stéroïdogènes et les cellules germinales. Les cellules de soutien mâles et femelles ont donc une origine commune et donnent naissance respectivement aux cellules de Sertoli et aux cellules de la granulosa. Les cellules stéroïdogènes donneront naissance dans le testicule aux cellules de Leydig et aux cellules de la thèque dans l’ovaire. |
Différenciation testiculaire De nombreux travaux essentiellement réalisés chez la souris ont permis de mettre en évidence les évènements morphogénétiques impliqués dans la formation d’un ovaire ou d’un testicule. Chez cette espèce, la gonade mâle est la première à présenter un processus de différenciation et à exhiber morphologiquement son orientation sexuelle. Deux événements majeurs sont en effet observés : la formation des cordons testiculaires (futurs tubes séminifères) et l’apparition d’une vascularisation typique du testicule (développement de l’artère testiculaire à la surface de la gonade). La première étape de la différenciation testiculaire consiste en la spécification des précurseurs des cellules de Sertoli (pré-Sertoli), qui se fait sous l’effet de l’expression du gène SRY (sex-determining region on the Y chromosome) porté par le chromosome Y. En partenariat avec SF1, SRY active l’expression de SOX9 (SRY-related HMG-box gene 9) induisant la différenciation des cellules de Sertoli [
12]. Celles-ci agissent ensuite comme un maître d’œuvre orchestrant la différenciation des autres types cellulaires du testicule : cellules de Leydig, cellules myoïdes péritubulaires, cellules germinales et cellules endothéliales, grâce aux facteurs paracrines qu’elles sécrètent
(Figure 2A)
. En particulier, les cellules de Sertoli sont responsables de la migration de cellules endothéliales depuis le mésonéphros vers la gonade XY. Ces cellules endothéliales vont s’associer juste en dessous de l’épithélium cœlomique pour former le vaisseau cœlomique (future artère testiculaire) et le réseau d’artérioles [
13,
14]
(Figure 2B)
.
 | Figure 2.
Différenciation du testicule. A. La cellule de Sertoli, chef d’orchestre de la différenciation testiculaire. La différenciation de la gonade mâle est déclenchée par l’expression du gène SRY dans les précurseurs des cellules de Sertoli. En partenariat avec SF1, SRY active alors l’expression de SOX9 qui est responsable de l’activation d’une cascade génique permettant la différenciation des cellules de Sertoli. Grâce aux facteurs diffusibles qu’elles sécrètent et aux interactions cellulaires qu’elles établissent, les cellules de Sertoli vont orienter la différenciation des autres types cellulaires du testicule. B. Les différents compartiments du testicule. Les cellules du testicule en cours de différenciation s’organisent en deux compartiments fonctionnels : les cordons séminifères et l’espace interstitiel à l’extérieur des cordons. Les tubes séminifères sont entourés par les cellules myoïdes péritubulaires (en orange). Au sein des tubes séminifères, les cellules de Sertoli (en bleu) entourent les cellules germinales (en vert). Le compartiment interstitiel contient les cellules de Leydig (en gris) et des cellules endothéliales formant un réseau d’artérioles depuis le mésonéphros sous-jacent vers la surface de la gonade où il forme l’artère testiculaire (en rouge). |
La formation de cordons sexuels commence via les cellules de Sertoli qui entourent des faisceaux de cellules germinales, contrôlant leur prolifération et inhibant leur entrée en méiose. Les interactions cellulaires avec les cellules endothéliales migrant depuis le mésonéphros induisent ensuite la fragmentation des cordons testiculaires. La formation des cordons sera ensuite consolidée par la différenciation des cellules myoïdes péritubulaires qui entourent les cordons testiculaires
(Figure 2B)
. L’équivalent femelle des cellules péritubulaires reste à l’heure actuelle inconnu. Entre les cordons, la région interstitielle contient notamment les cellules de Leydig qui produisent des androgènes essentiels à la masculinisation du tractus génital. Différenciation ovarienne Chez la souris, alors que la gonade mâle montre un début de morphogenèse rapide en réponse à l’expression du gène Sry, la gonade femelle garde un aspect morphologique peu différencié malgré l’initiation de l’expression de gènes spécifiques de l’ovaire comme Foxl2 ( forkhead transcription factor FOXL2), Rspo1 ( R-spondin gene 1) et Wnt4 ( Wingless-type MMTV integration site family, member 4). Dans l’ovaire murin, le premier évènement caractéristique de la voie femelle est l’entrée en méiose des cellules germinales qui vont rapidement être bloquées au stade de prophase de première division méiotique (ovocytes I). Au contraire, chez d’autres espèces de mammifères, dont l’espèce humaine, l’ovaire présente dès sa différenciation des évènements morphogénétiques importants. En effet, le délai entre la première expression des marqueurs femelles et l’entrée en méiose des cellules germinales est assez long (entre 15 et 20 jours chez la femme ou la chèvre) et on assiste au cours de cette période à des processus de prolifération et de migration cellulaires intensifs. L’ovaire s’organise en deux compartiments : le cortex et la médulla. Les cellules germinales prolifèrent et migrent à la périphérie de l’ovaire, alors que les cellules somatiques sont principalement regroupées dans le cœur de la gonade [
15]. Chez la chèvre il existe par ailleurs une production d’hormones stéroïdes au sein de l’ovaire précoce
(Figure 3)
. En effet, de nombreuses cellules présentes dans la médulla produisent des œstrogènes dont l’action, relayée par les récepteurs ERα et ERβ (estrogen receptor α et β), peut s’exercer à la fois sur les cellules germinales et les cellules somatiques [
16]. Chez l’homme, une activité stéroïdogène a été observée dans l’ovaire précoce sans que toutefois une synthèse d’œstrogènes ait été clairement établie [
17].
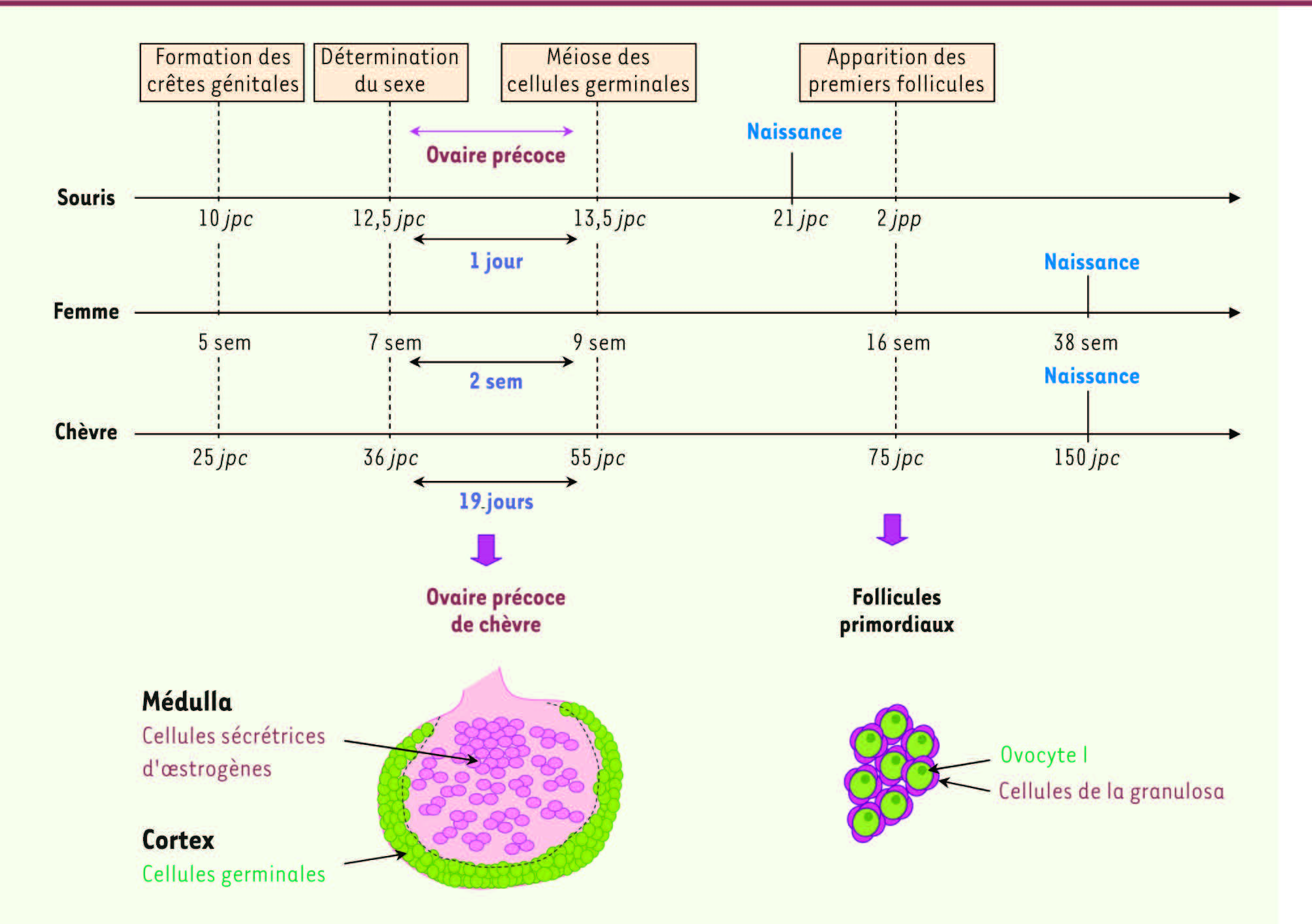
 | Figure 3.
Principales étapes de la différenciation de l’ovaire. La chronologie des grandes étapes de la différenciation ovarienne chez la souris, la femme et la chèvre est indiquée en semaines ou en jours post-coïtum (jpc). L’étape de différenciation précoce de l’ovaire, avant l’initiation de la méiose des cellules germinales, diverge fortement entre ces trois espèces. Chez la souris, cette période se résume à une journée au cours de laquelle aucun processus morphogénétique particulier ne peut être observé ; on parle chez cette espèce de blastème indifférencié. Chez la femme ou chez la chèvre, des vagues de proliférations et de migrations, notamment des cellules germinales, induisent la mise en place d’une organisation de type cortex/médulla, les cellules germinales étant en périphérie de l’ovaire et les cellules somatiques majoritairement regroupées au centre. Chez la chèvre est également observée une activité stéroïdogène au cœur de l’ovaire où les cellules somatiques produisent des œstrogènes dès ce stade. Après le début de la méiose, une couronne de cellules somatiques vient entourer les ovocytes I pour former les follicules primordiaux. Ces follicules constituent l’unité fonctionnelle de l’ovaire. jpc : jour post-coïtum ; jpp : jour post-partum ; sem : semaines. |
Le processus d’initiation de la méiose se fait de façon asynchrone dans la gonade femelle et s’étend sur une période de plusieurs semaines chez la femme ou la chèvre. Les ovocytes I sont regroupés en cohortes, entourés par des cellules somatiques, formant les nids ou cordons ovigères. Lors de la fragmentation de ces cordons, un ovocyte va se trouver entouré par une couronne de cellules somatiques, les cellules de la granulosa, formant ainsi un follicule primordial. Ces follicules représentent les unités fonctionnelles de l’ovaire et constituent le stock dont disposera la femelle pour toute sa vie reproductive. La folliculogenèse a lieu au cours du dernier tiers de la gestation chez la femme ou la chèvre et parfois même après la naissance comme chez la souris
(Figure 3)
. |
Entre l’homme et la souris, des différences existent… Bien qu’un grand nombre d’acteurs de la différenciation gonadique aient été découverts chez l’homme grâce aux études génétiques de patients présentant des désordres de la différenciation sexuelle (DSD : disorders of sex development), la grande majorité des connaissances mécanistiques ont été acquises dans le modèle murin par l’étude de différents mutants pour les gènes impliqués. L’invalidation génique, qu’elle soit globale (knock-out), conditionnelle (ciblée dans un organe ou un type cellulaire précis) ou inductible (ciblée dans le temps), s’avère être un outil très puissant et incontournable pour déterminer la fonction d’un gène donné, les voies moléculaires par lesquelles il agit et ses interactions avec les autres acteurs impliqués. Cependant, l’invalidation génique n’étant principalement réalisée que chez la souris (grâce à la disponibilité de lignées de cellules ES, embryonic stem cells), les connaissances acquises s’appliquent au modèle murin mais des divergences peuvent exister avec d’autres modèles mammaliens, espèce humaine comprise. Ainsi, d’une manière très générale, il apparaît que le modèle murin est, comparativement à l’espèce humaine, considérablement plus robuste d’un point de vue « dosage génique ». Par ailleurs, compte-tenu de son temps de génération très court, de la taille importante des portées et par conséquent de son évolution (en termes d’accumulation de mutations) nettement plus rapide (x 100 par rapport à l’homme en ne considérant que le temps de génération), l’espèce murine semble avoir « simplifié » les cascades génétiques requises pour la gonadogenèse. Dans ce paragraphe, nous illustrerons par quelques exemples les différences de robustesse de dosage génique existant entre l’homme et la souris. Dans le paragraphe suivant, le modèle caprin sera présenté pour illustrer la notion de « simplification » des cascades génétiques murines. Divergences dans le dosage génique entre l’homme et la souris Les différences de dosage génique entre l’homme et la souris sont parfaitement illustrées par les différences de phénotypes observées entre ces deux espèces principalement pour les mutations perte de fonction de différents gènes comme par exemple WT1, SOX9 et DMRT1 ( doublesex and Mab3 related transcription factor 1). Dans tous les cas, des mutations hétérozygotes de ces gènes sont responsables d’agénésies testiculaires chez l’homme, alors que leur haplo-insuffisance chez la souris n’a pas d’effet. Les gènes WT1 et SOX9 ont été découverts chez l’homme et leur haplo-insuffisance est responsable dans cette espèce d’inversion sexuelle de type femme XY associée à des tumeurs rénales (tumeurs de Wilms) pour WT1 et à des malformations osseuses (dysplasie campomélique) pour SOX9 [
18–
21]. L’invalidation de ces gènes chez la souris n’a d’effet qu’à l’état homozygote : en l’absence de Wt1 les animaux présentent une absence de rein, de surrénales et de gonades dans les deux sexes, et en l’absence de Sox9 une létalité embryonnaire en milieu de gestation [8,
22]. Dans les deux cas, des stratégies d’invalidation conditionnelle (Sox9) ou de certaines isoformes (Wt1) ont du être développées afin d’appréhender le rôle de ces gènes dans la gonadogenèse [
23,
24]. Un autre exemple est celui du gène DMRT1 impliqué dans un phénotype d’inversion sexuelle de type femme XY chez des patients présentant des délétions du bras court du chromosome 9 [
25,
26]. L’invalidation de ce gène chez la souris n’entraîne aucun effet chez les animaux hétérozygotes pour la mutation et la différenciation testiculaire précoce n’apparait pas perturbée à l’état homozygote. Néanmoins, chez les mâles Dmrt1-/-
, un phénotype testiculaire apparaît à partir du dixième jour après la naissance et se traduit par un blocage de la spermatogenèse [
27]. Par ailleurs, les haplo-insuffisances du chromosome 9, associées à une inversion sexuelle de type femme XY chez l’homme, affectent potentiellement deux autres gènes, DMRT2 et 3, en plus de DMRT1 [
28]. La complexité des mutations chez l’homme (grandes délétions) et l’absence d’inversion du sexe chez la souris ont probablement contribué à sous-estimer la fonction de ce facteur DMRT1 chez les mammifères ; facteur par ailleurs sélectionné trois fois de manière indépendante comme déterminant testiculaire chez le poisson médaka (système XX/XY), le xénope et le poulet (systèmes ZZ/ZW) [
29]. Un dernier exemple illustrant parfaitement la robustesse du système murin porte cette fois sur des mutations gain de fonction du gène Dax1 (DSS-AHC critical region on the X chromosome, gene 1), nommé maintenant NR0B1 (nuclear receptor subfamily 0, group B, member 1). DAX1 a été découvert chez l’homme car sa duplication sur le chromosome X entraîne une inversion du sexe chez des patients XY [
30]. Il en découle que chez l’homme, deux doses du gène DAX1 empêchent l’action d’une dose du gène SRY. Cet état génétique a été reproduit chez la souris où une inversion du sexe de type femelle XY a pu être obtenue par addition - par transgenèse - d’environ cinq doses des transcrits de Dax1 dans un contexte où le chromosome Y vient de l’espèce poschiavinus (YPOS) qui possède un allèle faible du gène Sry [
31]. À l’heure actuelle, DAX1 étant considéré comme un inhibiteur des autres membres de la famille des récepteurs nucléaires, notamment NR5A1/SF1 (nuclear receptor subfamily 5, group A, member 1), il est probable que deux doses de DAX1 empêchent l’activation correcte de SOX9 par SF1. Par ailleurs, étant donné que l’invalidation de Dax1 chez la souris entraîne également une inversion sexuelle de type femelle XY [
32], on perçoit la complexité de ce facteur qui doit être présent, mais à une dose très précise, pour une différenciation testiculaire harmonieuse. Un modèle mammalien alternatif : la chèvre Depuis plusieurs années maintenant, notre équipe étudie la différenciation gonadique chez les mammifères de rente (caprins, porcins) car, dans ces espèces, des mutations naturelles sont responsables d’inversion sexuelle de type mâle XX. Chez la chèvre, la mutation PIS ( polled intersex syndrome) engendre une absence de pousse des cornes à l’état hétérozygote et une inversion sexuelle des sujets XX chez les homozygotes ( PIS-/-
). Cette mutation est une délétion d’un fragment d’environ 12 kilobases qui conduit à des changements d’expression d’au moins trois gènes différents, le gène FOXL2 et deux gènes codant pour de longs ARN non codants [
33,
34]. À l’heure actuelle, de nombreux arguments expérimentaux montrent que seul le gène FOXL2 est responsable des phénotypes observés et que les deux longs ARN non codants sont impliqués dans la régulation complexe de FOXL2. La mutation PIS entraîne un gain de fonction du gène FOXL2 dans la peau céphalique. Ce gain de fonction, détectable dès l’hétérozygotie, est responsable de l’absence de pousse des cornes. Par ailleurs, la mutation PIS entraîne l’absence d’expression du gène FOXL2 dans les gonades XX des individus homozygotes ; il en résulte une levée d’inhibition du gène SOX9 et une différenciation testiculaire en l’absence du facteur déterminant SRY. Chez l’homme, des mutations hétérozygotes du gène FOXL2 sont responsables d’un phénotype palpébral (BPES : blepharophymosis ptosis epicanthus-inversus syndrome)4 qui peut être associé à une insuffisance ovarienne précoce [
35]. Comme c’est le cas pour l’invalidation des gènes « mâles », l’invalidation de Foxl2 chez la souris est sans effet à l’état hétérozygote. En revanche, l’invalidation homozygote de Foxl2 engendre une absence de formation des paupières et des follicules ovariens [
36]. La divergence des phénotypes observés chez la chèvre et la souris lors de la perte de l’expression ovarienne de FOXL2 (inversion sexuelle versus insuffisance ovarienne) résulte selon toute vraisemblance de différences dans les processus et la durée de la différenciation de l’ovaire précoce, déjà évoquées ci-dessus. En effet, alors que l’ovaire de souris présente, au cours de cette période de 24 heures, un aspect blastémateux sans changements morphologiques notables, on observe dans l’ovaire de chèvre une organisation spatiale en deux zones, corticale et médullaire, ainsi qu’une production d’œstrogènes
(Figure 3)
. L’ovaire précoce de souris ne produit pas d’œstrogènes et il ne s’organise en deux zones qu’après le stade de méiose des cellules germinales. Ce n’est qu’après la naissance et la formation des follicules ovariens que des œstrogènes sont sécrétées chez cette espèce. De façon intéressante, l’invalidation de Foxl2 à l’âge adulte dans un ovaire produisant des œstrogènes induit une inversion sexuelle des cellules somatiques, qui acquièrent des caractéristiques de type cellules de Sertoli avec notamment l’expression du marqueur mâle Sox9 [6]. Ainsi, c’est cette divergence dans la chronologie du développement et en particulier dans l’existence d’un environnement œstrogénique au sein de la gonade femelle par ailleurs régulé par FOXL2 lui-même, qui explique la différence de phénotypes observée entre la chèvre et la souris lors d’invalidations du gène FOXL2 [7]. Cette différence observée dans la voie femelle pourrait également produire des échos dans la voie mâle sur la manière de déclencher l’expression de SOX9 dans les différentes espèces. En effet, il est surprenant de constater que FOXL2 et DMRT1 ont été plusieurs fois démontrés comme étant des antagonistes directs (chez le xénope et chez le rat). De plus, leur invalidation respective chez la souris n’induit pas d’inversion sexuelle, alors que leur perte (FOXL2) ou leur haplo-insuffisance (DMRT1) engendre une inversion sexuelle chez des mammifères non murins. Ainsi, certains rôles importants de FOXL2 dans l’ovaire et de DMRT1 dans le testicule n’auraient pas été conservés chez la souris qui semble avoir « allégé » son programme de différenciation gonadique. |
Nos connaissances de la différenciation sexuelle des mammifères ont énormément progressé au cours des deux dernières décennies. Dans un premier temps, suite à la découverte du gène SRY et à la mise en évidence de sa piètre conservation, cette voie de développement était considérée comme faiblement conservée au cours de l’évolution. À l’heure actuelle, il semble au contraire que la grande majorité des acteurs-clés impliqués soient conservés chez l’ensemble des vertébrés, voire même chez des invertébrés. En effet, en plus de DMRT1 qui possède un orthologue dans la différenciation testiculaire chez la drosophile (dsx) et chez le vers Caenorhabditis (Mab3), un gène SOX (Sox100B) est impliqué dans la différenciation testiculaire chez la drosophile et un orthologue du gène FOXL2 vient d’être décrit dans les gonades d’huitres. Dans les années à venir, avec le développement très rapide des techniques d’études à haut débit, de nombreux autres acteurs devraient être découverts, notamment les gènes cibles des facteurs majeurs que sont SOX9 et FOXL2. Les interactions géniques sous-tendant la différenciation gonadique devraient également être mieux décortiquées. La découverte de nouvelles mutations chez des patients atteints de DSD, par les techniques de séquençage de l’ensemble des exons (exomes) [
37] ou la recherche de zones du génome caractérisées par une variation du nombre de copies (CNV : copy number variation), devrait grandement participer aux futurs progrès dans ce domaine. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Note ajoutée aux épreuves Une publication très récente [
38] rapportant l’invalidation spécifique de Dmrt1 dans les cellules de Sertoli renforce la constatation d’une non-conservation de rôles importants de Foxl2 dans l’ovaire et de Dmrt1 dans le testicule chez la souris. Ce travail de l’équipe de David Zarkower publié en Juillet 2011 peut être considéré comme le pendant mâle de l’invalidation à l’âge adulte de Foxl2 dans l’ovaire [6, 7]. Pour décortiquer le rôle spécifique de Dmrt1 dans la cellule de Sertoli par rapport à son rôle dans la cellule germinale, les auteurs provoquent l’ablation du gène Dmrt1 spécifiquement dans la cellule de Sertoli. Les cellules de Sertoli Dmrt1-/-
vont alors exprimer Foxl2 et se reprogrammer en cellules somatiques de type femelle. Il faut cependant remarquer que l’expression de Foxl2 apparaît très tardivement après la naissance (entre 14 et 28 jours), bien que l’ablation de Dmrt1 ait lieu dès la différenciation des cellules de Sertoli. Ceci suggère que chez la souris mâle, le rôle-clé de Dmrt1 dans la différenciation testiculaire précoce a été perdu, bien que ce rôle persiste pour maintenir l’identité testiculaire à l’âge adulte. Il en va de même pour le gène Foxl2 dans la différenciation ovarienne chez la souris femelle [6, 7].
|
|
Footnotes |
1.
Badinter
E.
, L’un est l’autre : des relations entre hommes et femmes. Collection Points . Paris: : Odile Jacob;
1986. 2.
Aristote
. De la génération des animaux. Livre IV . Paris: : Les Belles Lettres; , 1963. 3.
Jacobs
PA
,
Strong
JA.
A case of human intersexuality having a possible XXY sex-determining mechanism . Nature.
1959; ; 183 : :302.–303. 4.
Russell
LB.
Genetics of mammalian sex chromosomes . Science.
1961; ; 133 : :1795.–1803. 5.
Jost
A.
Recherches sur le contrôle hormonal de l’organogenèse sexuelle du lapin et remarques sur certaines malformations de l’appareil génital humain . Gyn Obstet.
1950; ; 49 : :44.–60. 6.
Uhlenhaut
N
,
Jakob
S
,
Anlag
K
, et al.
Somatic sex reprogramming of adult ovaries to testes by FOXL2 ablation . Cell.
2009; ; 139 : :1130.–1142. 7.
Pannetier
M
,
Pailhoux
E.
FOXL2, le gardien de l’identité ovarienne . Med Sci (Paris).
2010; ; 26 : :470.–473. 8.
Kreidberg
JA
,
Sariola
H
,
Loring
JM
, et al.
WT-1 is required for early kidney development . Cell.
1993; ; 74 : :679.–691. 9.
Luo
X
,
Ikeda
Y
,
Parker
KL.
A cell-specific nuclear receptor is essential for adrenal and gonadal development and sexual differentiation . Cell.
1994; ; 77: :481.–490. 10.
Brennan
J
,
Capel
B.
One tissue, two fates: molecular genetic events that underlie testis versus ovary development . Nat Rev Genet.
2004; ; 5 : :509.–521. 11.
Capel
B.
The battle of the sexes . Mech Dev.
2000; ; 92 : :89.–103. 12.
Sekido
R
,
Lovell-Badge
R.
Sex determination involves synergistic action of SRY and SF1 on a specific Sox9 enhancer . Nature.
2008; ; 453 : :930.–934. 13.
Brennan
J
,
Karl
J
,
Capel
B.
Divergent vascular mechanisms downstream of Sry establish the arterial system in the XY gonad . Dev Biol.
2002; ; 244 : :418.–428. 14.
Combes
AN
,
Wilhelm
D
,
Davidson
T
, et al.
Endothelial cell migration directs testis cord formation . Dev Biol.
2009; ; 326 : :112.–120. 15.
Kerr
CL
,
Hill
CM
,
Blumenthal
PD
,
Gearhart
JD.
Expression of pluripotent stem cell markers in the human fetal ovary . Hum Reprod.
2008; ; 23 : :589.–599. 16.
Pannetier
M
,
Fabre
S
,
Batista
F
, et al.
FOXL2 activates P450 aromatase gene transcription: towards a better characterization of the early steps of mammalian ovarian development . J Mol Endocrinol.
2006; ; 36 : :399.–413. 17.
George
FW
,
Wilson
JD.
Conversion of androgen to estrogen by the human fetal ovary . J Clin Endocrinol Metab.
1978; ; 47 : :550.–555. 18.
Gessler
M
,
Poustka
A
,
Cavenee
W
, et al.
Homozygous deletion in Wilms tumours of a zinc-finger gene identified by chromosome jumping . Nature.
1990; ; 343 : :774.–778. 19.
Pelletier
J
,
Bruening
W
,
Li
F
, et al.
WT1 mutations contribute to abnormal genital system development and hereditary Wilms’ tumour . Nature.
1991; ; 353 : :431.–434. 20.
Foster
J
,
Dominguez-Steglich
M
,
Guioli
S
, et al.
Campomelic dysplasia and autosomal sex reversal caused by mutations in an SRY-related gene . Nature.
1994; ; 372 : :525.–530. 21.
Wagner
T
,
Wirth
J
,
Meyer
J
, et al.
Autosomal sex reversal and campomelic dysplasia are caused by mutations in and around the SRY-related gene SOX9 . Cell.
1994; ; 79 : :1111.–1120. 22.
Chaboissier
M
,
Kobayashi
A
,
Vidal
V
, et al.
Functional analysis of Sox8 and Sox9 during sex determination in the mouse . Development.
2004; ; 131 : :1891.–1901. 23.
Lavery
R
,
Lardenois
A
,
Ranc-Jianmotamedi
F
, et al.
XY Sox9 embryonic loss-of-function mouse mutants show complete sex reversal and produce partially fertile XY oocytes . Dev Biol.
2011; ; 354 : :111.–122. 24.
Hammes
A
,
Guo
JK
,
Lutsch
G
, et al.
Two splice variants of the Wilms’ tumor 1 gene have distinct functions during sex determination and nephron formation . Cell.
2001; ; 106 : :319.–329. 25.
Raymond
CS
,
Parker
ED
,
Kettlewell
JR
, et al.
A region of human chromosome 9p required for testis development contains two genes related to known sexual regulators . Hum Mol Genet.
1999; ; 8 : :989.–996. 26.
Ottolenghi
C
,
Veitia
R
,
Quintana-Murci
L
, et al.
The region on 9p associated with 46, XY sex reversal contains several transcripts expressed in the urogenital system and a novel doublesex-related domain . Genomics.
2000; ; 64 : :170.–178. 27.
Raymond
CS
,
Murphy
MW
,
O’Sullivan
MG
, et al.
Dmrt1, a gene related to worm and fly sexual regulators, is required for mammalian testis differentiation . Genes Dev.
2000; ; 14 : :2587.–2595. 28.
Ottolenghi
C
,
McElreavey
K.
Deletions of 9p and the quest for a conserved mechanism of sex determination . Mol Genet Metab.
2000; ; 71 : :397.–404. 29.
Koopman
P.
Sex determination: the power of DMRT1 . Trends Genet.
2009; ; 25 : :479.–481. 30.
Zanaria
E
,
Muscatelli
F
,
Bardoni
B
, et al.
An unusual member of the nuclear hormone receptor superfamily responsible for X-linked adrenal hypoplasia congenita . Nature.
1994; ; 372 : :635.–641. 31.
Swain
A
,
Narvaez
V
,
Burgoyne
P
, et al.
Dax1 antagonizes Sry action in mammalian sex determination . Nature.
1998; ; 391 : :761.–767. 32.
Yu
RN
,
Ito
M
,
Saunders
TL
, et al.
Role of Ahch in gonadal development and gametogenesis . Nat Genet.
1998; ; 20 : :353.–357. 33.
Pailhoux
E
,
Vigier
B
,
Chaffaux
S
, et al.
A 11.7-kb deletion triggers intersexuality and polledness in goats . Nat Genet.
2001; ; 29 : :453.–458. 34.
Pannetier
M
,
Elzaiat
M
,
Thépot
D
, et al.
Telling the story of XX sex-reversal in the goat: highlighting the sex-crossroad in domestic mammals . Sex Dev.
2011
(sous presse).. 35.
Crisponi
L
,
Deiana
M
,
Loi
A
, et al.
The putative forkhead transcription factor FOXL2 is mutated in blepharophimosis/ptosis/epicanthus inversus syndrome . Nat Genet.
2001; ; 27 : :159.–166. 36.
Schmidt
D
,
Ovitt
C
,
Anlag
K
, et al.
The murine winged-helix transcription factor Foxl2 is required for granulosa cell differentiation and ovary maintenance . Development.
2004; ; 131 : :933.–942. 37.
Jordan
B.
Du bon usage des exomes . Med Sci (Paris).
2010; ; 26 : :1111.–1113. 38.
Matson
CK
,
Murphy
MW
,
Sarver
AL
, et al.
DMRT1 prevents female reprogramming in the postnatal mammalian testis . Nature.
2011; ; 476 : :101.–104. |