| |
| Med Sci (Paris). 2011 October; 27(10): 811–813. Published online 2011 October 21. doi: 10.1051/medsci/20112710006.Modulation du front d’onde pour l’excitation biphotonique en optogénétique Aurélien Bègue,1 Francesca Anselmi,1 Eirini Papagiakoumou,1 and Valentina Emiliani1* 1Wavefront-engineering microscopy group, Neurophysiology and New Microscopies laboratory, CNRS UMR 8154, Inserm U603, Université Paris Descartes, 45, rue des Saints Pères, 75270Paris Cedex 06, France MeSH keywords: Potentiels d'action, effets des radiations, Animaux, Phénomènes biophysiques, Dendrites, physiologie, Humains, Rayons infrarouges, Ouverture et fermeture des portes des canaux ioniques, Lasers, Micromanipulation, méthodes, Microscopie, instrumentation, Neurones, Neurosciences, Optique et photonique, Photochimie, Photons, Ingénierie des protéines, Protéines de fusion recombinantes, biosynthèse, génétique, Rhodopsine, composition chimique |
Le développement de l’optogénétique en neurosciences L’expression ciblée de protéines photosensibles sous contrôle d’un promoteur spécifique, technique que l’on désigne sous l’appellation optogénétique, a connu un essor formidable ces dernières années dans le domaine des neurosciences. La diversité des protéines photosensibles naturelles et leur amélioration par ingénierie génétique ont permis de créer une vaste gamme d’outils optogénétiques qui permettent de contrôler l’activité cérébrale avec la lumière, via la stimulation ou l’inhibition de neurones. L’optogénétique s’est imposée et a pris peu à peu l’avantage sur des méthodes traditionnelles fondées sur la pose d’électrodes et la pharmacologie, en exploitant les avantages des techniques de stimulation optique. En effet, contrairement aux électrodes, la photostimulation ne provoque pas de perturbations mécaniques et permet d’activer plusieurs régions avec une plus grande flexibilité et une meilleure précision spatiale. L’outil optogénétique le plus couramment utilisé est un canal cationique excitateur qui s’insère dans la membrane plasmique, la channelrhodopsin-2 (ChR2). Grâce au faible niveau d’intensité lumineuse requis pour son excitation (1 mW/mm², lumière bleue), la ChR2 a pu être activée avec une illumination à champ large délivrée, par exemple, par des fibres optiques implantées dans le cerveau d’animaux in vivo. La ChR2 a ainsi grandement contribué à notre compréhension des mécanismes responsables de pathologies complexes comme l’anxiété [
1], et a permis de relier l’activité de certains types neuronaux à des comportements précis, comme dans le cas des neurones cholinergiques du noyau accumbens [
2]. Pourtant une illumination à champ large n’est pas suffisante pour répondre à certaines questions, concernant par exemple la connectivité interne des circuits neuronaux, qui demande une résolution cellulaire ou subcellulaire. Un contrôle tridimensionnel de l’illumination permettrait de sélectionner un sous-groupe de neurones parmi ceux qui expriment le promoteur lié aux protéines photosensibles, ou même de cibler un compartiment cellulaire comme une dendrite. Cette précision est nécessaire pour analyser l’intégration des signaux des différents compartiments cellulaires et comprendre le traitement de l’information par le neurone. |
Illumination biphotonique de la ChR2 Une illumination biphotonique [
3] permet d’obtenir un contrôle dans les trois dimensions spatiales. En effet, de plus grandes longueurs d’onde améliorent la pénétration du faisceau laser et le confinement axial est obtenu grâce à l’effet non linéaire biphotonique
(Figure 1)
.
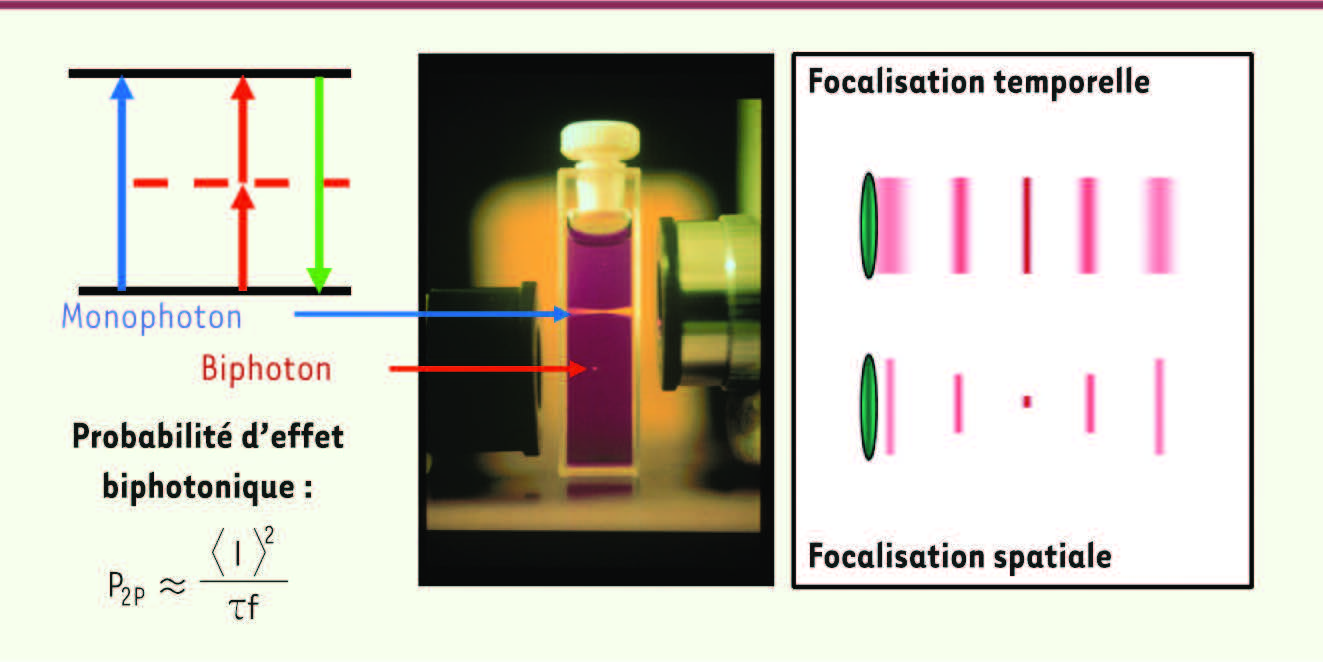
 | Figure 1.
Effet biphotonique. L’excitation biphotonique se base sur l’absorption « simultanée » de deux photons (rouge ou infrarouge) pour qu’une molécule (fluorophore ou outil optogénétique) passe de l’état de repos à l’état excité. La probabilité de cet effet dépend du carré de l’intensité d’excitation mais aussi de la durée d’impulsion, τ, et de la fréquence de répétition du laser, f. Dans la configuration classique (focalisation spatiale), la lumière est focalisée par l’objectif du microscope qui concentre l’intensité, et donc l’effet biphotonique, au point focal. La dépendance quadratique explique le confinement axial amélioré par rapport à l’excitation monophotonique. Quant à la focalisation temporelle, elle obtient un sectionnement optique en allongeant la durée d’impulsion en dehors du plan focal (d’où la diminution de la probabilité de l’effet biphotonique). Dans cette configuration, le confinement axial est conservé indépendamment de la surface excitée [
6] (image : Brad Amos/Science Photo Library, Londres). |
Néanmoins, l’application de l’illumination biphotonique classique (
Figure 1
gauche) à l’activation de la ChR2 présente plusieurs inconvénients qui en ont retardé l’utilisation. Le petit volume d’excitation balayé (environ 3 à 5 μm3) ne permet pas d’activer un nombre suffisant de canaux pour déclencher des potentiels d’action, compte tenu de la faible expression des canaux ioniques photosensibles dans la membrane neuronale et de leur faible conductance. Rickgauer et al. ont proposé une première solution pour résoudre ce problème en balayant le volume d’excitation rapidement dans l’échantillon [
4]. L’effet cumulatif de l’excitation est suffisant pour déclencher un potentiel d’action dans des neurones en culture, mais même à puissance saturante, le temps nécessaire pour atteindre le seuil de potentiel d’action est plus long (environ 30 ms) que le temps de fermeture des canaux de la ChR2 (environ 10 ms). Cette technique n’est donc pas idéale pour la génération de trains de potentiels d’action ou l’excitation de groupes de cellules. Une autre solution envisagée fut d’augmenter le volume d’excitation au-delà du volume biphotonique classique. Cependant, le confinement axial se dégrade avec l’accroissement du diamètre du spot d’excitation. Andrasfalvy et al. [
5] ont proposé de coupler l’illumination biphotonique par balayage avec la technique de focalisation temporelle (FT) (
Figure 1
à droite) [6] pour rétablir un sectionnement optique indépendamment de la résolution latérale de la zone d’excitation et pouvoir ainsi utiliser de plus larges spots d’excitation. Cette combinaison permet la génération de potentiels d’action sur des compartiments cellulaires ou sur le soma, mais la zone d’excitation n’est pas adaptable à la morphologie cellulaire. De plus, l’activation simultanée de plusieurs cellules reste difficile en raison du temps de balayage. |
Combinaison de la focalisation temporelle avec le contraste de phase généralisé (CPG-FT) En alternative au balayage, des méthodes d’illumination parallèle peuvent être utilisées pour photoexciter plusieurs structures simultanément. Ces dernières années, notre laboratoire a développé des méthodes d’illumination parallèle (telle que l’holographie numérique) qui, couplées avec la FT, permettent de générer des patrons complexes d’illumination laser, tout en contrôlant le confinement axial [
7,
8]. Dans la continuité de cette démarche, nous avons implémenté la technique du contraste de phase généralisé (CPG), qui permet de définir des zones d’excitation de forme arbitraire avec une précision latérale micrométrique [
9]. Le CPG, issu d’une évolution de la microscopie à contraste de phase, se base sur l’interférence entre deux composantes du faisceau laser, le « signal », qui porte l’information spatiale du patron, et la « référence » (non modulée spatialement), qui est retardée par un filtre de phase de façon à maximiser le contraste. Dans le CPG, le signal et la référence sont générés par une matrice de cristaux liquides, l’interférence entre ces deux composantes se produisant au plan de l’échantillon [9]. Fort de notre expérience avec la FT, nous avons couplé cette technique avec le CPG biphotonique
(Figure 2)
. Nous avons utilisé ce système pour l’excitation de neurones exprimant la ChR2. Deux exemples de résultats sont montrés dans la
Figure 2 C-D
pour des neurones pyramidaux du cortex dans des tranches de cerveau [
10]. Afin de maximiser les réponses neuronales à l’activation biphotonique de la ChR2, trois paramètres ont dû être optimisés : la surface d’excitation, la puissance et la durée de l’illumination. Pour chaque expérience, nous avons déterminé la surface d’excitation sur la base de la morphologie cellulaire, en exploitant la flexibilité du CPG. La durée d’impulsion était limitée par la désensibilisation de la ChR2, tandis que le seuil maximal de puissance était dicté par la nécessité d’éviter les dommages liés à l’illumination et de contenir le volume d’excitation. En général, un spot de 10 μm de diamètre, placé sur le soma du neurone, permettait de déclencher un potentiel d’action, avec une puissance de 0,5 mW/μm² environ et une durée d’impulsion de 10 ms. Des trains de potentiels d’action (jusqu’à une fréquence de 30 Hz) pouvaient aussi être générés par une séquence d’impulsions laser. Ce résultat a été obtenu dans plusieurs cellules simultanément, ce qui constitue un avantage de notre technique par rapport aux autres méthodes de photostimulation biphotonique de la ChR2. Nous avons également adapté les patrons de stimulation à des structures fines telles que les dendrites, apicales et basales, des neurones pyramidaux.
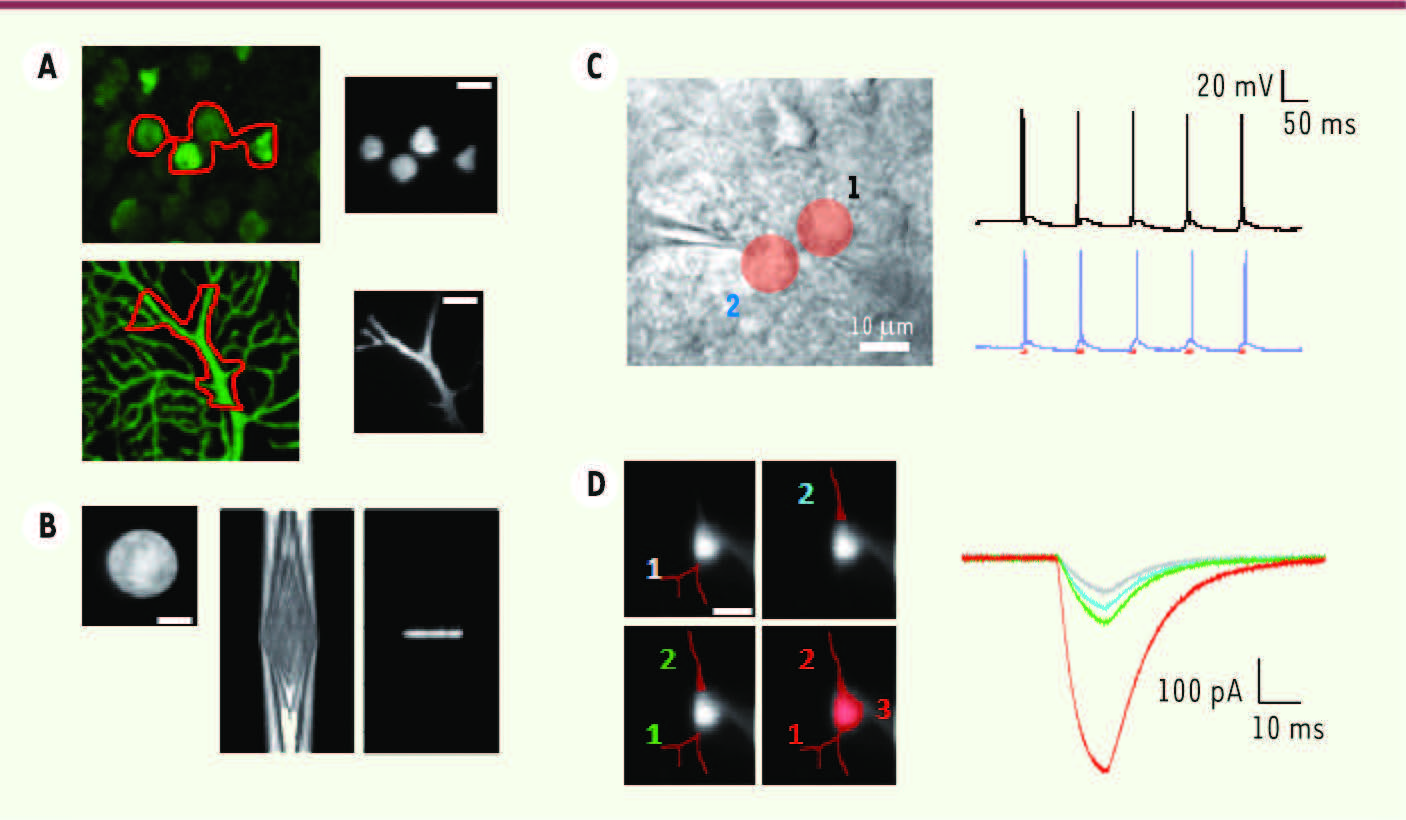
 | Figure 2.
Excitation de la ChR2 par CPG-FT. Deux patrons d’excitation ont été dessinés (A) pour cibler plusieurs corps cellulaires (haut) ou des dendrites (bas). Le résultat a été « imagé » sur une lamelle fluorescente (droite). Nous avons également mesuré la propagation axiale (B) d’un spot de 20 μm de diamètre (gauche), obtenu par CPG (centre) et CPG-FT (droite) : le confinement axial est amélioré par l’utilisation de la FT. L’illumination simultanée de deux neurones par des trains d’impulsions génère des séquences de potentiels d’action (enregistrées par électrophysiologie, C). L’excitation peut être dirigée aussi bien vers des dendrites (D) : l’amplitude des courants évoqués augmente avec la surface d’excitation (adapté de [ 10]) (échelles : 10 μm) .
|
En conclusion, notre technique permet la photoactivation biphotonique de la ChR2 avec une précision latérale et axiale micrométrique. Pour la première fois, nous avons démontré l’activation simultanée de plusieurs neurones ainsi que celle de sous-compartiments cellulaires. Cette technique pourrait être également utilisée avec d’autres outils optogénétiques ou composés cagés (on appelle ainsi des composés biologiques rendus inactifs par une « cage » photolysable) pour répondre à des questions biologiques importantes, aussi bien sur la connectivité locale des circuits neuronaux (étude de paire connectée, inhibition locale) que sur l’intégration dendritique (organisation spatiale des afférences synaptiques, plasticité). à |
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Tye
KM
,
Prakash
R
,
Kim
SY
, et al.
Amygdala circuitry mediating reversible and bidirectional control of anxiety . Nature.
2011; ; 471 : :358.–362. 2.
Witten
IB
,
Lin
SC
,
Brodsky
M
et al.
Cholinergic interneurons control local circuit activity and cocaine conditioning . Science.
2010; ; 330 : :1677.–1681. 3.
Denk
W
,
Strickler
JH
,
Webb
WW.
Two-photon laser scanning fluorescence microscope . Science.
1990; ; 248 : :73.–76. 4.
Rickgauer
JP
,
Tank
DW.
Two-photon excitation of channelrhodopsin-2 at saturation . Proc Natl Acad Sci USA.
2009; ; 106 : :15025.–15030. 5.
Andrasfalvy
BK
,
Zemelman
BV
,
Tang
J
,
Vaziri
A.
Two-photon single-cell optogenetic control of neuronal activity by sculpted light . Proc Natl Acad Sci USA.
2010; ; 107 : :11981.–11986. 6.
Oron
D
,
Tal
E
,
Silberberg
Y.
Scanningless depth-resolved microscopy . Opt Express.
2005; ; 13 : :1468.–1476. 7.
Lutz
C
,
Otis
TS
,
DeSars
V
, et al.
Holographic photolysis of caged neurotransmitters . Nat Methods.
2008; ; 5 : :821.–827. 8.
Papagiakoumou
E
,
de Sars
V
,
Oron
D
,
Emiliani
V.
Patterned two-photon illumination by spatiotemporal shaping of ultrashort pulses . Opt Express.
2008; ; 16 : :22039.–22047. 9.
Glückstad
J.
Phase contrast image synthesis . Optics Communications.
1996; ; 130 : :225.–230. 10.
Papagiakoumou
E
,
Anselmi
F
,
Bègue
A
, et al.
Scanless two-photon excitation of channelrhodopsin-2 . Nat Methods.
2010; ; 7 : :848.–854. |