| |
| Med Sci (Paris). 2011 June; 27(6-7): 572–573. Published online 2011 July 1. doi: 10.1051/medsci/2011276003.Interaction entre Escherichia coli et plaques de Peyer dans la maladie de Crohn Le rôle des long polar fimbriae Benoit Chassaing1* and Arlette Darfeuille-Michaud1** 1Pathogénie bactérienne intestinale, JE2526 Université d’Auvergne, USC-INRA 2018, CBRV, Facultés de médecine-pharmacie, 28, place Henri Dunant, BP 38,63001Clermont-Ferrand, France MeSH keywords: Adhésines d'Escherichia coli, physiologie, Animaux, Présentation d'antigène, Antigènes CD, Adhérence bactérienne, Molécules d'adhérence cellulaire, Maladie de Crohn, génétique, immunologie, microbiologie, Modèles animaux de maladie humaine, Cellules épithéliales, Escherichia coli, pathogénicité, ultrastructure, Protéines Escherichia coli, Fimbriae bactériens, Protéines liées au GPI, Prédisposition génétique à une maladie, Humains, Activation des lymphocytes, Souris, Souris knockout, Modèles immunologiques, Protéine adaptatrice de signalisation NOD2, Plaques de Peyer, anatomopathologie, Transcytose, Virulence |
Implication de bactéries invasives dans la maladie de Crohn La maladie de Crohn est une maladie inflammatoire chronique de l’intestin qui affecte environ 1 personne sur 1 000 dans les pays occidentaux, soit environ 2 millions de personnes dans le monde, et qui est caractérisée par un état d’hyperactivité du système immunitaire intestinal. Des études cliniques et épidémiologiques ont permis d’impliquer des facteurs environnementaux, génétiques et infectieux dans la survenue de cette maladie. En ce qui concerne les facteurs infectieux, il a été montré que la muqueuse iléale de patients atteints de la maladie de Crohn est anormalement colonisée par des souches de Escherichia coli appartenant à un groupe de bactéries pathogènes dénommées adherent-invasive E. coli (AIEC), capables d’adhérer et d’envahir les cellules de la muqueuse intestinale et également de se multiplier dans les cellules épithéliales et les macrophages de l’hôte. La prévalence de souches AIEC au niveau iléal est de 36,4 % chez les patients atteints de MC contre seulement 6,2 % chez les sujets indemnes de pathologie inflammatoire intestinale [
1]. La forte colonisation de la muqueuse iléale par des bactéries AIEC est en relation avec une expression anormale de molécules CEACAM6 (carcinoembryonic antigen-related cell adhesion molecule 6) chez les patients [
2,
3]. L’expression accrue de CEACAM6, récepteur impliqué dans l’adhésion des AIEC, serait consécutive à la stimulation des cellules épithéliales intestinales par des cytokines pro-inflammatoires mais également à l’infection par ces bactéries qui sont ainsi capables de promouvoir leur propre colonisation. |
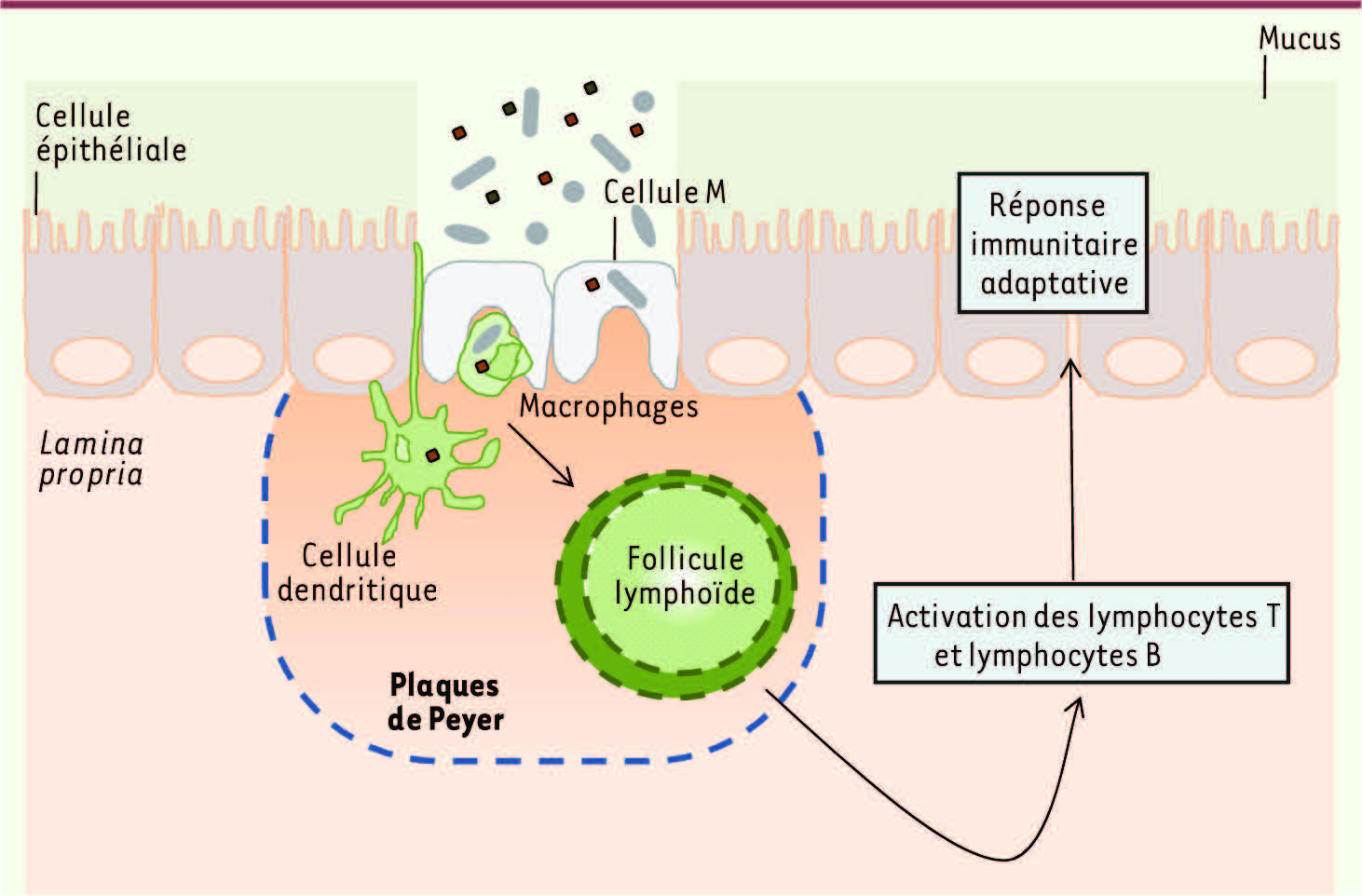
Cellules M des plaques de Peyer Les plaques de Peyer sont des acteurs majeurs du tissu lymphoïde associé à la muqueuse intestinale (MALT, mucosa associated lymphoid tissue). Il s’agit d’agrégats de follicules lymphoïdes principalement retrouvés dans l’iléon et le côlon. Les plaques de Peyer sont impliquées dans l’échantillonnage d’antigènes présents dans la lumière intestinale et dans leur présentation au système immunitaire sous-jacent [
4]. Cette fonction est rendue possible par la présence, au niveau de l’épithélium recouvrant les plaques de Peyer, de cellules spécialisées appelées cellules M (Figure 1). Les cellules M ont un fort pouvoir de transcytose, ce qui permet aux antigènes présents dans la lumière intestinale de traverser la barrière épithéliale. La présentation antigénique aboutit à l’activation de lymphocytes T et B et à la mise en place d’une réponse immunitaire adaptative.
 | Figure 1
Organisation schématique des plaques de Peyer associées à la paroi intestinale. L’échantillonnage antigénique réalisé par les cellules M permet la présentation antigénique au système immunitaire sous-jacent (macrophages et cellules dendritiques) pour la mise en place d’une réponse immunitaire adaptative mettant en jeu les lymphocytes T et B. |
Plusieurs études cliniques ont montré que les plaques de Peyer jouent un rôle important dans l’initiation de la maladie de Crohn. En effet, les observations cliniques suggèrent que les sites initiaux de l’inflammation chez les patients apparaissent au niveau des follicules lymphoïdes, avec des lésions aphtoïdes1 très précoces au niveau de l’épithélium recouvrant les plaques de Peyer [
5,
6]. Implication des long polar fimbriae dans le ciblage des plaques de Peyer par les bactéries AIEC Sur la base des données bibliographiques, une étude européenne collaborative a été menée afin de déterminer si les bactéries AIEC associées à la maladie de Crohn pourraient être à l’origine des lésions précoces au niveau des plaques de Peyer chez les patients atteints de maladie de Crohn [
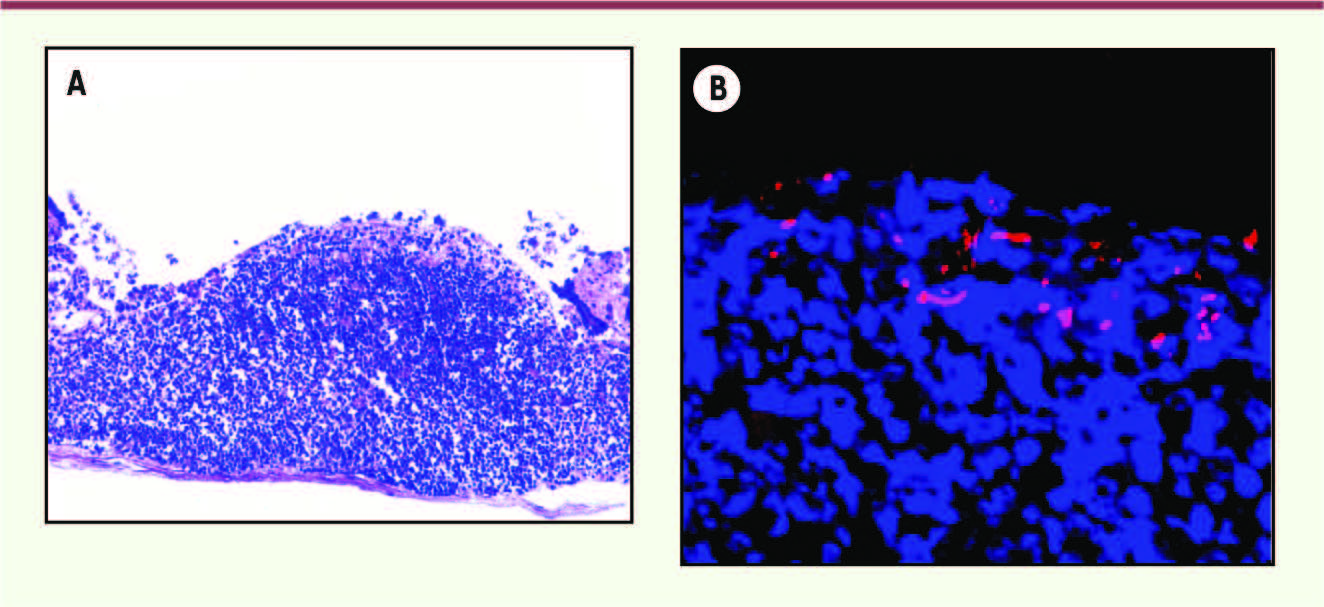
7]. L’analyse de la séquence du génome de la souche AIEC de référence LF82 a permis de mettre en évidence la présence d’un groupe de gènes composant l’opéron lpf, codant les long polar fimbriae (LPF). Les LPF sont des appendices filamenteux exprimés à la surface des bactéries et susceptibles de permettre l’adhésion des bactéries à des cellules hôtes. De manière intéressante, l’inactivation de l’opéron lpf par mutagenèse dirigée conduit à une diminution drastique du pouvoir d’interaction de la souche AIEC LF82 avec des plaques de Peyer murines ou humaines. L’analyse à l’échelle cellulaire de l’interaction entre bactéries AIEC et plaques de Peyer a montré que les LPF permettent l’adhésion des bactéries aux cellules M présentes au niveau de l’épithélium recouvrant les plaques de Peyer (Figure 2).  | Figure 2
Interaction des bactéries AIEC avec une plaque de Peyer. A. Visualisation d’une plaque de Peyer murine après coloration à l’hématoxyline-éosine. B. Visualisation des bactéries AIEC (en rouge) par hybridation à l’aide d’une sonde fluorescente. Les noyaux des cellules sont colorés en bleu par le Hoechst. |
Une interaction augmentée entre bactéries AIEC et plaques de Peyer pourrait exister chez les patients présentant des mutations du gène NOD2 (nucleotide-binding oligomerization domain containing 2). Ce gène, premier gène de susceptibilité mis en évidence chez les patients atteints de maladie de Crohn [
8], code pour le récepteur intracytoplasmique NOD2 capable d’initier une réponse innée des cellules hôtes en réponse à une stimulation par le muramyl dipeptide bactérien. Une étude antérieure utilisant un modèle murin invalidé pour le récepteur Nod2 avait montré que les plaques de Peyer de ces animaux présentaient à leur surface un nombre de cellules M trois fois plus important que celui des animaux sauvages [
9]. Nous avons montré qu’une telle augmentation du nombre de cellules M permet à un plus grand nombre de bactéries AIEC exprimant les LPF d’interagir avec les plaques de Peyer d’animaux invalidés pour le gène nod2. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Nous remercions pour leur soutien l’Association François Aupetit dédiée à l’amélioration des connaissances sur les maladies inflammatoires chroniques intestinales (maladie de Crohn et rectocolite hémorragique), l’Institut national de la recherche agronomique et le ministère de l’Enseignement supérieur et de la Recherche.
|
Footnotes |
1.
Darfeuille-Michaud
A
,
Boudeau
J
,
Bulois
P
, et al.
High prevalence of adherent-invasive Escherichia coli associated with ileal mucosa in Crohn’s disease . Gastroenterology.
2004; ; 127 : :412.-421. 2.
Barnich
N
,
Carvalho
FA
,
Glasser
AL
, et al.
CEACAM6 acts as a receptor for adherent-invasive E. coli, supporting ileal mucosa colonization in Crohn disease . J Clin Invest.
2007; ; 117 : :1566.-1574. 3.
Carvalho
FA
,
Barnich
N
,
Sivignon
A
, et al.
Crohn’s disease adherent-invasive Escherichia coli colonize and induce strong gut inflammation in transgenic mice expressing human CEACAM . J Exp Med.
2009; ; 206 : :2179.-2189. 4.
Kiyono
H
,
Fukuyama
S
. NALT- versus Peyer’s-patch-mediated mucosal immunity . Nat Rev Immunol.
2004; ; 4 : :699.-710. 5.
Morson
BC
. The early histological lesion of Crohn’s disease . Proc R Soc Med.
1972; ; 65 : :71.-72. 6.
Gullberg
E
,
Soderholm
JD
. Peyer’s patches and M cells as potential sites of the inflammatory onset in Crohn’s disease . Ann N Y Acad Sci.
2006; ; 1072 : :218.-232. 7.
Chassaing
B
,
Rolhion
N
,
de Vallée
A
, et al.
Crohn disease-associated adherent-invasive E. coli bacteria target mouse and human Peyer’s patches via long polar fimbriae . J Clin Invest.
2011; ; 121 : :966.-975. 8.
Hugot
JP
,
Chamaillard
M
,
Zouali
H
, et al.
Association of NOD2 leucine-rich repeat variants with susceptibility to Crohn’s disease . Nature.
2001; ; 411 : :599.-603. 9.
Barreau
F
,
Meinzer
U
,
Chareyre
F
. CARD15/NOD2 is required for Peyer’s patches homeostasis in mice . PLoS One.
2007; ; 2 : :e523.. |