| |
| Med Sci (Paris). 2011 May; 27(5): 514–520. Published online 2011 May 25. doi: 10.1051/medsci/2011275017.Signalisation et prédispositions métaboliques liées au cancer colorectal Stéphanie Olivier,1 Anne-Marie Mir,1 Jean-Claude Michalski,1 and Tony Lefebvre1* 1CNRS-UMR 8576, unité de glycobiologie structurale et fonctionnelle, IFR 147, bâtiment C9, Université de Lille 1, avenue Mendeleiev, Cité scientifique, 59655Villeneuve d’Ascq, France |
Le cancer colorectal (CCR) résulte d’une succession d’altérations génétiques qui affectent certains oncogènes, suppresseurs de tumeur ou gènes de stabilité de l’ADN [
32]. Ces altérations sont d’origines diverses. On distingue l’instabilité chromosomique (CIN pour chromosomal instability) responsable d’une perte importante du nombre de copies de gènes ou d’un fragment de chromosome, et l’instabilité microsatellitaire (MSI pour microsatellite instability), correspondant à une modification de gènes qui contiennent des séquences microsatellites. La séquence de mutations des oncogènes et suppresseurs de tumeur qui conduit à l’altération de voies de signalisation précises définit la progression du CCR : c’est la séquence de Fearon et Vogelstein (Figure 1) [
1,
2]. Les voies qui activent la prolifération cellulaire sont stimulées (Wnt, RTK [récepteurs à activité tyrosine kinase]) et les voies de réparation de l’ADN, de l’arrêt du cycle cellulaire et de l’apoptose sont inactivées (TGF , p53).
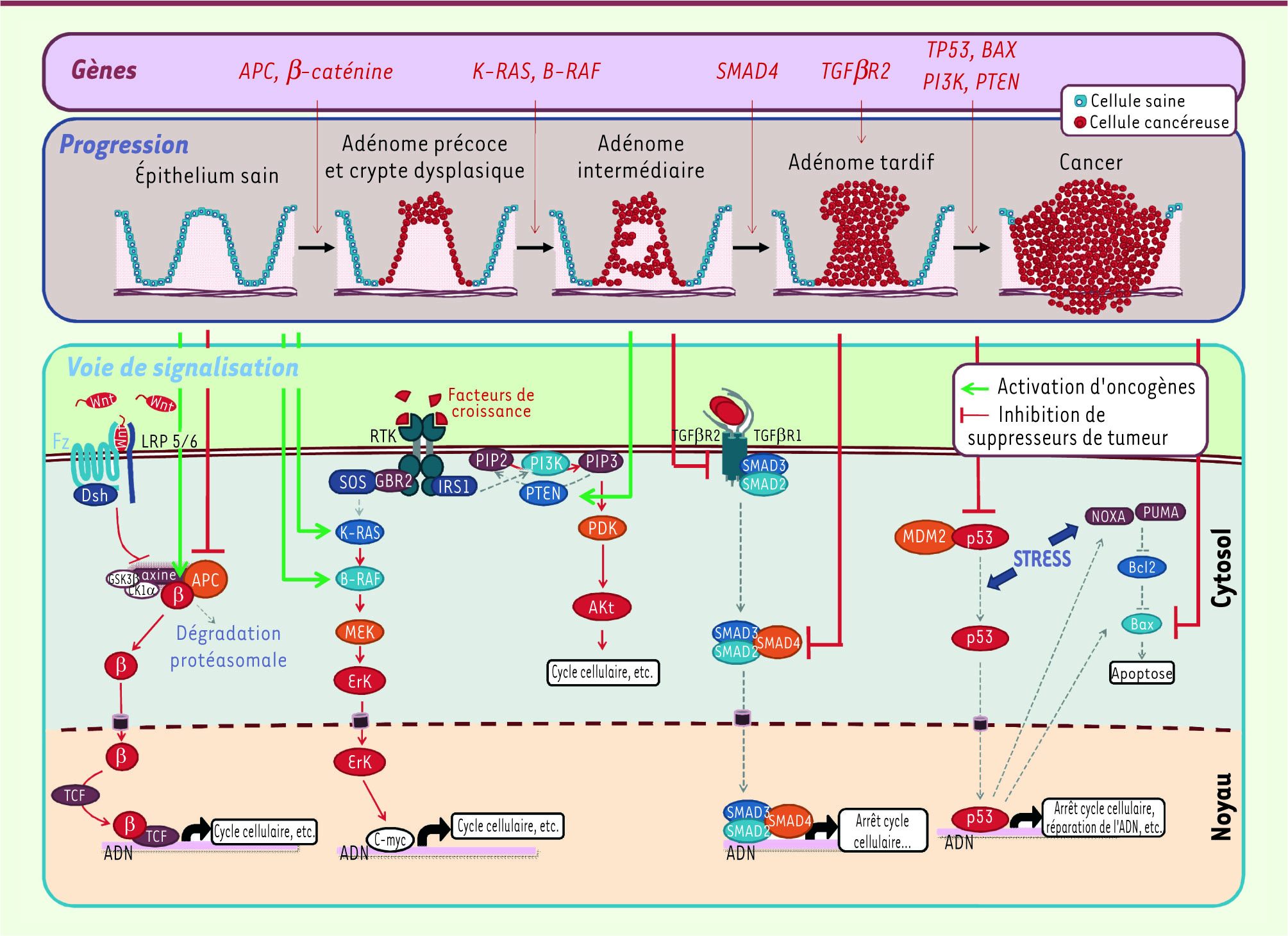
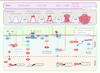 | Figure 1.
Mécanisme moléculaire du CCR. La mise en place et la progression du cancer colorectal (CCR) (progression de l’épithélium sain vers l’adénome puis au cancer) sont des processus multi-étapes. Progressivement les cellules des muqueuses colique et rectale sont le siège de mutations ou de défaillances qui permettent la transition d’une étape à l’autre. Dans bon nombre de CCR, c’est la voie Wnt/β-caténine (étape initiatrice) qui est à l’origine de cette longue marche vers le cancer (l’ensemble de ces événements peut mettre entre dix et vingt ans avant d’aboutir à un cancer véritable). Pour les abréviations voir le texte (partie supérieure adaptée de [
31]). |
|
Mécanismes moléculaires au service du cancer colorectal La voie Wnt/β-caténine : l’initiation de la cancérisation L’altération de la voie Wnt/β-caténine est dans 90 % des cas l’élément initiateur du processus de cancérisation des muqueuses colique et rectale, et correspond à l’apparition d’un adénome précoce (cryptes dysplasiques). Cette voie de signalisation est fondamentale pour le contrôle de l’embryogenèse et le renouvellement de l’épithélium des cryptes intestinales [
3]. Au cours de ces processus, les cellules sont stimulées par des facteurs Wnt, ce qui provoque la formation d’un complexe membranaire constitué du récepteur Frizzled (Fz) couplé au corécepteur LRP5/6 ( low-density lipoprotein-related receptor protein) et de Dishevelled (Dsh). Après phosphorylation de Dsh et de LRP5/6, l’axine est recrutée à la membrane. Cette protéine d’échafaudage est le facteur-clé du complexe de destruction de la β -caténine : son recrutement à la membrane empêche donc la dégradation de la β -caténine, élément central de la voie Wnt. En absence de stimulation, la β -caténine est séquestrée dans un complexe formé de l’axine, d’APC ( adenomatous polyposis coli) et des kinases GSK3 β (glycogène synthase kinase 3 β) et CK1α (caséine kinase 1). La β-caténine subit tout d’abord une série de phosphorylations dans une région appelée boîte de destruction (D- box), puis est la cible de l’ubiquitine ligase β-TrCp (β -transducin repeat containing protein). L’ubiquitinylation de la β-caténine provoque sa dégradation protéasomale. Le recrutement de l’axine à la membrane en réponse aux facteurs Wnt bloque ce processus de dégradation. La β -caténine migre alors dans le noyau où elle s’associe au T-cell factor (TCF) pour former un facteur de transcription ciblant entre autres les gènes du cycle cellulaire (cycline D1, c-myc, etc.). Les premiers dérèglements observés dans la cancérogenèse colique sont dus pour 85 % des cas à des altérations génétiques d’APC qui conduisent à des formes tronquées de la protéine [
4] incapables de s’associer avec la β -caténine ; celle-ci n’étant plus dégradée, la prolifération cellulaire est incontrôlée. On observe également en moindre proportion des mutations au niveau de la D- box de la β -caténine empêchant sa phosphorylation et sa dégradation. La compréhension de ces premiers dérèglements est essentielle pour la détection précoce des CCR et leur traitement. Les voies de signalisation associées aux récepteurs à activité tyrosine kinase : la progression du CCR Les récepteurs à activité tyrosine kinase sont des éléments essentiels de la prolifération cellulaire ; ils permettent la transmission au sein de la cellule de l’information portée par des facteurs de croissance tels que l’EGF ( epidermal growth factor). Deux voies de signalisation majeures sont activées par ces récepteurs : la voie MAPK ( mitogen-activated protein kinase) et la voie PI3K (phosphatidylinositol 3 kinase)/Akt, stimulant de concert la prolifération cellulaire et inhibant l’apoptose. Ces deux voies sont la cible d’altérations génétiques au cours de la cancérogenèse colique, ce qui entraîne le passage vers un adénome tardif (cryptes dysplasiques). Dans une cellule saine, la phosphorylation des récepteurs à activité tyrosine kinase qui intervient en réponse aux facteurs de croissance permet le recrutement de protéines relais qui possèdent un domaine SH2 ( Src homology 2), comme SHC ( Src homology 2 domain-containing), Grb2 ( growth factor receptor-bound protein 2) ou encore PI3K. SHC et Grb2, via l’oncogène K-Ras, stimulent la voie MAPK constituée de la cascade de kinases suivante : Raf (MAPKKK), MEK (MAPKK) et Erk (MAPK), cette dernière étant la protéine centrale de cette voie [
5]. Erk active par phosphorylation différents facteurs de transcription parmi lesquels c-myc et c-fos, impliqués dans la prolifération cellulaire. De plus, Erk entraîne la séquestration de Bad et inhibe la caspase-9, bloquant ainsi les processus apoptotiques. Il est intéressant de noter que ces deux protéines sont également inactivées par la voie PI3K/Akt, ce qui indique une action concertée de ces deux voies de signalisation. Lors de la cancérogenèse colique, des mutations activatrices de K-Ras ou de B-Raf (37 % et 13 % des CCR respectivement) permettent l’activation constitutive de la voie MAPK et la prolifération anarchique des cellules des cryptes intestinales [
6,
7]. Celles-ci sont également capables d’échapper à l’apoptose, une caractéristique majeure des cellules cancéreuses. Une autre caractéristique est l’autosuffisance en facteurs de croissance initiée par la stimulation de cette voie (capacité d’activer des gènes codant des facteurs de croissance comme le facteur angiogénique VEGF) [5]. Comme pour les protéines relais, la sous-unité régulatrice p85 de la PI3K est elle aussi capable de se fixer aux résidus phosphorylés de ces récepteurs à activité tyrosine kinase. Après recrutement de la sous-unité catalytique p110, PI3K catalyse la transformation du PIP2 (phosphatidylinositol-4,5-bisphosphate) en PIP3 (phosphatidylinositol-3,4,5-triphosphate). La réaction inverse est catalysée par le suppresseur de tumeur PTEN (phosphatase and tensin homolog). L’accumulation de PIP3 recrute des protéines à domaine PH (pleckstrin homology) comme PDK1 (phosphatidylinositol-dependent protein kinase-1) puis Akt/PKB (protéine kinase B). Après activation par PDK1, PI3K module l’activité de nombreuses cibles impliquées dans l’apoptose et le cycle cellulaire (Bad, procaspase-9, p21, etc.) [
8]. De plus, la voie PI3K/Akt interagit avec la voie Wnt/β-caténine en inhibant GSK3 , ce qui souligne les relations entre les différentes voies de signalisation. Parmi les CCR, 30 % ont une mutation activatrice de la sous-unité catalytique de PI3K et 13 % des altérations qui inactivent le suppresseur de tumeur PTEN [
9,
10]. Ces deux modifications permettent l’accumulation de PIP3 à la membrane et la stimulation incontrôlée de la voie PI3K/Akt. Les altérations génétiques de ces deux voies sont problématiques, notamment pour le traitement des cancers par des anticorps dirigés contre certains récepteurs de facteurs de croissance (cétuximab : anti-EGFR) [
33]. Une mutation de ces voies (Ras, Raf, PI3K) rend le traitement inefficace chez ces patients. Les mutations du TGFbR2 et de p53 : progression vers le cancer invasif Ces deux voies de signalisation contrôlent la croissance cellulaire en déclenchant l’apoptose et l’arrêt du cycle cellulaire. Ce sont donc des voies anticancéreuses qui doivent être inactivées pour que la tumeur progresse vers un stade invasif. Afin de stopper la prolifération cellulaire, la cellule stimule la voie du TGF (transforming growth factor β) par action autocrine. La fixation du TGF à la sous-unité II du récepteur permet la formation d’un complexe hétérodimérique avec la sous-unité I et sa phosphorylation. Une fois activée, cette dernière phosphoryle les facteurs de transcription Smad2 et Smad3, leur permettant de se complexer à Smad4, qui est nécessaire à la translocation nucléaire du complexe. Le complexe Smad2/3/4 s’associe avec d’autres protéines telles que p21 ou la survivine pour les réguler [
11]. Cette voie de signalisation doit être désactivée pour la progression tumorale des cellules coliques. Près d’un tiers des CCR possède des mutations de la sous-unité II du récepteur du TGF inactivant la transduction du signal [
12]. On peut également trouver des mutations inactivatrices des composants en aval de cette voie comme Smad4 (20 % des CCR) [
13]. Une des conséquences de la réplication anarchique des cellules cancéreuses est l’apparition de dommages à l’ADN ou de défauts de la division cellulaire. Si elles ne sont pas réparées correctement, ces erreurs déclenchent l’apoptose par le biais de p53, peu exprimée dans la cellule saine puisque dégradée sous l’impulsion de l’ubiquitine ligase MDM2 (murine double minute 2). Lors d’un stress (lésions de l’ADN), MDM2 est inhibé, conduisant à l’accumulation de p53. Après avoir été la cible de nombreuses modifications post-traductionnelles, p53 active la transcription de gènes cibles qui, comme pour la voie du TGF , ont pour but dans un premier temps l’arrêt du cycle cellulaire puis la mort cellulaire programmée (p21, Puma, Noxa, Bax, etc.) [
14]. La mutation de p53 (45 % des CCR) est donc une des dernières étapes avant la métastase des cellules cancéreuses coliques et elle provoque la non-réparation des erreurs de réplication et l’échappement définitif à l’apoptose [
15]. Enfin, plus directement et en parallèle, on observe des mutations de protéines-clés de l’apoptose comme Bax [
16]. Bien que les acteurs et les mécanismes de la cancérogenèse colique soient bien décrits, les causes des premiers dérèglements menant aux CCR restent incertaines. Néanmoins, plusieurs facteurs de risque sont connus, parmi lesquels le syndrome métabolique ou la suralimentation. |
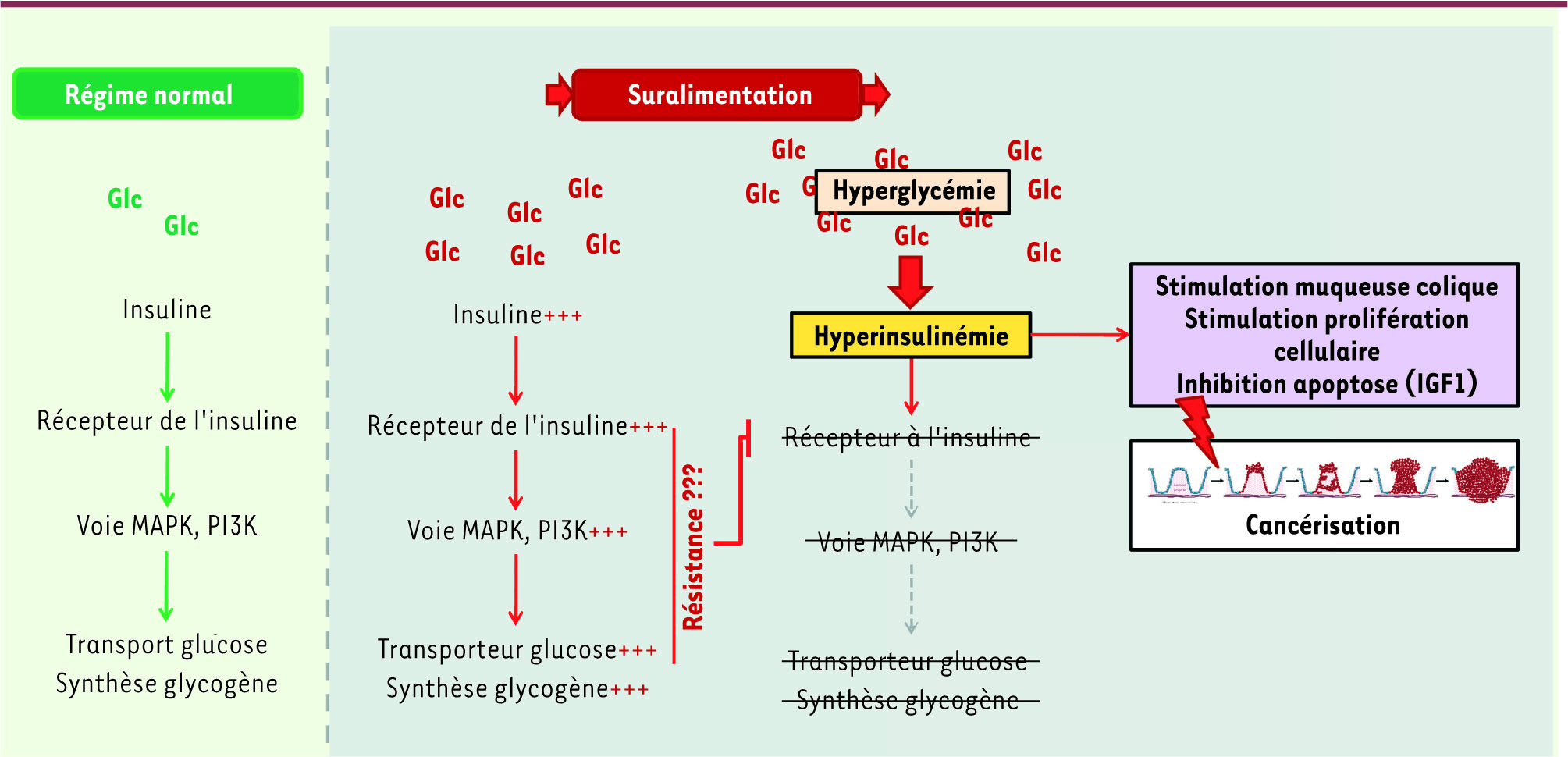
L’émergence du cancer colorectal : importance des facteurs de risque Alimentation, glucides et CCR L’alimentation a depuis longtemps été décrite comme un facteur-clé dans l’émergence du CCR. Certains nutriments, comme les glucides, jouent un rôle particulier dans ce processus. En effet, une forte consommation de sucres augmente considérablement la probabilité de déclencher un cancer colorectal [
17,
18]. De plus, l’hyperglycémie est une des caractéristiques du syndrome métabolique, pathologie associée aux CCR et favorisant la mise en place de la résistance à l’insuline. Cette résistance, observée notamment chez les diabétiques de type 2, permettrait de faire le lien entre l’hyperglycémie et l’initiation des CCR. La résistance à l’insuline, un facteur favorisant la tumorigenèse ? Dans un organisme sain, les cellules β pancréatiques synthétisent l’insuline nécessaire au transport et au stockage du glucose. L’ingestion prolongée ou trop importante de nutriments stimule de manière excessive la voie de l’insuline, provoquant peu à peu une désensibilisation et une diminution de la réponse attendue. Pour compenser cette perte d’efficacité qui mène à l’hyperglycémie, l’organisme synthétise de plus en plus d’insuline : c’est l’hyperinsulinémie. On sait depuis le milieu des années 1990 que des patients atteints de CCR ont une intolérance au glucose et une résistance à l’insuline (taux d’insuline sérique triple de la normale) [
19,
20]. De plus, les diabétiques de type 2 ont un risque de déclencher un CCR très supérieur à celui d’individus sains [
21]. La question posée est celle du mécanisme moléculaire qui fait le lien entre la résistance à l’insuline et le CCR. L’hyperinsulinémie exerce de nombreux effets néfastes sur l’organisme (Figure 2). Parmi ceux-ci, on note que la surexposition de tissus normalement peu ou pas exposés à l’insuline mais possédant toutefois le récepteur hormonal, c’est le cas du côlon, déclenche l’activation des voies de signalisation impliquées dans la progression tumorale. À cela il faut ajouter que l’insuline favorise la stimulation cellulaire par d’autres facteurs de croissance comme l’IGF-1 ( insulin growth factor-1) accentuant par conséquent la prolifération cellulaire et l’apparition d’erreurs aberrantes de l’ADN, ce qui se traduit par la cancérisation du tissu [
22].
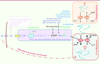
 | Figure 2.
La résistance à l’insuline : un facteur favorisant la cancérisation des muqueuses coliques ? Un déséquilibre alimentaire serait responsable d’une plus forte propension à développer un cancer colorectal. Dans certaines pathologies telles que le diabète de type 2 mais également chez les patients souffrant de syndrome métabolique, une suralimentation et une exposition prolongée au glucose aboutissent progressivement au phénomène de résistance à l’insuline caractérisée par une défaillance de régulation de certaines voies de signalisation (PI3K et MAPK en particulier). Ces problèmes d’ordre moléculaire se manifestent pour certains d’entre eux par l’émergence de cancers, c’est le cas des cancers colorectaux. |
Bien que les relations entre les désordres métaboliques et les CCR soient bien connues aujourd’hui, on peine encore à expliquer le processus intime liant ces deux groupes de pathologies. Pour tenter de comprendre les mécanismes sous-jacents, il semble crucial de mieux maîtriser l’impact de l’alimentation et de la résistance à l’insuline sur la cancérisation. La régulation des voies de signalisation impliquées dans l’étiologie des CCR par la O-N-acétylglucosaminylation, une modification post-traductionnelle qui dépend directement du statut nutritionnel de l’organisme, pourrait apporter quelques réponses. |
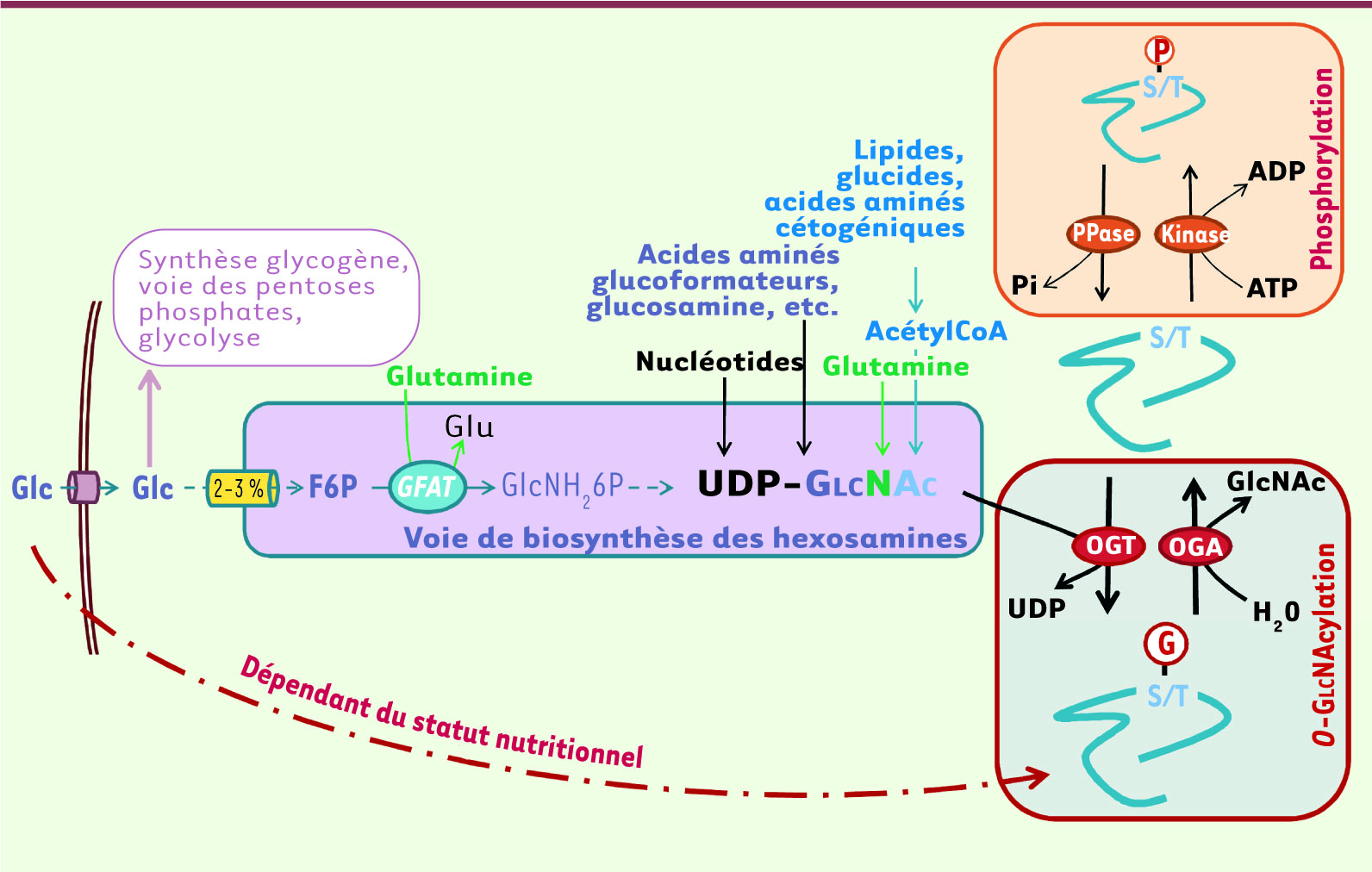
La O-GlcNAcylation, senseur nutritionnel de l’organisme La O-GlcNAcylation La O-N-acétylglucosaminylation ( O-GlcNAcylation) est une glycosylation un peu originale [
23] (Figure 3). En effet, contrairement aux glycosylations dites « classiques » ( N- et O-glycosylations complexes) des protéines sécrétées, membranaires ou résidentes du réticulum endoplasmique ou du Golgi, la O-GlcNAcylation affecte les protéines cytosoliques, nucléaires et mitochondriales. De plus, c’est une modification dynamique qui consiste en l’ajout d’un résidu unique de N-acétylglucosamine (GlcNAc) sur un résidu sérine ou thréonine. Cette versatilité fait de la O-GlcNAcylation un compétiteur de la phosphorylation, modification post-traductionnelle avec laquelle elle est souvent comparée. Contrairement aux phénomènes de phosphorylation qui sont contrôlés par plus de 1 000 kinases et plus de 150 phosphatases, le dynamisme de la O-GlcNAcylation est régulé par un couple unique d’enzymes. La O-GlcNAc transférase (OGT) catalyse l’ajout d’un résidu de GlcNAc sur la protéine à partir d’UDP-GlcNAc, produit final de la voie de biosynthèse des hexosamines. La O-GlcNAcase (OGA) hydrolyse quant à elle ce même résidu. Le caractère dynamique de la O-GlcNAcylation et l’utilisation de l’UDP-GlcNAc comme substrat en font un senseur nutritionnel pour la cellule. En effet, les niveaux de O-GlcNAcylation sont intimement corrélés avec le niveau d’UDP-GlcNAc disponible, qui dépend lui-même du glucose qui entre dans la cellule. Par cet aspect, elle fait le lien entre l’état nutritionnel et la régulation des processus biologiques fondamentaux comme la transcription, la traduction, la signalisation cellulaire, le trafic intracellulaire, le cycle cellulaire ou le développement [ 23].
 | Figure 3.
La O-GlcNAcylation : un senseur nutritionnel. Un niveau très bas de glucose circulant emprunte, après son transport dans la cellule, la voie de biosynthèse des hexosamines. Cette voie aboutit à la formation d’UDP-GlcNAc, un nucléotide-sucre majeur utilisé dans les processus de glycosylations simples et complexes. Parmi ces glycosylations on retrouve la O-GlcNAcylation, modification post-traductionnelle réversible et capable de bloquer certains sites de phosphorylation : c’est l’antagonisme phosphorylation/O-GlcNAcylation. D’autres sources nutritionnelles ou métaboliques sont également capables de pourvoir aux besoins cellulaires en UDP-GlcNAc (acides aminés, acides gras, nucléotides, etc.). C’est pourquoi ce nucléotide-sucre ainsi que la O-GlcNAcylation sont considérés comme des senseurs nutritionnels puisque leur concentration reflète l’état nutritionnel de l’organisme dans son ensemble. Puisque la O-GlcNAcylation entre en compétition avec certains sites de phosphorylation, les conditions nutritionnelles d’un organisme ont également un impact sur les processus de phosphorylation-déphosphorylation. Glc, glucose ; F6P, fructose-6-phosphate ; GlcNH26P, glucosamine-6-phosphate ; UDP, uridine diphosphate ; UDP-GlcNAc, uridine diphospho-N-acétylglucosamine ; OGT, O-GlcNAc transférase ; OGA, O-GlcNAcase ; G, O-GlcNAc ; P, phosphate ; GlcNAc, N-acétylglucosamine ; Glu, glutamate ; GFAT, glutamine : fructose-6-phosphate amido-transférase ; ADP, adénosine diphosphate ; ATP, adénosine triphosphate ; PPase, protéine phosphatase. |
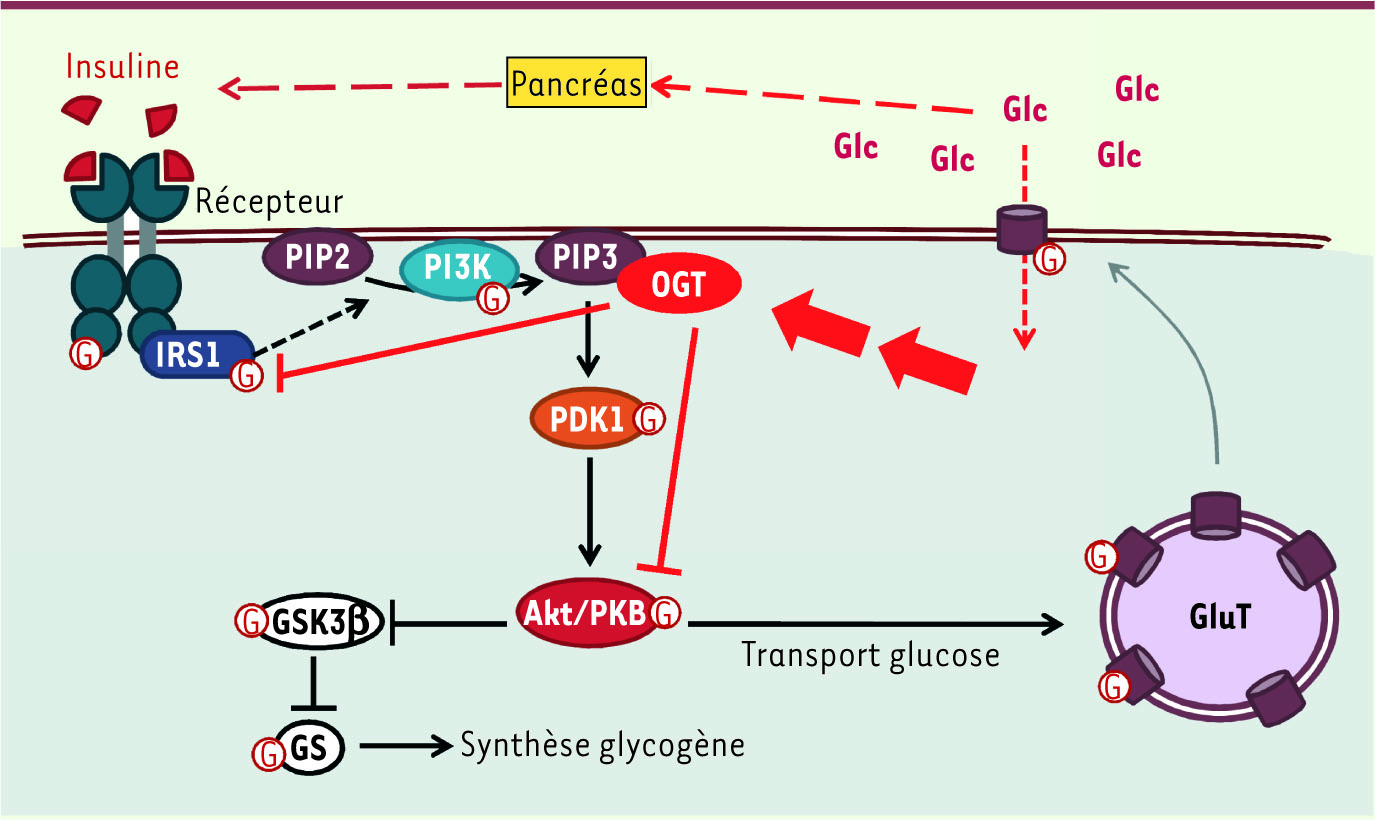
La O-GlcNAcylation : entre alimentation et résistance à l’insuline De nombreux éléments de la voie de signalisation de l’insuline sont O-GlcNAcylés : chaîne du récepteur de l’insuline, IRS1/2 ( insulin responsive substrate), PDK1, p110PI3K, Akt1/2, GSK3, GLUT4. L’hyperglycémie, par le biais de la voie de biosynthèse des hexosamines, augmenterait la O-GlcNAcylation des protéines cibles de l’OGT, et plus particulièrement IRS1 et Akt/PKB. En réponse à l’insuline, l’OGT est rapidement recrutée à la membrane par son interaction avec le PIP3 (lui-même s’accumule en cas de suractivation de PI3K ou de défaillance de PTEN, voir plus haut). La O-GlcNAcylation de IRS1 et Akt, en restreignant leur phosphorylation, bloque leur activité, induisant la résistance à l’insuline [
24] (Figure 4). Par cette séquence d’événements, la O-GlcNAcylation pourrait être un élément faisant le lien entre l’hyperglycémie, la résistance à l’insuline et la cancérisation des cellules coliques.
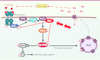 | Figure 4.
La O-GlcNAcylation favorise la désensibilisation de la voie de l’insuline observée dans de nombreux syndromes métaboliques. L’insuline, en se fixant sur son récepteur, active la voie PI3kinase. Cette activation se traduit par une série de phosphorylations qui aboutit à une réponse cellulaire, notamment un transport et une utilisation accrus du glucose (mis en réserve sous forme de glycogène). Il a été démontré que l’OGT (O-GlcNAc transférase) inactive cette signalisation par O-GlcNAcylation de certains composants de cette voie dont Akt/PKB : cette inactivation serait en partie à l’origine du phénomène de résistance à l’insuline. G : O-GlcNAc. |
La O-GlcNAcylation affecte de nombreux oncogènes et suppresseurs de tumeur Il a été décrit que de nombreux facteurs impliqués dans les processus de cancérisation ou dans la régulation du cycle cellulaire étaient O-GlcNAcylés. Parmi ceux-ci on retrouve c-myc, oncogène fréquemment surexprimé dans les cancers et muté dans les lymphomes de Burkitt ; il est O-GlcNAcylé sur un site de phosphorylation (T58) responsable de sa dégradation [
25]. P53 est également O-GlcNAcylé sur un résidu (T149) proche d’un site de phosphorylation (T155) responsable de la dégradation et du changement d’activité de la protéine [
26]. Certains composants de la voie MAPK sont O-GlcNAcylés comme Erk2 [
27]. Une corrélation entre l’augmentation des niveaux de O-GlcNAcylation et l’activation de la voie MAPK dans l’ovocyte de xénope a été démontrée [
28]. L’oncogène β -caténine est également O-GlcNAcylé [
29] mais le rôle de sa O-GlcNAcylation reste flou. Néanmoins, l’étude d’une protéine similaire, la plakoglobine, qui possède le même système de dégradation (phosphorylation d’une D-box conduisant à la dégradation) nous permet d’émettre quelques hypothèses. La plakoglobine est O-GlcNAcylée sur un résidu adjacent à la D-box, ce qui entraîne une compétition avec la phosphorylation et la stabilisation de celle-ci [
30]. Un mécanisme similaire pourrait expliquer l’initiation de la cancérisation de la muqueuse colorectale et permettre d’établir un lien étroit entre la suralimentation, la production excessive d’UDP-GlcNAc (donneur du motif O-GlcNAc) par la voie des hexosamines, l’élévation des niveaux de O-GlcNAcylation et une suractivation de la voie Wnt/β-caténine par stabilisation aberrante de son élément central : la β -caténine. Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
Les auteurs remercient le Comité Nord de la Ligue nationale contre le concer pour le financement de leurs travaux de recherche.
|
1.
Fearon
ER
,
Vogelstein
B
. A genetic model for colorectal tumorigenesis . Cell.
1990; ; 61 : :759.-767. 2.
Markowitz
SD
,
Bertagnolli
MM
. Molecular origins of cancer : Molecular basis of colorectal cancer . N Engl J Med.
2009; ; 361 : :2449.-2460. 3.
Reya
T
,
Clevers
H
. Wnt signalling in stem cells and cancer . Nature.
2005; ; 434 : :843.-850. 4.
Yang
J
,
Zhang
W
,
Evans
PM
, et al.
Adenomatous polyposis coli (APC) differentially regulates beta-catenin phosphorylation and ubiquitination in colon cancer cells . J Biol Chem.
2006; ; 281 : :17751.-17757. 5.
McCubrey
JA
,
Steelman
LS
,
Chappell
WH
, et al.
Roles of the Raf/MEK/ERK pathway in cell growth, malignant transformation and drug resistance . Biochim Biophys Acta.
2007; ; 1773 : :1263.-1284. 6.
Bos
JL
,
Fearon
ER
,
Hamilton
SR
,
Vogelstein
B
. Prevalence of ras gene mutations in human colorectal cancers . Nature.
1987; ; 327 : :293.-297. 7.
Davies
H
,
Bignell
GR
,
Cox
C
, et al.
Mutations of the BRAF gene in human cancer . Nature.
2002; ; 417 : :949.-954. 8.
Chang
F
,
Lee
JT
,
Navolanic
PM
, et al.
Involvement of PI3K/Akt pathway in cell cycle progression, apoptosis, and neoplastic transformation : a target for cancer chemotherapy . Leukemia.
2003; ; 17 : :590.-603. 9.
Samuels
Y
,
Wang
Z
,
Bardelli
A
, et al.
High frequency of mutations of the PIK3CA gene in human cancers . Science.
2004; ; 304 : :554.. 10.
Parsons
DW
,
Wang
TL
,
Samuels
Y
, et al.
Colorectal cancer : mutations in a signalling pathway . Nature.
2005; ; 436 : :792.. 11.
Xu
Y
,
Pasche
B.
TGF-beta signaling alterations and susceptibility to colorectal cancer . Hum Mol Genet.
2007; ; 16
(n° special 1) : :R14.-R20. 12.
Biswas
S
,
Trobridge
P
,
Romero-Gallo
J
, et al.
Mutational inactivation of TGFBR2 in microsatellite unstable colon cancer arises from the cooperation of genomic instability and the clonal outgrowth of transforming growth factor beta resistant cells . Genes Chromosomes Cancer.
2008; ; 47 : :95.-106. 13.
Takagi
Y
,
Kohmura
H
,
Futamura
M
, et al.
Somatic alterations of the DPC4 gene in human colorectal cancers in vivo . Gastroenterology.
1996; ; 111 : :1369.-1372. 14.
Papazoglu
C
,
Mills
AA
. p53 : at the crossroad between cancer and ageing . J Pathol.
2007; ; 211 : :124.-133. 15.
Baker
SJ
,
Markowitz
S
,
Fearon
ER
, et al.
Suppression of human colorectal carcinoma cell growth by wild-type p53 . Science.
1990; ; 249 : :912.-915. 16.
Hector
S
,
Prehn
JH
. Apoptosis signaling proteins as prognostic biomarkers in colorectal cancer : a review . Biochim Biophys Acta.
2009; ; 1795 : :117.-129. 17.
Gnagnarella
P
,
Gandini
S
,
La Vecchia
C
,
Maisonneuve
P
. Glycemic index, glycemic load, and cancer risk : a meta-analysis . Am J Clin Nutr.
2008; ; 87 : :1793.-1801. 18.
Key
TJ
,
Spencer
EA.
, Carbohydrates cancer : an overview of the epidemiological evidence. . Eur J Clin Nutr.
2007; ; 61 : (suppl 1)
:S112.-S121. 19.
Pais
R
,
Silaghi
H
,
Silaghi
AC
, et al.
Metabolic syndrome and risk of subsequent colorectal cancer . World J Gastroenterol.
2009; ; 15 : :5141.-5148. 20.
Yam
D
,
Fink
A
,
Mashiah
A
,
Ben-Hur
E
. Hyperinsulinemia in colon, stomach and breast cancer patients . Cancer Lett.
1996; ; 104 : :129.-132. 21.
Khaw
KT
,
Wareham
N
,
Bingham
S
, et al.
Preliminary communication : glycated hemoglobin, diabetes, and incident colorectal cancer in men and women : a prospective analysis from the European prospective investigation into cancer-Norfolk study . Cancer Epidemiol Biomarkers Prev.
2004; ; 13 : :915.-919. 22.
Giovannucci
E
. Insulin, insulin-like growth factors and colon cancer : a review of the evidence . J Nutr.
2001; ; 131 : :3109S.-3120S. 23.
Issad
T
. O-GlcNAc glycosylation and regulation of cell signaling . Med Sci (Paris).
2010; ; 26 : :753.-759. 24.
Yang
X
,
Ongusaha
PP
,
Miles
PD
, et al.
Phosphoinositide signalling links O-GlcNAc transferase to insulin resistance . Nature.
2008; ; 451 : :964.-969. 25.
Chou
TY
,
Hart
GW
,
Dang
CV
. c-Myc is glycosylated at threonine 58, a known phosphorylation site and a mutational hot spot in lymphomas . J Biol Chem.
1995; ; 270 : :18961.-18965. 26.
Yang
WH
,
Kim
JE
,
Nam
HW
, et al.
Modification of p53 with O-linked N-acetylglucosamine regulates p53 activity and stability . Nat Cell Biol.
2006; ; 8 : :1074.-1083. 27.
Dehennaut
V
,
Slomianny
MC
,
Page
A
, et al.
Identification of structural and functional O-linked N-acetylglucosamine-bearing proteins in Xenopus laevis oocyte . Mol Cell Proteomics.
2008; ; 7 : :2229.-2245. 28.
Dehennaut
V
,
Hanoulle
X
,
Bodart
JF
, et al.
Microinjection of recombinant O-GlcNAc transferase potentiates Xenopus oocytes M-phase entry . Biochem Biophys Res Commun.
2008; ; 369 : :539.-546. 29.
Lefebvre
T
,
Baert
F
,
Bodart
JF
, et al.
Modulation of O-GlcNAc glycosylation during Xenopus oocyte maturation . J Cell Biochem.
2004; ; 93 : :999.-1010. 30.
Hatsell
S
,
Medina
L
,
Merola
J
, et al.
Plakoglobin is O-glycosylated close to the N-terminal destruction box . J Biol Chem.
2003; ; 278 : :37745.-37752. 31.
Walther
A
,
Johnstone
E
,
Swanton
C
, et al.
Genetic prognostic and predictive markers in colorectal cancer . Nat Rev Cancer.
2009; ; 9 : :489.-499. 32.
Évaluation des risques et perspectives thérapeutiques en oncologie colorectale . Med Sci (Paris).
2009; ; 25 ((hs1)) : :1.-56. 33.
Bodmer
A
,
Goetsch
L
,
Favet
L
, et al.
Anticorps et tumeurs solides. Cibles établies et pistes prometteuse . Med Sci (Paris).
2009; ; 25 : :1090.-1098. |