| |
| Med Sci (Paris). 2011 May; 27(5): 493–500. Published online 2011 May 25. doi: 10.1051/medsci/2011275014.Les nouveaux anticoagulants oraux Utilisation actuelle et avenir Bénédicte Dumont,1 Dorothée Faille,1 and Nadine Ajzenberg1* 1Département d’hématologie et d’immunologie biologiques, Hôpital Bichat, APHP, 46, rue Henri Huchard, 75877Paris Cedex 18, France |
À la recherche de l’anticoagulant idéal L’héparine et les antivitamines K (AVK) ont longtemps été le traitement de choix dans la prévention et le traitement curatif des thromboses veineuses profondes (TVP). L’héparine non fractionnée (HNF) et les héparines de bas poids moléculaire (HBPM) sont des mélanges de chaînes polysaccharidiques plus ou moins longues extraites de muqueuse intestinale de porc. Les AVK bloquent le mécanisme de réduction de la vitamine K1,, un cofacteur de la synthèse hépatique de quatre protéines de la coagulation, les facteurs II, VII, IX et X, et de deux inhibiteurs de la coagulation, la protéine C et la protéine S (Figure 1). Les héparines et le fondaparinux sont administrés uniquement par voie parentérale, alors que les AVK le sont par voie orale. Le délai d’action des héparines est rapide. Celui des AVK étant plus long, ceux-ci ne sont que rarement utilisés en première intention. Une surveillance biologique attentive mais contraignante de ces traitements est requise2. De plus, la cible thérapeutique des AVK est particulièrement étroite et de nombreuses interférences médicamenteuses ou alimentaires rendent difficile l’équilibration du traitement.
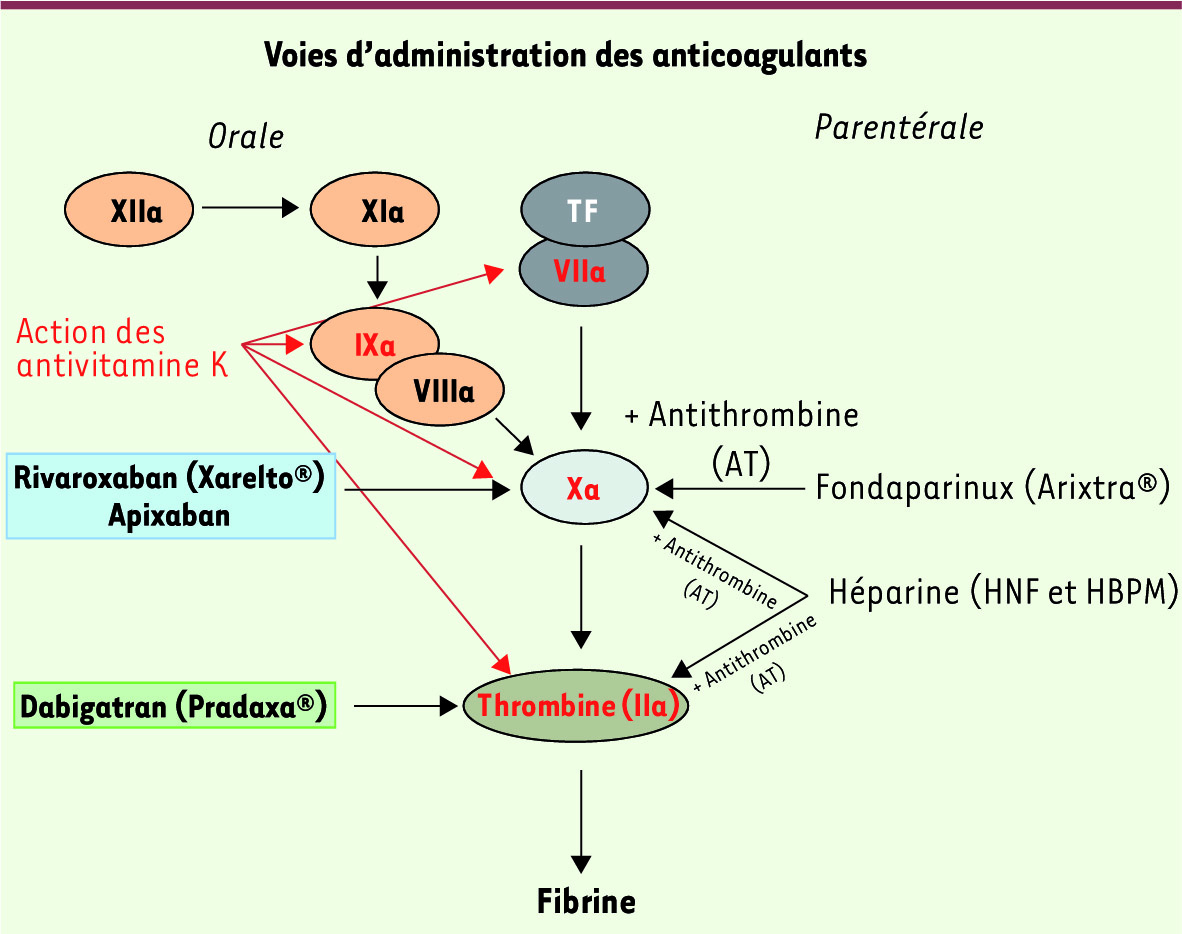
 | Figure 1.
Schéma simplifié de la cascade de la coagulation et mode d’action des nouveaux anticoagulants oraux rivaroxaban, apixaban et dabigatran. La nomenclature des facteurs de coagulation utilise des chiffres romains suivi de a pour activé. Le traitement par les médicaments antivitamine K bloque la γ-carboxylation des facteurs de coagulation synthétisés dans le foie (ici en caractères rouges), une étape de maturation des protéines essentielle à leur activité enzymatique. Les héparines ont une action anticoagulante indirecte, dépendante de l’antithrombine, et inhibent soit de façon comparable les facteurs Xa et IIa (HNF), soit de façon prédominante le facteur Xa (HBPM). Le fondaparinux a une activité dépendante de l’antithrombine et inhibe spécifiquement le facteur Xa. TF : facteur tissulaire. |
Le développement de nouveaux anticoagulants est donc nécessaire pour répondre à ces contraintes et difficultés. L’anticoagulant idéal devrait répondre aux critères suivants : administrable per os une fois par jour, en une dose unique pour tous les patients avec une bonne efficacité antithrombotique, un risque hémorragique faible, des profils pharmacocinétique et pharmacodynamique prévisibles, une absence de surveillance biologique, peu d’interactions médicamenteuses ou alimentaires et une fenêtre thérapeutique large. Plusieurs antithrombotiques administrables per os et pouvant répondre à ces critères sont en cours de développement. Ce sont principalement des inhibiteurs spécifiques ciblés sur un seul facteur de la coagulation, tels la thrombine ou le facteur X activé (a). Cette revue porte sur les trois molécules dont le développement est le plus avancé : le dabigatran étexilate (antithrombine), le rivaroxaban et l’apixaban (anti-Xa). |
Pharmacocinétique et pharmacodynamique Les principales caractéristiques des trois molécules sont présentées dans le
Tableau I
et sur la
Figure 1
.
Tableau I.
|
Dabigatran |
Rivaroxaban |
Apixaban |
| Facteur de coagulation ciblé Prodrogue |
IIa Dabigatran étexilate |
Xa Non |
Xa Non |
| Biodisponibilité (%) |
7,2 |
> 80 |
50 |
| Délai avant concentration maximale (h) |
2 |
2-4 |
3-4 |
| Demi-vie (h) |
12-17 |
7-11 |
12-15 |
| Liaison aux protéines plasmatiques (%) |
35 |
> 90 |
80 |
| Métabolisme |
Hépatique |
Hépatique 2/3 (nécessite CYP3A4 ; est un substrat de P-gp) |
Hépatique (nécessite CYP 3A4) |
| Élimination |
80 % rénale |
1/3 rénale (active) |
25 % rénale |
|
20 % biliaire |
1/3 rénale (métabolite inactif) 1/3 biliaire |
55 % fécale |
| Métabolites actifs |
~ 100 % |
~ 50 % |
~ 70 % |
| Interactions médicamenteuses |
Inhibiteurs et inducteurs de P-gp CI : prise de quinidine |
Inhibiteurs et inducteurs du CYP3A4 et de P-gp |
Inhibiteurs de CYP3A4 |
Caractéristiques pharmacologiques des antithrombotiques oraux. CI : contre-indication. |
Le dabigatran : un antithrombine Le dabigatran inhibe directement la thrombine (facteur IIa), de façon réversible et indépendamment de l’antithrombine (AT) [
1]. Son mécanisme d’action est ainsi différent de celui de l’héparine qui dépend de l’antithrombine. Il inactive de manière équivalente la thrombine liée à la fibrine et la thrombine libre. Le dabigatran a une mauvaise absorption intestinale. C’est pourquoi il est administré sous forme de dabigatran étexilate (Pradaxa ®, Boehringer Ingelheim), prodrogue sans activité pharmacologique, formulé dans des gélules contenant de l’acide tartrique qui lui confère un environnement acide et rend son absorption indépendante des variations du pH gastrique. Sa biodisponibilité est très faible (7 %) et sa demi-vie a une durée de 14 à 17 heures. Son métabolisme est hépatique mais indépendant du cytochrome P450. Le dabigatran étexilate est un substrat des protéines de transport transmembranaires de type P-glycoprotéines (P-gp) qui régulent sa concentration plasmatique [
2]. Ainsi des médicaments inhibiteurs ou activateurs de P-gp peuvent interférer avec la concentration plasmatique du dabigatran étexilate (Tableau I). L’élimination du dabigatran est principalement urinaire [
3]. Aussi le dabigatran est-il contre-indiqué en cas d’insuffisance rénale sévère (clairance de la créatinine inférieure à 30 ml/min). Il est également contre-indiqué en cas d’insuffisance hépatique sévère car les patients présentant de telles anomalies ont été exclus des études. Inhibiteurs oraux du facteur Xa Contrairement au fondaparinux (Arixtra ®), inhibiteur indirect du Xa, les inhibiteurs oraux sont de petites molécules synthétiques qui inactivent le facteur Xa libre et lié au complexe prothrombinase de façon équivalente et directe. En théorie, l’inhibition du Xa serait d’une efficacité antithrombotique plus importante que l’inhibition de la thrombine car le Xa est situé en amont de la thrombine dans la cascade de la coagulation et une molécule de Xa catalyse la formation de 1 000 molécules de thrombine. De plus, la thrombine a des propriétés anti-inflammatoires ( via son interaction avec la protéine C et la thrombomoduline) qui seraient bloquées par des anti-IIa mais pas par des anti-Xa. |
Le rivaroxaban (Xarelto®, Bayer Ortho-McNeill) est un inhibiteur sélectif direct du facteur Xa, compétitif et réversible, directement actif. Sa biodisponibilité est d’environ 80 % et sa concentration plasmatique maximale est atteinte en 2 à 4 heures. Son métabolisme hépatique nécessite le cytochrome CYP3A4 et des inhibiteurs ou des activateurs de CYP3A4 peuvent donc interférer avec sa transformation. Le rivaroxaban est également un substrat des P-gp et les inhibiteurs ou des activateurs de P-gp interfèrent avec son absorption, comme pour le dabigatran. L’alimentation retarde son absorption [
4] et permet également de réduire la variabilité interindividuelle. Ainsi, il est recommandé d’administrer le rivaroxaban au cours des repas ou dans les 2 heures qui suivent, mais seules les dernières études de phase III suivent cette recommandation. Sa demi-vie varie entre 7 et 11 heures. Son élimination est en grande partie rénale, sous forme inchangée (~ 33 %) et sous forme de métabolites inactifs (~ 33 %) et également biliaire (~ 33 %). Le rivaroxaban doit être utilisé avec prudence en cas d’insuffisance rénale sévère et n’est pas recommandé lorsque la clairance de la créatinine est inférieure à 15 ml/min. Il est contre-indiqué en cas d’insuffisance hépatique sévère car les patients présentant de telles anomalies ont été exclus des études de phase III. |
Le développement de l’apixaban (Pfizer et Bristol-Myers-Squibb) est moins avancé que celui du dabigatran et du rivaroxaban. C’est également un inhibiteur réversible et sélectif direct du Xa, directement actif. Sa biodisponibilité est de 50 %. Sa concentration plasmatique maximale est atteinte en 2 à 4 heures. Il n’y a pas d’interaction alimentaire rapportée ni de modification de son absorption avec l’alimentation. Son métabolisme hépatique nécessite le cytochrome CYP3A4. Des interférences médicamenteuses avec les inhibiteurs ou activateurs du CYP3A4 sont donc possibles, comme pour le rivaroxaban. La demi-vie de l’apixaban est de 10 à 14 heures. Son élimination est rénale (25 %), en plus grande partie fécale (55 %) [
5]. En raison de ses multiples voies d’élimination, l’apixaban peut être utilisé en cas d’insuffisance rénale ou hépatique. |
Le profil pharmacocinétique de ces médicaments est linéaire, dose-dépendant et prévisible, ce qui rend inutile une surveillance biologique de l’activité anticoagulante de façon systématique, contrairement au traitement par les AVK ou l’héparine non fractionnée. Cependant, dans certaines situations, comme en cas d’hémorragie, de chirurgie urgente ou d’insuffisance rénale, une évaluation de l’activité anticoagulante pourrait être utile afin de dépister un surdosage. Le dabigatran, le rivaroxaban et l’apixaban allongent le temps de céphaline activée (TCA) et le temps de quick (TQ) mais de façon indépendante de la dose. Ces tests ne peuvent donc pas être utilisés dans la surveillance biologique de ces médicaments. Un test direct qui évalue l’activité anti-Xa du rivaroxaban et de l’apixaban est en cours d’étude et doit être validé en pratique clinique. Un TQ modifié exprimé en concentration de rivaroxaban plutôt qu’en secondes ou en INR (international normalized ratio, voir Glossaire) semble utilisable [
6]. Le temps d'écarine et le temps de thrombine modifié; sont des tests globaux qui permettraient d'évaluer la concentration plasmatique du dabigatran plus efficacement que le TCA (voir Glossaire) [
7]. Il est important de rappeler que ces molécules ne nécessitent aucune surveillance de la numération plaquettaire (voir note 2). |
Le dabigatran étexilate et le rivaroxaban ont obtenu respectivement en mars et septembre 2008 l’autorisation européenne de mise sur le marché dans la prévention des événements thromboemboliques veineux (ETEV) chez les adultes bénéficiant d’une intervention chirurgicale programmée pour prothèse totale de hanche (PTH) ou de genou (PTG). Le dabigatran étexilate est également autorisé par la Food and drug administration (FDA) nord-américaine. Seules les études de phase III les plus avancées seront présentées ici. Deux schémas thérapeutiques de référence sont utilisés dans ces études : l’énoxaparine (HBPM de référence) 30 mg × 2/j, débutée 12 à 24 heures après la chirurgie dans les études nord-américaines, ou l’énoxaparine 40 mg/j, débutée la veille de l’intervention dans les études européennes. Prévention des ETEV après chirurgie orthopédique pour PTH et PTG |
Dabigatran étexilate (Pradaxa ®) Trois études internationales de non-infériorité de phase III, randomisées et en double aveugle, ont comparé le dabigatran (150 ou 220 mg/j), débuté à demi-dose 1 à 4 heures après la chirurgie, soit à l’énoxaparine (40 mg/j) débutée la veille de l’intervention (études RE-MODEL [PTG] [
8] et RE-NOVATE [PTH] [
9]), soit à l’énoxaparine (30 mg × 2/j) débutée 12 à 24 heures après la chirurgie (étude RE-MOBILIZE [PTG] [
10]) (Tableaux II et III). La réduction de la première dose administrée est justifiée par une accumulation du médicament par modification de la vidange gastrique et du pH en période postopératoire immédiate [
11].
Tableau II.
|
Dabigatran |
Rivaroxaban |
Apixaban |
| Acronyme |
REMODEL |
RECORD 3 |
ADVANCE 2 |
| Posologie journalière |
220 mg × 1 |
150 mg × 1 |
10 mg × 1 |
2,5 mg × 2 |
| Durée |
6 à 10 j |
10 à 14 j |
10 à 14 j |
| Nombre de patients randomisés |
|
2 101 |
2 531 |
1 973 |
| Durée du suivi |
3 mois |
30 à 35 j |
30 à 60 j |
| ETEV totaux (%)* |
36,4 versus 37,7 |
40,5 versus 37,7 |
9,6 versus 18,9 |
15,1 versus 24,4 |
| ETEV majeurs (%) |
2,6 versus 3,5 |
3,8 versus 3,5 |
1 versus 2,6* |
1,1 versus 2,2 |
| Saignements majeurs (%) |
1,5 versus 1,3 |
1,3 versus 1,3 |
0,6 versus 0,5 |
0,6 versus 0,9 |
Études de phase III chez les patients bénéficiant d’une PTG (schéma thérapeutique européen) des nouveaux anticoagulants par comparaison à l’énoxaparine 40 mg/j débutée la veille de l’intervention. * « médicament étudié » versus « énoxaparine », *p < 0,05. ETEV (événements thromboemboliques veineux) totaux : EP (embolie pulmonaire), TVP (thromboses veineuses profondes) proximales et distales, symptomatiques ou asymptomatiques, détectées par phlébographie et mortalité toutes causes confondues pendant le traitement. ETEV majeurs : EP, TVP proximales, symptomatiques ou asymptomatiques, détectées par phlébographie, décès lié à un ETEV pendant le traitement. Saignements majeurs : chute de l’hémoglobine > 2g/l ; transfusion > 2CG (culots globulaires), saignements rétropéritonéal, intracrânien, intraoculaire ou intraspinal ou reprise chirurgicale pour hémorragie. |
Tableau III.
| Principe actif |
Dabigatran |
Rivaroxaban |
| Acronyme |
RENOVATE |
RECORD 1 |
RECORD 2 |
| Posologie journalière |
220 mg × 1 |
150 mg × 1 |
10 mg × 1 |
10 mg × 1 |
| Durée anticoagulant oral |
28 à 35 j |
31 à 39 j |
31 à 39 j |
| Durée énoxaparine |
28 à 35 j |
31 à 39 j |
10 à 14 j |
| Nombre de patients randomisés |
3 494 |
4 541 |
2 509 |
| Durée du suivi |
3 mois |
30 à 35 j |
30 à 35 j |
| ETEV totaux (%) |
6 versus 6,7 |
6 versus 6,7 |
1,1 versus 3,7* |
2 versus 9,3* |
| ETEV majeurs (%) |
3,1 versus 3,9 |
3,1 versus 3,9 |
0,2 versus 2* |
0,6 versus 5,1* |
| Saignements majeurs (%) |
2 versus 1,6 |
2 versus 1,6 |
0,3 versus 0,1* |
< 0,1 versus < 0,1 |
Études de phase III chez les patients bénéficiant d’une PTH (schéma européen) en comparaison à l’énoxaparine 40 mg/j débutée la veille de l’intervention. « Médicament étudié » versus « énoxaparine », *p < 0,05. ETEV totaux, ETEV majeurs et saignements majeurs : voir légende du Tableau II. |
Dans les études européennes, le dabigatran est aussi efficace que l’énoxaparine sur les ETEV totaux (thromboses veineuses profondes phlébographiques et symptomatiques, embolies pulmonaires) et les décès de toute cause survenus pendant le traitement (28 à 35 jours pour la PTH, 10 jours pour la PTG) (Tableaux II et III) alors qu’il est moins efficace dans l’étude américaine avec un pourcentage d’ETEV totaux de 31,1 % avec le dabigatran 220 mg/j versus 25,3 % avec l’énoxaparine (différence de risque = 5,8 % ; intervalle de confiance [IC] 95 % [0,8 ; 10,8 %] p = 0,02) [10]. Dans les trois études, le taux de saignements majeurs ne diffère pas entre les groupes et selon le schéma thérapeutique de l’énoxaparine. La méta-analyse des trois études [
12] permet d’identifier des sous-groupes de patients à risque hémorragique ayant une insuffisance rénale modérée (clairance de la créatinine entre 30 et 50 ml/min) ou âgés de plus de 75 ans. Ils représentent respectivement 7 % et 16 % de la population totale étudiée. Le risque de saignement majeur dépendant de la dose, une dose de 150 mg/j est recommandée chez ces patients. Une attention particulière a été portée à l’augmentation des transaminases sous dabigatran (en référence à un autre médicament ayant une action antithrombine, le ximelagatran, qui avait été retiré du marché en 2006 en raison de son hépatotoxicité). Cette augmentation est faible (2,2 à 2,6 %) et comparable à celle qui survient sous énoxaparine [12]. |
Les études RECORD ont permis d’inclure plus de 12 700 patients. Ces études montrent la supériorité du rivaroxaban sur l’énoxaparine pour réduire le risque d’ETEV après PTH (RECORD 1 et 2) [
13,
14] ou PTG (RECORD 3 et 4) [
15,
16]. La prise du rivaroxaban commence toujours 6 à 8 heures après la fin de l’intervention à la dose unique de 10 mg/j, et l’énoxaparine 12 heures avant l’intervention selon le schéma européen (40 mg/j) (RECORD 1, 2 et 3) (Tableaux II et III) ou 12 à 24 heures après la fin de l’intervention (30 mg × 2/j) selon le schéma américain (RECORD 4) [16]. Le rivaroxaban est plus efficace que l’énoxaparine sur les ETEV totaux dans toutes les études (Tableaux II et III) et même sur les ETEV symptomatiques dans l’étude RECORD 3 dans laquelle le traitement anticoagulant est prolongé pendant 13 à 17 jours après PTG dans les deux bras. En ce qui concerne le risque hémorragique majeur (défini comme pour le dabigatran), les résultats des quatre études ne montrent pas de différence significative entre le rivaroxaban et l’énoxaparine. En revanche, les saignements majeurs associés à un retentissement clinique sont plus importants avec le rivaroxaban qu’avec l’énoxaparine (3,19 % versus 2,55 %, p = 0,039) lorsque les quatre études sont analysées ensemble [
17]. Cependant, d’après les auteurs, le manque de puissance des études rend incertaine l’interprétation de ces résultats. L’augmentation des transaminases était similaire dans les deux groupes. La FDA a remis en cause cette méta-analyse conduite par la firme pharmaceutique Bayer Healthcare et Johnson & Johnson et a réalisé sa propre méta-analyse en utilisant des méthodes statistiques différentes. Le rivaroxaban réduit alors l’incidence totale des ETEV mais n’est pas supérieur à l’énoxaparine dans la prévention des ETEV symptomatiques et des décès. Cette étude montre une augmentation significative du risque hémorragique avec le rivaroxaban (saignements majeurs avec le rivaroxaban en comparaison à l’énoxaparine (hasard ratio = 3, IC 95 % [1,4 % ; 6,2 %], p = 0,0037). Ces résultats ont conduit la FDA à refuser la mise sur le marché américain du rivaroxaban3. |
L’apixaban n’a pas d’autorisation de mise sur le marché (AMM). L’étude européenne de phase III ADVANCE-2 [
18], randomisée multicentrique en double aveugle, a comparé l’efficacité de l’apixaban 2,5 mg × 2/j (débuté 12 à 24 heures après l’intervention) à celle de l’énoxaparine 40 mg/j (débuté 12 heures avant l’intervention) sur l’incidence des ETEV après PTG chez 1 973 patients pendant 10 à 14 jours (Tableau III). Une diminution significative des ETEV a été observée dans le groupe apixaban comparé au groupe énoxaparine (15,1 % versus 24,4 %) (réduction du risque relatif = 9,3 %, IC 95 % [12,7 % ; 5,8 %], p < 0,001). Une tendance non significative à une diminution des saignements cliniquement importants mais non majeurs (hématome postchirurgical, gingivorragies, épistaxis, hématurie, saignements digestifs) a été obtenue dans le groupe apixaban versus énoxaparine (3,5 % versus 4,8 %, p = 0,09). Une autre étude de phase III est actuellement en cours, ADVANCE-3 dans la PTH. Elle évalue l’efficacité de l’apixaban en comparaison de celle de l’énoxaparine selon le même protocole qu’ADVANCE-2. Les résultats sont attendus4. |
Autres indications sans AMM Fibrillation auriculaire (FA) La FA est associée à un risque élevé d’événements thromboemboliques, notamment d’accidents vasculaires cérébraux (AVC). C’est le plus souvent une indication au traitement anticoagulant au long cours. |
L’étude RE-LY, réalisée chez 18 113 patients présentant une FA, a comparé le dabigatran (110 mg ou 150 mg × 2/j) à un AVK, la warfarine (valeur cible d’INR entre 2 et 3), dans la prévention des AVC [
19,
20]. Un traitement par aspirine était associé chez 20 % des patients inclus. Le critère principal de cette étude de non-infériorité était la survenue d’AVC et/ou d’embolie systémique pendant un suivi médian de deux ans. Cette étude a montré une meilleure efficacité du dabigatran (150 mg × 2/j) par rapport à la warfarine (1,11 % d’évènements versus 1,69 %, risque relatif [RR] = 0,66 ; IC 95 % [0,63 % ; 0,82 %], p < 0,0001) avec un risque hémorragique identique dans les deux groupes. Seuls les saignements gastro-intestinaux majeurs étaient augmentés chez les patients traités par dabigatran. En revanche, le dabigatran à la dose de 110 mg × 2/j a une efficacité identique à celle de la warfarine (1,53 % versus 1,69 %) et un risque hémorragique moindre (2,71 % versus 3,36 %, RR = 0,80, IC 95 % [0,69 % ; 0,93 %], p = 0,003). Une dyspepsie a été rapportée chez 12 % des patients sous dabigatran et chez seulement 5,8 % des patients sous warfarine. Il n’a pas été rapporté de toxicité hépatique dans cette étude. |
Les études sont en cours selon les schémas thérapeutiques suivants :
-
comparables à celui utilisé avec le dabigatran dans l’étude RE-LY :
-
étude ROCKET-AF [
21] : rivaroxaban 20 mg/j ou 15 mg/j si insuffisance rénale modérée ; 14 000 patients prévus.
-
étude ARISTOLE [
22] : apixaban (5 mg × 2/j) ; 18 000 patients prévus.
-
en utilisant l’aspirine (81 à 324 mg/j) comme comparateur :
-
étude AVERROES [
23] : apixaban (5 mg × 2/j) ; 5 000 à 6 000 patients prévus.
Les résultats sont attendus pour 2011. |
Traitement curatif des thromboses veineuses profondes (TVP) et prévention secondaire des TVP |
L’étude RECOVER a montré la non-infériorité du dabigatran (150 mg × 2/j) comparé à la warfarine (INR cible entre 2 et 3) chez 2 564 patients présentant une TVP et tous traités initialement par héparine pendant 10 jours [
24]. Les taux de récidive de TVP symptomatiques avec le dabigatran et la warfarine étaient comparables (2,4 % versus 2,1 %). Les saignements majeurs sont survenus chez 1,6 % des patients sous dabigatran, et 1,9 % des patients sous warfarine. Aucun effet secondaire n’a été observé spécifiquement avec le dabigatran. D’autres études évalueront le dabigatran 150 mg × 2/j en prévention secondaire des TVP après 6 à 18 mois de traitement initial par AVK en comparaison à un placebo (n = 1 500)5, ou à la warfarine (n = 2 700)6. |
Toutes les études de phase III sont actuellement en cours et évaluent l’efficacité, à la phase aiguë d’une TVP (Einstein TVP, 3 400 patients)7, ou d’une embolie pulmonaire (EP) symptomatique avec ou sans TVP (Einstein EP, 4 000 patients)8, du rivaroxaban à la dose de 15mg × 2/j pendant 3 semaines, puis 20 mg × 1/j pendant 3, 6 ou 12 mois par rapport à un traitement anticoagulant habituel. Le critère principal d’efficacité de ces deux études est la récidive d’un ETEV symptomatique à 3, 6 et 12 mois. Les premiers résultats de l’étude de la prévention à long terme des ETEV (Einstein extension, 1 197 patients) [
25] indiquent une diminution de 82 % du risque relatif de récidive d’un ETEV avec le rivaroxaban 20 mg/j versus placebo. L’étude AMPLIFY compare l’apixaban (10 mg × 2/j pendant 7 jours puis 5 mg × 2/j pendant 6 mois) au même schéma thérapeutique classique9. |
Prévention secondaire des syndromes coronaires aigus (SCA) |
Aucune étude de phase III n’est actuellement en cours. |
Les essais de phase III actuellement en cours comparent d’une part deux doses de rivaroxaban (2,5 mg × 2/j et 5 mg × 2/j) (ATLAS SCA TIMI 51)10,, et d’autre part l’apixaban (5 mg × 2/j) à un placebo (APPRAISE-2)11, en plus du traitement antiplaquettaire usuel. Le critère principal d’efficacité est le risque de récidive, de décès, d’AVC ou de revascularisation dans les 6 mois suivant un premier SCA. Les résultats de ces études sont attendus pour 2012. |
Conclusions et perspectives Le dabigatran et le rivaroxaban représentent des alternatives thérapeutiques très intéressantes aux HBPM dans la prévention thromboembolique après PTH et PTG. Il existe plusieurs avantages à l’utilisation de ces nouveaux anticoagulants, parfois contrebalancés par certains inconvénients : la demi-vie courte de ces anticoagulants a l’avantage de diminuer le risque d’accidents hémorragiques; cependant, le risque hémorragique des nouveaux anticoagulants oraux reste un problème délicat puisque : (1) aucun antidote n’existe à ce jour, (2) la relation entre concentration thérapeutique de l’anticoagulant et risque hémorragique n’est pas définie. Une bonne observance est nécessaire car l’oubli de 2 ou 3 prises conduit à une inefficacité complète du médicament. Le problème d’observance rencontré avec les AVK ne sera pas résolu par ces nouveaux anticoagulants comme le montre l’étude RELY dans laquelle respectivement 7,3 %, 7,8 % et 6,2 % des patients traités par dabigatran 110 ou 150 mg/j ou warfarine ont arrêté leur traitement sans raison particulière [20]. L’arrivée de ces nouveaux anticoagulants va révolutionner la prise en charge thérapeutique curative et préventive des TVP et des embolies systémiques au cours de la fibrillation auriculaire, la preuve de leur efficacité en prévention primaire étant faite. Le principal avantage est le profil pharmacocinétique prévisible qui permet de les administrer en une ou deux prises par jour sans surveillance biologique. D’autres anti-Xa avec des caractéristiques pharmacocinétiques différentes sont en cours de développement avec soit une demi-vie un peu plus longue, soit un effet plus rapide. La spécificité de ces nouveaux médicaments permettra de choisir la molécule la mieux adaptée à chaque patient. ‡ Conflit d’intérêts Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article. |
Glossaire
|
Temps de céphaline avec activateur (TCA)
|
Il correspond à la mesure du temps de coagulation d’un plasma recalcifié en présence de phospholipides (substitut lipidique des plaquettes) et d’un activateur de la phase contact (facteurs XII et XI, kininogène de haut poids moléculaire, prékallicréine), du complexe anti-hémophilique (facteur IX, facteur VIII), du complexe de la prothrombinase (facteur X, facteur V), la prothrombine (facteur II) et le fibrinogène (Figure 1). C’est un test simple, rapide et facilement automatisable. Il est exprimé en secondes et sous forme d’un rapport à un temps témoin. |
|
Activité anti-Xa
|
Mesure colorimétrique qui détermine la concentration d’héparine présente dans le plasma. |
|
Temps de thrombine
|
Il mesure le temps de formation du caillot en présence de thrombine. Il est allongé en cas de présence d’inhibiteur de la thrombine. |
|
Temps d’écarine
|
Test de coagulation réalisé sur plasma, qui utilise comme réactif l’écarine, protéase purifiée à partir de venin de vipère. L’écarine active la prothrombine en une forme intermédiaire de thrombine, la meizothrombine d’activité coagulante modérée. Les inhibiteurs directs de la thrombine inhibent l’activité de la meizothrombine et allongent donc ce temps de coagulation. Ce test n’est pas sensible à l’action des antivitamines K ni des héparines. |
|
Temps de Quick (ou taux de prothrombine)
|
Il consiste à mesurer le temps de coagulation après addition, à un plasma citrate, d’un excès de thromboplastine calcique contenant du facteur tissulaire, des phospholipides et du calcium. Le résultat est exprimé en pourcentage. Le test est improprement dénommé alors taux de prothrombine (ou TP qui ne reflète pas seulement les variations de la prothrombine). Le temps de Quick explore les facteurs VII, X, V et le fibrinogène. Lors d’un traitement par AVK, les résultats sont exprimés en INR = (temps de Quick du malade/temps de Quick du témoin)ISI.ISI = index de sensibilité internationale défini par le fabricant du réactif. La surveillance de l’INR permet de comparer les résultats entre différents laboratoires qui utilisent des automates et des réactifs différents. Une zone thérapeutique est définie selon chaque indication et varie entre 2 et 4,5. |
|
Footnotes |
1.
Wienen
W
,
Stassen
JM
,
Priepke
H
, et al.
In vitro profile and ex vivo anticoagulant activity of the direct thrombin inhibitor dabigatran and its orally active prodrug, dabigatran etexilate . Thromb Haemost.
2007; ; 98 : :155.-162. 2.
DuBuske
LM
. The role of P-glycoprotein and organic anion-transporting polypeptides in drug interactions . Drug Saf.
2005; ; 28 : :789.-801. 3.
Stangier
J
. Clinical pharmacokinetics and pharmacodynamics of the oral direct thrombin inhibitor dabigatran etexilate . Clin Pharmacokinet.
2008; ; 47 : :285.-295. 4.
Kubitza
D
,
Becka
M
,
Zuehlsdorf
M
,
Mueck
W
. Effect of food, an antacid, and the H2 antagonist ranitidine on the absorption of BAY 59–7939 (rivaroxaban), an oral, direct factor Xa inhibitor, in healthy subjects . J Clin Pharmacol.
2006; ; 46 : :549.-558. 5.
Carreiro
J
,
Ansell
J
. Apixaban, an oral direct Factor Xa inhibitor: awaiting the verdict . Expert Opin Investig Drugs.
2008; ; 17 : :1937.-1945. 6.
Samama
MM
,
Martinoli
JL
,
LeFlem
L
, et al.
Assessment of laboratory assays to measure rivaroxaban: an oral, direct factor Xa inhibitor . Thromb Haemost.
2011; ; 103 : :815.-825. 7.
Liesenfeld
KH
,
Schäfer
HG
,
Trocóniz
IF
, et al.
Effects of the direct thrombin inhibitor dabigatran on ex vivo coagulation time in orthopaedic surgery patients: a population model analysis . Br J Clin Pharmacol.
2006; ; 62 : :527.-537. 8.
Eriksson
BI
,
Dahl
OE
,
Rosencher
N
, et al.
Oral dabigatran etexilate vs. subcutaneous enoxaparin for the prevention of venous thromboembolism after total knee replacement: the RE-MODEL randomized trial . J Thromb Haemost.
2007; ; 5 : :2178.-2185. 9.
Eriksson
BI
,
Dahl
OE
,
Rosencher
N
, et al.
Dabigatran etexilate versus enoxaparin for prevention of venous thromboembolism after total hip replacement: a randomised, double-blind, non-inferiority trial . Lancet.
2007; ; 370 : :949.-956. 10.
RE-MOBILIZE Writing Committee. ,
Ginsberg
JS
,
Davidson
BL
, et al.
Oral thrombin inhibitor dabigatran etexilate vs North American enoxaparin regimen for prevention of venous thromboembolism after knee arthroplasty surgery . J Arthroplasty.
2009; ; 24 : :1.-9. 11.
Trocóniz
IF
,
Tillmann
C
,
Liesenfeld
KH
, et al.
Population pharmacokinetic analysis of the new oral thrombin inhibitor dabigatran etexilate (BIBR 1048) in patients undergoing primary elective total hip replacement surgery . J Clin Pharmacol.
2007; ; 47 : :371.-382. 12.
Friedman
RJ
,
Dahl
OE
,
Rosencher
N
, et al.
Dabigatran versus enoxaparin for prevention of venous thromboembolism after hip or knee arthroplasty: a pooled analysis of three trials . Thromb Res.
2010; ; 126 : :175.-182. 13.
Eriksson
BI
,
Borris
LC
,
Friedman
RJ
, et al.
Rivaroxaban versus enoxaparin for thromboprophylaxis after hip arthroplasty . N Engl J Med.
2008; ; 358 : :2765.-2775. 14.
Kakkar
AK
,
Brenner
B
,
Dahl
OE
, et al. Extended duration rivaroxaban versus short-term enoxaparin for the prevention of venous thromboembolism after total hip arthroplasty: a double-blind, randomised controlled trial . Lancet.
2008; ; 372 : :31.-39. 15.
Lassen
MR
,
Ageno
W
,
Borris
LC
, et al.
Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty . N Engl J Med.
2008; ; 358 : :2776.-2786. 16.
Turpie
AG
,
Lassen
MR
,
Davidson
BL
, et al.
Rivaroxaban versus enoxaparin for thromboprophylaxis after total knee arthroplasty (RECORD4): a randomised trial . Lancet.
2009; ; 373 : :1673.-1680. 17.
Van Thiel
D
,
Kalodiki
E
,
Wahi
R
, et al.
Interpretation of benefit-risk of enoxaparin as comparator in the RECORD program: rivaroxaban oral tablets (10 milligrams) for use in prophylaxis in deep vein thrombosis and pulmonary embolism in patients undergoing hip or knee replacement surgery . Clin Appl Thromb Hemost.
2009; ; 15 : :389.-394. 18.
Lassen
MR
,
Raskob
GE
,
Gallus
A
, et al.
Apixaban versus enoxaparin for thromboprophylaxis after knee replacement (ADVANCE-2): a randomised double-blind trial . Lancet.
2010; ; 375 : :807.-815. 19.
Ezekowitz
MD
,
Connolly
S
,
Parekh
A
, et al.
Rationale and design of RE-LY: randomized evaluation of long-term anticoagulant therapy, warfarin, compared with dabigatran . Am Heart J.
2009; ; 157 : 805-10-810.
:e1-2.. 20.
Connolly
SJ
,
Ezekowitz
MD
,
Yusuf
S
, et al.
Dabigatran versus warfarin in patients with atrial fibrillation . N Engl J Med.
2009; ; 361 : :1139.-1151. 21.
Rocket
AF
. Study Investigators. Rivaroxaban-once daily, oral, direct factor Xa inhibition compared with vitamin K antagonism for prevention of stroke and embolism trial in atrial fibrillation: rationale and design of the ROCKET AF study . Am Heart J.
2010; ; 159 : :340.-347. 22.
Lopes
RD
,
Alexander
JH
,
Al-Khatib
SM
, et al.
Apixaban for reduction in stroke and other ThromboemboLic events in atrial fibrillation (ARISTOTLE) trial: design and rationale . Am Heart J.
2010; ; 159 : :331.-339. 23.
Eikelboom
JW
,
O’Donnell
M
,
Yusuf
S
, et al.
Rationale and design of AVERROES: apixaban versus acetylsalicylic acid to prevent stroke in atrial fibrillation patients who have failed or are unsuitable for vitamin K antagonist treatment . Am Heart J.
2010; ; 159 : :348.-353. 24.
Schulman
S
,
Kearon
C
,
Kakkar
AK
, et al.
Dabigatran versus warfarin in the treatment of acute venous thromboembolism . N Engl J Med.
2009; ; 361 : :2342.-2352. 25.
Buller
HR
. Once-daily oral rivaroxaban versus placebo in the long-term prevention of recurrent symptomatic venous thromboembolism. The Einstein-extension study . ASH Annual Meeting Abstracts.
2009; ; 114 : :LBA-2.. |