| |
| Med Sci (Paris). 2011 May; 27(5): 467–470. Published online 2011 May 25. doi: 10.1051/medsci/2011275007.Le xeroderma pigmentosum
Un modèle d’analyse du lien entre accumulation de mutations génomiques et effet Warburg durant la transformation tumorale Hamid Reza Rezvani1,2* and Alain Taïeb2,3,4 1Inserm U1035, Bordeaux, F-33000, France 2Université Bordeaux Segalen, Bordeaux, F-33000, France 3Inserm U305, 33000Bordeaux, France 4CHU de Bordeaux, Département de dermatologie et dermatologie pédiatrique, Centre de référence des maladies rares de la peau, Hôpital Saint-André, Bordeaux, F-33000, France MeSH keywords: Apoptose, Vieillissement de la cellule, Transformation cellulaire néoplasique, génétique, métabolisme, Cycle de l'acide citrique, Altération de l'ADN, Réparation de l'ADN, ADN mitochondrial, effets des médicaments et des substances chimiques, Protéines de liaison à l'ADN, déficit, physiologie, Métabolisme énergétique, Glycolyse, Humains, Kératinocytes, anatomopathologie, Modèles biologiques, Tumeurs, Phosphorylation oxydative, Espèces réactives de l'oxygène, toxicité, Xeroderma pigmentosum |
Otto Warburg (1883-1970), prix Nobel de médecine en 1931, constata un excès de production de lactates dans les cellules cancéreuses. Il émit en 1924, à partir de ces observations, l’hypothèse qu’un élément fondamental du cancer était d’ordre métabolique : les cellules cancéreuses tireraient principalement leur énergie de la fermentation anaérobie du glucose (glycolyse anaérobie) au lieu de produire l’ATP à partir de l’oxydation phosphorylante mitochondriale [
1]. Le développement, à partir des années 1950, de la biologie moléculaire et la découverte d’oncogènes et de gènes suppresseurs de tumeurs ont rejeté dans l’oubli l’hypothèse de Warburg. Or, on assiste ces dernières années à une réévaluation du rôle de l’effet Warburg en oncologie. Le concept d’hyperconsommation de glucose par les cellules tumorales a été exploité progressivement pour devenir un outil diagnostique majeur avec le développement clinique de la technique de tomographie par émission de positions (TEP-scan) [
2]. La découverte de mutations dans des gènes codant pour les enzymes mitochondriaux (par exemple la succinate déhydrogénase) à l’origine de certains cancers héréditaires (Tableau I) souligne le rôle du métabolisme bioénergétique dans la progression tumorale [
3]. Les études récentes montrent que beaucoup de lignées cancéreuses se caractérisent par une augmentation de la glycolyse, du transport du glucose et de l’activité de la voie des pentoses phosphates, ainsi que par une diminution des mitochondries, de la quantité et de l’activité des protéines de la phosphorylation oxydative par rapport aux cellules normales [2, 3]. Ces altérations du métabolisme énergétique dans les cellules cancéreuses pourraient être liées à plusieurs causes : mutations de l’ADN mitochondrial ; augmentation du stress oxydant résultant de la production excessive d’espèces réactives de l’oxygène (ERO) [
14] ; adaptation des tissus à l’hypoxie [2, 3] et/ou activation d’oncogènes ou inactivation de gènes suppresseurs de tumeurs dont TP53, HIF-1a (Hypoxia-inducible factor-1a), c-MYC et PI3K/AKT [
4].
Tableau I.
| Gène |
Fonction majeure |
Type de tumeur |
N° OMIM/ transmission |
| Succinate déhydrogénase B (SDHB) |
Cycle de Krebs, chaîne respiratoire |
Paragangliomes1 et phéochromocytomes2 familiaux, autres tumeurs |
115310/autosomique dominant |
| Succinate déhydrogénase C (SDHC) |
Cycle de Krebs, chaîne respiratoire |
Paragangliomes et phéochromocytomes familiaux |
605373/autosomique dominant |
| Succinate déhydrogénase D (SDHD) |
Cycle de Krebs, chaîne respiratoire |
Paragangliomes et phéochromocytomes familiaux, syndrome de Cowden-like3, autres tumeurs |
602690/autosomique dominant |
| Fumarate hydratase (FH) |
Cycle de Krebs |
Léiomyomes4 cutanés multiples, léiomyomes utérins, léiomyosarcome, carcinome papillaire rénal |
605839 (léiomyomatose héréditaire avec carcinome rénal, HLRCC)/autosomique dominant |
Cancers héréditaires par mutations des enzymes mitochondriaux.
|
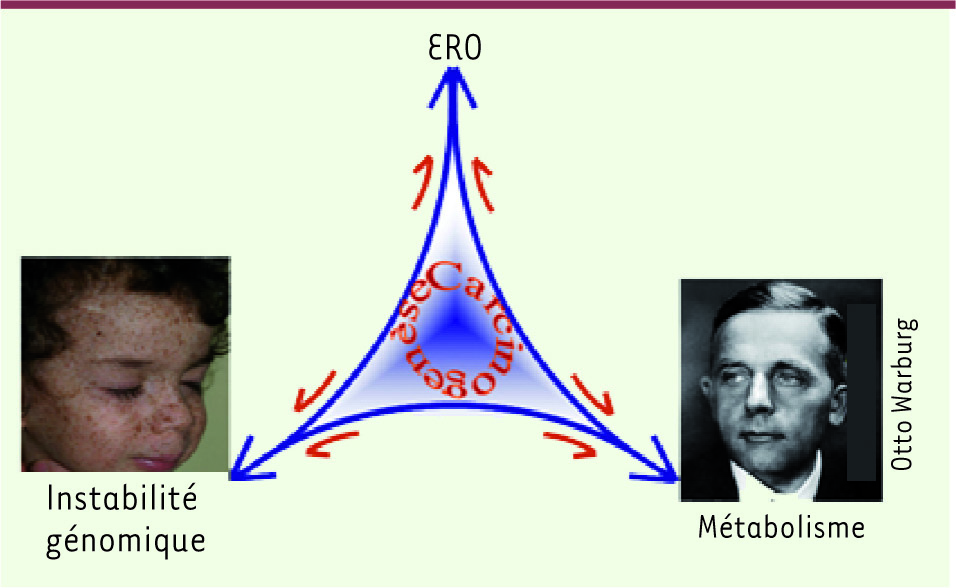
Cependant, la relation entre les mutations génomiques, l’effet Warburg et l’augmentation du niveau des ERO durant la transformation tumorale reste à clarifier (Figure 1). De plus, il n’y a pas de mécanisme(s) formellement établi(s) reliant l’accumulation des mutations génomiques et les modifications bioénergétiques cellulaires.
 | Figure 1.
Le tripode de la carcinogenèse. ERO : espèces réactives de l’oxygène. |
|
Le xeroderma pigmentosum (XP) : un modèle pour l’étude de la carcinogenèse Afin de comprendre les liens entre accumulation de mutations, modifications métaboliques et augmentation des ERO, nous avons émis l’hypothèse que les cellules exprimant une prédisposition à la transformation maligne, ou celles qui ont une capacité à accumuler des mutations, pourraient permettre d’élucider cette relation. Les cellules déficientes en protéine xeroderma pigmentosum C (XPC) représentent un outil de choix puisqu’elles sont déficientes dans le système de réparation de l’ADN par excision de nucléotides (NER), ce qui les rend plus susceptibles à la transformation néoplasique. Le système NER est déficient dans trois maladies : le XP, le syndrome de Cockayne et la trichothiodystrophie [
15], qui sont génétiquement hétérogènes [
5]. Le rôle du système NER dans la cancérogenèse est évident chez les patients XP qui présentent une extrême sensibilité aux rayonnements UV et développent des carcinomes et des mélanomes cutanés, le risque étant multiplié par 1 000 avant l’âge de 10 ans. De plus, un risque de 10 à 20 fois plus élevé de développer des cancers internes avant 20 ans a été décrit [
6]. Les patients XP sont classés en 8 groupes : XPA à XPG et un groupe XPV. Dans les cellules des patients XPC, la réparation couplée à la transcription (TCR) est efficace et la réparation globale du génome (GGR) est déficiente. Ces cellules accumulent donc des mutations dans les parties non transcrites du génome conduisant à une transformation néoplasique [5]. Les souris XPC
−/−
ont aussi cette prédisposition à développer des cancers spontanés et induits par les UV [
7]. De manière intéressante, les mutations les plus fréquemment observées chez les souris âgées sont des mutations G/T qui résultent d’un processus d’oxydation [
8], suggérant le rôle délétère des ERO. |
L’accumulation des lésions de l’ADN entraîne une production d’ERO et des changements métaboliques Notre approche [
9,
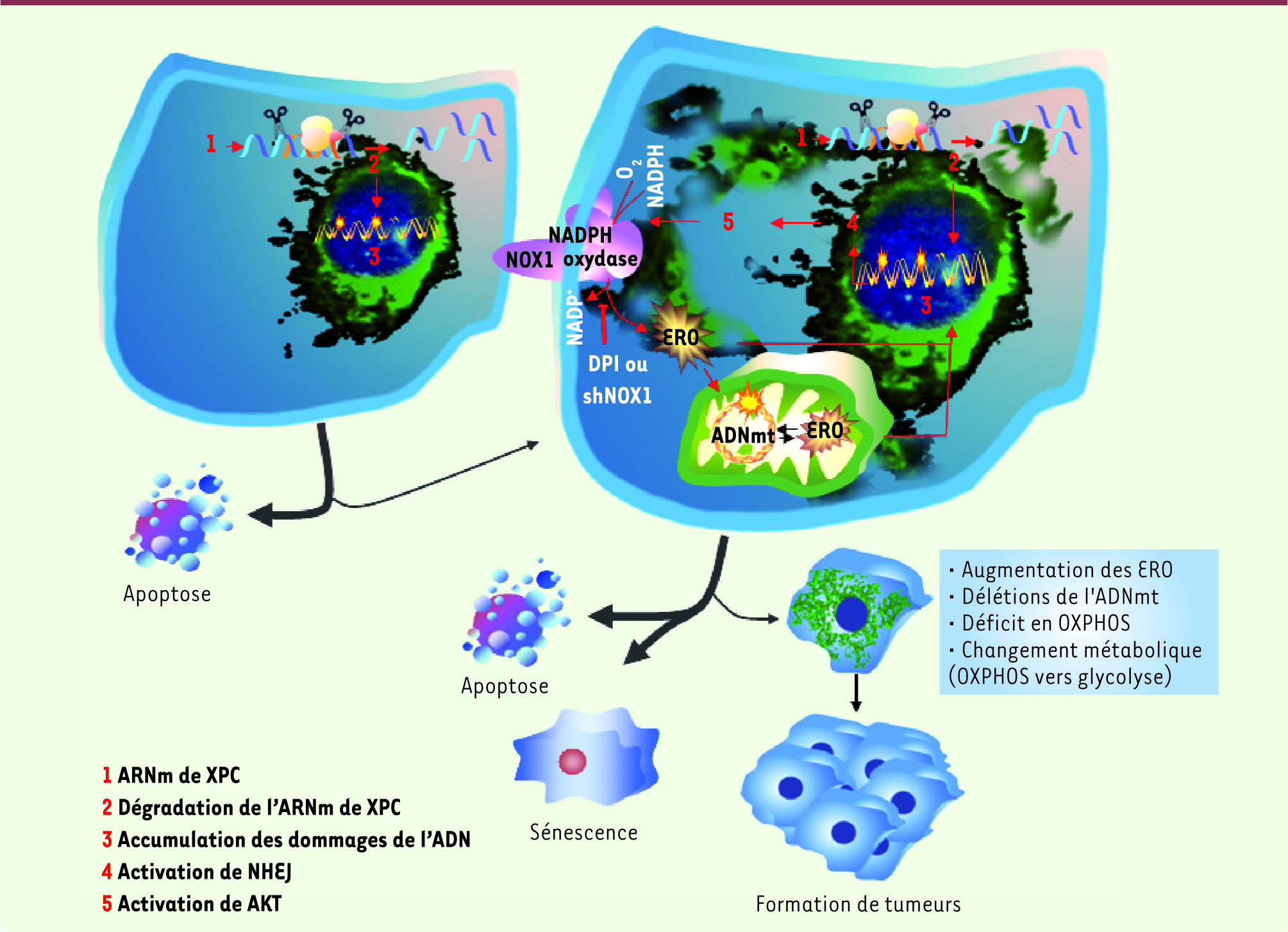
10] a été d’analyser le comportement métabolique et la transformation tumorale des kératinocytes normaux lorsqu’on invalide l’expression de XPC en utilisant des vecteurs lentiviraux qui expriment des petits ARN en « épingle à cheveux » (shRNA) (Figure 2).
 | Figure 2.
Un modèle décrivant les réponses cellulaires à l’invalidation de l’expression de XPC. L’extinction de XPC est obtenue par des shARN exprimés grâce à des vecteurs lentiviraux dans les kératinocytes humains normaux. L’accumulation des mutations suite à cette extinction induit une apoptose. Cependant, certaines cellules échappent à l’apoptose par l’activation de la voie de réparation NHEJ. Cette activation aboutit à l’induction de la voie AKT et de la NADPH oxydase 1 (NOX1) qui à son tour entraîne une augmentation des ERO. L’augmentation d’ERO peut induire l’apparition des mutations de l’ADN génomique et mitochondrial, et par conséquent une altération métabolique par la réduction de la fonction mitochondriale. L’augmentation d’ERO peut aussi induire les mutations d’oncogènes et/ou de gènes suppresseurs de tumeurs conduisant à des anomalies du cycle cellulaire, une prolifération plus importante, et enfin la formation de cellules tumorales. ERO : espèces réactives de l’oxygène; NHEJ : réparation par religation non homologue; DPI : diphénylène iodonium, inhibiteur de NOX; ADNmt : ADN mitochondrial. |
L’analyse de la prolifération des kératinocytes invalidés pour XPC (XPCKD) a montré que certaines cellules ont acquis une capacité de prolifération plus importante que celles des cellules témoins après 15 jours de culture. L’injection des cellules XPCKD à des souris immunodéficientes a abouti à la formation de tumeurs de type carcinome spinocellulaire (CSC), ce qui montre l’utilité de ces cellules pour étudier les phases initiales de la carcinogenèse. Une augmentation constitutive des ERO a été observée dans les cellules XPCKD en culture et des délétions de l’ADN mitochondrial dues à cette augmentation. Ces cellules XPCKD utilisent la glycolyse comme source principale de production d’ATP, comme en témoignent la concentration diminuée de glucose et la concentration élevée de lactate dans le milieu de culture des cellules ainsi que les mesures de la respiration cellulaire. Les analyses mécanistiques ont montré que l’activation de la NADPH oxydase-1 (NOX1) joue un rôle essentiel dans le processus de transformation tumorale. En effet, l’extinction de NOX1 dans ce système peut empêcher l’augmentation des ERO, les délétions de l’ADN mitochondrial, les modifications métaboliques ainsi que la transformation tumorale des kératinocytes XPCKD
(Figure 2) [9, 10]. Compte tenu de l’importance de l’activation de NOX1 dans la transformation tumorale des kératinocytes XPCKD, nous nous sommes intéressés au mécanisme de cette activation. Nos résultats ont révélé que l’accumulation des mutations qui accompagne la diminution de XPC conduit la majorité des cellules à l’apoptose. Cependant, certaines cellules peuvent échapper à l’apoptose par l’activation d’autres voies de réparation telles que, dans notre système, l’activation de la voie de réparation par religation non homologue (NHEJ), une voie qui majoritairement répare les cassures double brin. La mort quasi totale des cellules XPCKD suite à l’inhibition de la voie NHEJ a confirmé cette hypothèse. L’activation de la voie NHEJ peut déclencher, par une phosphorylation, la voie de signalisation AKT [
11] qui régule plusieurs étapes de la glycolyse. Son activation est donc suffisante pour l’induction de l’effet Warburg dans les cellules non transformées ou les cellules cancéreuses [
12]. Or dans notre modèle, l’activation de NOX1 dans les cellules XPCKD est dépendante de l’activation de AKT et par conséquent de la voie NHEJ (Figure 2). En faveur de notre hypothèse, l’inhibition de la voie NHEJ -AKT a entraîné une abolition de l’activation de NOX1 et par conséquent l’inhibition de l’effet Warburg et l’absence de transformation tumorale des cellules XPCKD. |
La majorité des tumeurs cancéreuses développent un métabolisme qui est plus glycolytique qu’oxydatif. Ceci avait conduit Warburg, il y a plus de 80 ans, à soupçonner un déficit de la fonction mitochondriale dans la carcinogenèse. L’importance de l’effet Warburg dans la progression tumorale est aujourd’hui largement confirmée, mais la mécanistique des modifications métaboliques reste à définir. L’utilisation des cellules invalidées pour XPC nous a permis de proposer un nouveau mécanisme par lequel l’accumulation des mutations dans le génome, possible grâce à l’inactivation d’un gène de réparation de l’ADN, peut aboutir à la formation de tumeurs via des effets sur la production des ERO et le métabolisme bioénergétique. En effet, notre étude montre que l’accumulation de mutations n’est pas suffisante seule pour l’induction de la transformation tumorale des kératinocytes XPCKD et que l’augmentation du niveau des ERO et les changements métaboliques sont indispensables pour ce processus. Comme l’activation de NOX a été constatée dans plusieurs tumeurs [9,
13], l’inhibition de cette activation pourrait être une piste originale pour la prévention et la thérapie des cancers liés à une augmentation des ERO. ‡ Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Warburg
O
. On the origin of cancer cells . Science.
1956; ; 123 : :309.-314. 2.
Gatenby
RA
,
Gillies
RJ
. Why do cancers have high aerobic glycolysis ?
Nat Rev Cancer.
2004; ; 4 : :891.-899. 3.
Brandon
M
,
Baldi
P
,
Wallace
DC
. Mitochondrial mutations in cancer . Oncogene.
2006; ; 25 : :4647.-4662. 4.
Yeung
SJ
,
Pan
J
,
Lee
MH
. Roles of p53, MYC and HIF-1 in regulating glycolysis: the seventh hallmark of cancer . Cell Mol Life Sci.
2008; ; 65 : :3981.-3999. 5.
Cleaver
JE
. Cancer in xeroderma pigmentosum and related disorders of DNA repair . Nat Rev Cancer.
2005; ; 5 : :564.-573. 6.
Kraemer
KH
,
Lee
MM
,
Scotto
J
. Xeroderma pigmentosum. Cutaneous, ocular, and neurologic abnormalities in 830 published cases . Arch Dermatol.
1987; ; 123 : :241.-250. 7.
Miccoli
L
,
Burr
KL
,
Hickenbotham
P
, et al.
The combined effects of xeroderma pigmentosum C deficiency and mutagens on mutation rates in the mouse germ line . Cancer Res.
2007; ; 67 : :4695.-4699. 8.
Wijnhoven
SW
,
Kool
HJ
,
Mullenders
LH
, et al.
Age-dependent spontaneous mutagenesis in Xpc mice defective in nucleotide excision repair . Oncogene.
2000; ; 19 : :5034.-5037. 9.
Rezvani
HR
,
Rossignol
R
,
Ali
N
, et al.
XPC silencing in normal human keratinocytes triggers metabolic alterations through NOX-1 activation-mediated reactive oxygen species . Biochim Biophys Acta.
2010; ; 5 : décembre (online).. 10.
Rezvani
HR
,
Kim
AL
,
Rossignol
R
, et al.
XPC silencing in normal human keratinocytes triggers metabolic alterations that drive the formation of squamous cell carcinomas . J Clin Invest.
2011; ; 121 : :195.-211. 11.
Bozulic
L
,
Surucu
B
,
Hynx
D
,
Hemmings
BA
. PKBalpha/Akt1 acts downstream of DNA-PK in the DNA double-strand break response and promotes survival . Mol Cell.
2008; ; 30 : :203.-213. 12.
Robey
RB
,
Hay
N
. Is Akt the Warburg kinase ? Akt-energy metabolism interactions and oncogenesis . Semin Cancer Biol.
2009; ; 19 : :25.-31. 13.
Clerkin
JS
,
Naughton
R
,
Quiney
C
,
Cotter
TG
. Mechanisms of ROS modulated cell survival during carcinogenesis . Cancer Lett.
2008; ; 266 : :30.-36. 14.
Migdal
C
,
Serres
M
. Espèces réactives de l’oxygène et stress oxydant . Med Sci (Paris).
2011; ; 27 : :405.-412. 15.
Compe
E
,
Egly
JM
. Troubles neurologiques et trichothiodystrophie : sans TFIIH, les hormones thyroïdiennes défaillent . Med Sciv (Paris).
2007; ; 23 : :1171.-1172. |