| |
| Med Sci (Paris). 2011 May; 27(5): 464–467. Published online 2011 May 25. doi: 10.1051/medsci/2011275006.Polyglutamylation des microtubules et neurodégénérescence Marie-Jo Moutin,1* Annie Andrieux,1 and Carsten Janke2** 1Institut des neurosciences, Inserm U836-CEA-iRTSV-GPC, Université Joseph Fourier, Grenoble, France 2Institut Curie, CNRS UMR 3306, Inserm U1005, Orsay, France MeSH keywords: Animaux, Axonème, métabolisme, ultrastructure, Survie cellulaire, Cils vibratiles, Cellules eucaryotes, Flagelles, Humains, Microtubules, Modèles neurologiques, Moteurs moléculaires, Dégénérescence nerveuse, Protéines de tissu nerveux, Amino-acid ligases, Maturation post-traductionnelle des protéines, physiologie, Serine-type D-Ala-D-Ala carboxypeptidase, Tubuline |
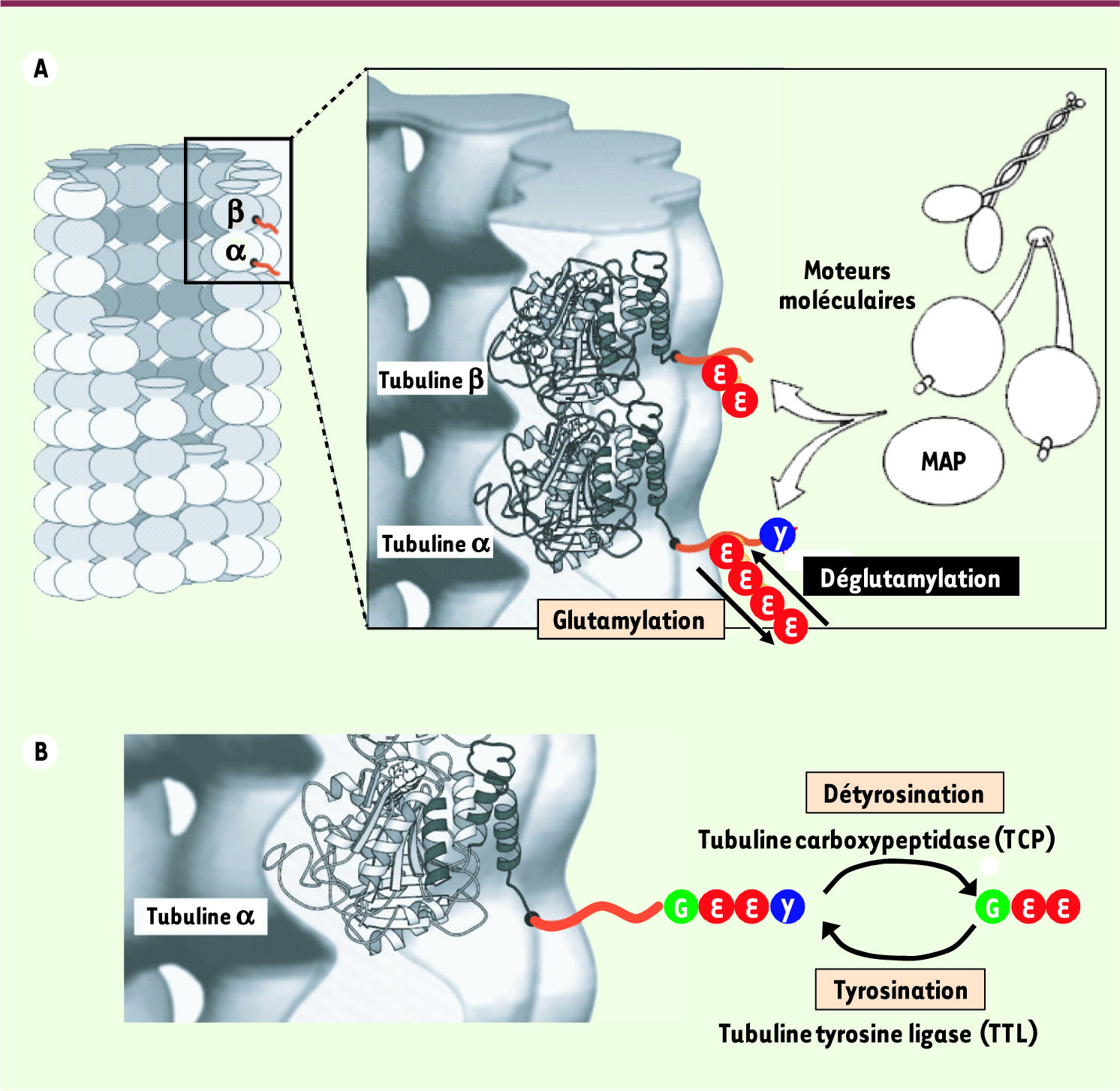
Les microtubules et leur régulation par des modifications post-traductionnelles Les microtubules sont des fibres du cytosquelette cellulaire. Dans les cellules eucaryotes, ils forment un réseau dynamique essentiel à la mobilité et à la morphologie de la cellule ainsi qu’à sa polarité. Dans les cellules nerveuses, par exemple, les microtubules déterminent le choix de l’extension neuritique qui deviendra l’axone du neurone différencié. Les microtubules permettent également le trafic de nombreux organites (mitochondries, vésicules golgiennes ou synaptiques, etc.) ou molécules (comme les ARN) dans le cytoplasme. Lorsque les cellules entrent en mitose, les microtubules forment le fuseau mitotique qui ségrège les chromosomes entre les cellules filles. Les microtubules sont également les composants principaux des cils et des flagelles : ils en constituent l’axe central, l’axonème. Au niveau moléculaire, les microtubules se présentent comme de larges tubes creux dont la paroi est composée de protéines très conservées dans l’évolution, les tubulines. Plus précisément, ce sont des assemblages orientés et dynamiques de dimères de tubuline α et β (
Figure 1A
). Leurs extrémités, en particulier celles appelées bouts « plus » (côté β-tubuline) qui se trouvent vers la périphérie cellulaire, polymérisent et dépolymérisent en permanence. Parce que les besoins en microtubules varient considérablement dans le temps et dans l’espace intracellulaire, la dynamique des microtubules est indispensable et cruciale pour l’exécution de leurs tâches cellulaires.
 | Figure 1.
Modifications post-traductionnelles de la tubuline. A. La polyglutamylation est une modification complexe de la tubuline contrôlée par des glutamylases et des déglutamylases. Les chaînes de glutamates de longueurs variables attachées sur le carboxy-terminus des tubulines α et β représentent des signaux pour les protéines (MAP, moteurs moléculaires) qui interagissent avec les microtubules. B. Le cycle de détyrosination/tyrosination modifie le carboxy-terminus de la tubuline : le résidu tyrosine carboxy-terminal de l’α-tubuline est successivement clivé par une carboxypeptidase (TCP) et ré-ajouté par une ligase (TTL). La TTL a été identifiée. Son absence provoque des défauts d’interaction des microtubules avec certains de leurs partenaires protéiques, engendre une désorganisation neuronale et favorise la progression tumorale [
10–
13]. La TCP reste inconnue à ce jour. Images modifiées à partir de la référence [
14]. |
Avec toujours la même architecture moléculaire, différents microtubules participent donc à des fonctions cellulaires très variées. Pour être le support de toutes ces activités, ils interagissent avec une grande variété de protéines, comme par exemple les MAP (microtubules associated proteins) qui peuvent stabiliser ou déstabiliser les microtubules, ou les divers moteurs moléculaires (dynéines, kinésines) qui se déplacent sur les microtubules pour transporter des organites ou des molécules. Toutes ces interactions entre les microtubules et leurs protéines partenaires sont régulées et coordonnées par diverses modifications post-traductionnelles des tubulines (modifications qui interviennent après la synthèse de la tubuline et souvent après son incorporation dans le microtubule). Ces mécanismes peuvent donc générer d’une façon rapide et réversible des signaux sur des microtubules bien définis. Plusieurs de ces modifications affectent les domaines carboxy-terminaux des tubulines qui sont exposés à l’extérieur des microtubules, comme la polyglutamylation (Figure 1A) et la polyglycylation des tubulines α et β et la détyrosination/tyrosination de la tubuline α (
Figure 1B
). Les modifications post-traductionnelles représentent donc des signaux pour les protéines qui interagissent avec les microtubules. Nous cherchons à comprendre comment celles-ci régulent l’organisation et les fonctions microtubulaires, en particulier dans les cellules nerveuses. |
La polyglutamylation, une modification complexe des microtubules. La polyglutamylation des microtubules, découverte il y a 21 ans par une équipe française [
1], correspond à un attachement covalent de chaînes de glutamates latérales sur le carboxy-terminus des tubulines α et β (Figure 1A). La longueur des chaînes peut être très variable, permettant ainsi de générer sur un seul site de modification toute une gamme de signaux diversifiés. La spécificité pour la tubuline α ou pour la tubuline β, ainsi que la présence de plusieurs sites de modification sur une même molécule de tubuline, augmentent encore la complexité potentielle de ces signaux. On imagine bien en conséquence que ce mécanisme rapide et réversible permet une régulation fine des fonctions et propriétés des microtubules. La polyglutamylation est particulièrement abondante sur les axonèmes des cils et des flagelles et sur les microtubules des cellules nerveuses. Le taux de polyglutamylation est en revanche très faible sur le réseau microtubulaire de la plupart des autres cellules. Mais, lors de la division cellulaire, une augmentation de la polyglutamylation est observée sur les microtubules qui participent directement aux processus de ségrégation du matériel génétique et à la séparation finale des deux cellules sœurs. La polyglutamylation est contrôlée par des activités enzymatiques portées par des glutamylases et des déglutamylases. Les glutamylases ont été identifiées il y a quelques années [
2,
3]. Elles font partie d’une famille de protéines nommées tubuline tyrosine ligase-like (TTLL) qui regroupent les diverses enzymes en charge de l’addition de résidus sur le carboxy-terminus de la tubuline : la tubuline tyrosine ligase (TTL,
Figure 1B
[
4]), les glutamylases (Figure 1A) et les glycyclases [
5,
6]. Au cours de l’évolution, cette famille d’enzymes est apparue avec les cils (au moment de l’émergence des eucaryotes), suggérant un rôle majeur de ces modifications dans l’assemblage de ces organites. Les enzymes catalysant la déglutamylation restaient inconnues jusqu’alors. Notre attention a été attirée par un groupe de gènes, également apparu avec les organismes ciliés, dont les produits présentent des caractéristiques de carboxypeptidases cytosoliques (cytosolic carboxy peptidases ou CCP). Des travaux publiés en 2007 avaient de plus proposé que l’un des membres de cette famille, la CCP1, soit l’enzyme qui enlève la tyrosine carboxy-terminale de la tubuline (la tubuline carboxypeptidase ou TCP,
Figure 1B) [
7,
8]. La possibilité que la CCP1 soit impliquée dans une modification de la tubuline était particulièrement intéressante parce que l’absence de cette carboxypeptidase est associée à un phénotype de dégénérescence neuronale chez la souris, le phénotype pcd (Purkinje cell degeneration, un mutant naturel d’ataxie cérébelleuse). |
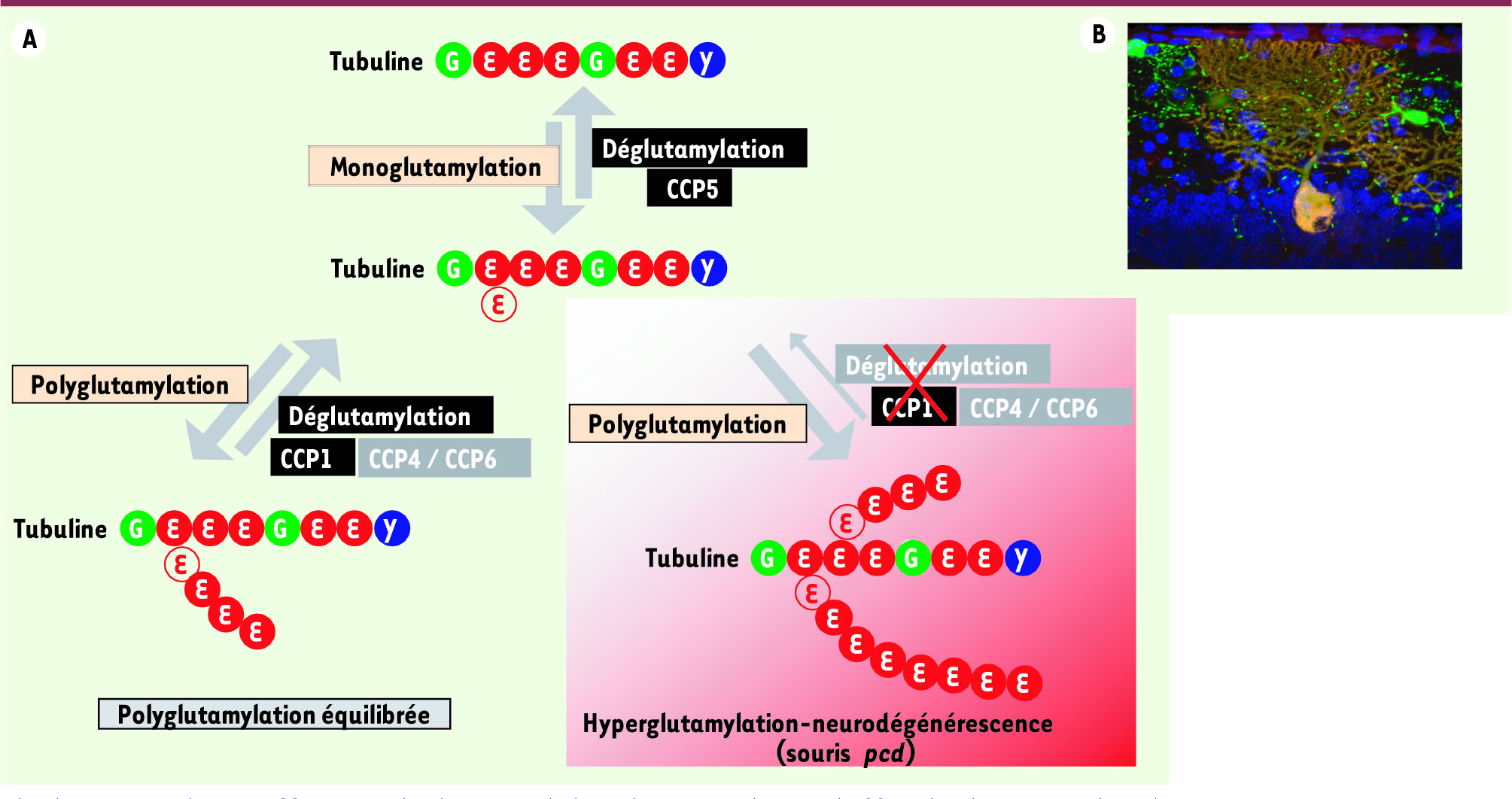
Découverte des déglutamylases et de leur importance pour la survie neuronale Les CCP sont des protéines qui présentent de fortes homologies avec les carboxypeptidases pancréatiques de la digestion : elles possèdent un domaine métallocarboxypeptidase contenant des résidus catalytiques et des résidus de liaison au zinc très conservés. De plus, elles ont la particularité d’être cytosoliques et nous les avons de ce fait considérées comme des enzymes qui pourraient catalyser des clivages d’acides aminés sur la tubuline. Des expériences de surexpression des CCP dans plusieurs types de cellules eucaryotes suivies d’une analyse des taux des modifications post-traductionnelles de la tubuline engendrées nous ont permis d’identifier quatre déglutamylases parmi les six CCP [14]. En décryptant leur fonctionnement, nous avons montré que trois de ces enzymes, CCP1, CCP4 et CCP6, catalysent le raccourcissement des chaînes de glutamates, alors que CCP5 coupe le glutamate de branchement des chaînes latérales générées par la polyglutamylation (Figure 2A). Nous avons également démontré que les déglutamylases fonctionnent de manière coopérative pour permettre la complète réversibilité de la polyglutamylation.
 | Figure 2.
Lien entre polyglutamylation et survie ou dégénérescence neuronales. A. La polyglutamylation doit être strictement régulée dans les neurones. Les glutamylases avaient été identifiées [ 2, 3]. Nous avons découvert les déglutamylases parmi les CCP : trois d’entre elles, CCP1, CCP4 et CCP6, catalysent le raccourcissement des chaînes de glutamates, alors que CCP5 coupe le glutamate de branchement. L’absence de CCP1 chez la souris pcd conduit à une hyperglutamylation des microtubules dans ses cellules de Purkinje (neurones du cervelet) et provoque leur dégénérescence. B. Exemple de cellule de Purkinje que nous avons sauvée de la dégénérescence dans le cervelet de la souris pcd en réduisant l’expression d’une polyglutamylase (TTLL1). Images modifiées à partir de [
9]. |
Considérant l’importance des CCP pour la régulation des taux de polyglutamylation des microtubules, nous avons ensuite analysé la responsabilité de cette modification dans le phénotype de la souris pcd dont le gène CCP1 est altéré suite à une mutation spontanée. Les souris pcd développent des ataxies cérébelleuses liées à la dégénérescence de leurs neurones de Purkinje et deviennent aveugles par dégénérescence de leurs cellules photoréceptrices de la rétine. Depuis sa découverte dans les années 1970, cette souris a été très étudiée et l’élucidation des mécanismes impliqués dans ses dégénérescences neuronales envisagée comme d’importance majeure pour la compréhension de désordres neurologiques. Après avoir découvert que CCP1 est une déglutamylase, nous avons montré que le taux de polyglutamylation est augmenté de façon anormale dans plusieurs régions du cerveau de la souris pcd, et en particulier dans celles qui dégénèrent, comme le cervelet. Cette observation suggère qu’une polyglutamylation excessive des microtubules pourrait induire, par des mécanismes qui restent à comprendre, une dégénérescence neuronale. Pour conforter cette hypothèse, nous sommes parvenus à contrecarrer l’excès de polyglutamylation dans les souris pcd en réduisant l’expression d’une polyglutamylase-clé du cerveau, l’enzyme TTLL1. Ces expériences ont été réalisées par injection d’un virus produisant des ARN interférentiels contre la TTLL1 dans le cervelet de la souris en cours de développement. Nous avons alors observé une survie de cellules de Purkinje du cervelet (Figure 2B) et une temporisation des défauts moteurs ataxiques, traduisant un ralentissement de la neurodégénérescence chez les souris pcd traitées. Nos expériences démontrent que la dégénérescence neuronale de la souris pcd est induite par une polyglutamylation excessive de la tubuline [14]. |
Le taux élevé de la polyglutamylation des microtubules des neurones nous avait permis d’envisager un rôle important de cette modification post-traductionelle pour les fonctions des microtubules. Nos travaux récents révèlent qu’une régulation stricte de la polyglutamylation par les enzymes de déglutamylation est indispensable à la survie neuronale (Figure 2). Comment une hyperglutamylation de la tubuline dans les neurones conduit à leur mort reste cependant une question ouverte. Nous cherchons désormais les protéines régulatrices des microtubules (MAP, moteurs) auxquelles les signaux de polyglutamylation, altérés chez la souris pcd, sont destinés. Des défauts de fonctionnement des microtubules ayant également été révélés associés à plusieurs maladies neurologiques, neurodégénératives et psychiatriques, il apparaît important à l’avenir d’étudier les modifications de la tubuline, et plus particulièrement la polyglutamylation, dans ces contextes pathologiques. ‡ Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
Edde
B
,
Rossier
J
,
Le Caer
JP
, et al.
Posttranslational glutamylation of alpha-tubulin . Science.
1990; ; 247 : :83.-85. 2.
Janke
C
,
Rogowski
K
,
Wloga
D
, et al.
Tubulin polyglutamylase enzymes are members of the TTL domain protein family . Science.
2005; ; 308 : :1758.-1762. 3.
Van Dijk
J
,
Rogowski
K
,
Miro
J
, et al.
A targeted multienzyme mechanism for selective microtubule polyglutamylation . Mol Cell.
2007; ; 26 : :437.-448. 4.
Ersfeld
K
,
Wehland
J
,
Plessmann
U
, et al.
Characterization of the tubulin-tyrosine ligase . J Cell Biol.
1993; ; 120 : :725.-732. 5.
Rogowski
K
,
Juge
F
,
van Dijk
J
, et al.
Evolutionary divergence of enzymatic mechanisms for posttranslational polyglycylation . Cell.
2009; ; 137 : :1076.-1087. 6.
Wloga
D
,
Webster
DM
,
Rogowski
K
, et al.
TTLL3 Is a tubulin glycine ligase that regulates the assembly of cilia . Dev Cell.
2009; ; 16 : :867.-876. 7.
Kalinina
E
,
Biswas
R
,
Berezniuk
I
, et al.
A novel subfamily of mouse cytosolic carboxypeptidases . Faseb J.
2007; ; 21 : :836.-850. 8.
Rodriguez de la Vega
M
,
Sevilla
RG
,
Hermoso
A
, et al.
Nna1-like proteins are active metallocarboxypeptidases of a new and diverse M14 subfamily . Faseb J.
2007; ; 21 : :851.-865. 9.
Rogowski
K
,
van Dijk
J
,
Magiera
MM
, et al.
A family of protein-deglutamylating enzymes associated with neurodegeneration . Cell.
2010; ; 143 : :564.-578. 10.
Erck
C
,
Peris
L
,
Andrieux
A
, et al.
A vital role of tubulin-tyrosine-ligase for neuronal organization . Proc Natl Acad Sci USA.
2005; ; 102 : :7853.-7858. 11.
Lafanechere
L
,
Courtay-Cahen
C
,
Kawakami
T
, et al.
Suppression of tubulin tyrosine ligase during tumor growth . J Cell Sci.
1998; ; 111 : :171.-181. 12.
Peris
L
,
Thery
M
,
Faure
J
, et al.
Tubulin tyrosination is a major factor affecting the recruitment of CAP-Gly proteins at microtubule plus ends . J Cell Biol.
2006; ; 174 : :839.-849. 13.
Peris
L
,
Wagenbach
M
,
Lafanechere
L
, et al.
Motor-dependent microtubule disassembly driven by tubulin tyrosination . J Cell Biol.
2009; ; 185 : :1159.-1166. 14.
Janke
C
,
Rogowski
K
,
van Dijk
J
. Polyglutamylation: a fine-regulator of protein function ? Protein modifications: beyond the usual suspects . EMBO Rep.
2008; ; 9 : :636.-641. |