| |
| Med Sci (Paris). 2011 May; 27(5): 455–457. Published online 2011 May 25. doi: 10.1051/medsci/2011275003.Nouveaux circuits neuronaux amygdaliens contrôlant le comportement de peur Stéphane Ciocchi,1* Andreas Lüthi,2** and Cyril Herry3*** 1Department of Cognitive Neurobiology, Center for Brain Research, Medical University Vienna, Spitalgasse 4, A-1090Vienna, Autriche 2Friedrich Miescher Institute for Biomedical Research, Maulbeerstrasse66, CH-4058Basel, Suisse 3Inserm U862, Neurocentre Magendie, 146, rue Léo Saignat, 33077Bordeaux Cedex, France MeSH keywords: Amygdale (système limbique), physiologie, Animaux, Conditionnement classique, Antagonistes des acides aminés excitateurs, pharmacologie, Peur, Réaction cataleptique, Humains, Lumière, Souris, Modèles neurologiques, Modèles psychologiques, Voies nerveuses, Neurones, classification, effets des radiations, Récepteurs du N-méthyl-D-aspartate, effets des médicaments et des substances chimiques, Thalamus, Acide gamma-amino-butyrique |
La peur est une réponse adaptative essentielle à la survie de nombreuses espèces animales. Ainsi, une réaction de peur insuffisante face à un danger potentiel peut induire une mauvaise estimation des signaux prédisant un futur danger. Au contraire, des réactions de peur excessives et inadaptées aux stimulus environnementaux peuvent réduire les chances de trouver de la nourriture et de se reproduire. Cette adaptation comportementale peut être innée, comme par exemple chez l’homme, chez qui le décryptage des expressions faciales permet l’identification d’émotions telles que la peur et, en conséquence, l’adoption d’un comportement adéquat. Cette adaptation peut être également la conséquence d’un apprentissage au cours duquel un animal apprend qu’un stimulus prédit un évènement désagréable. Cet apprentissage peut être modélisé chez le rongeur par l’utilisation du conditionnement auditif de peur de type pavlovien qui consiste à associer un stimulus sonore à un choc électrique léger délivré aux pattes de l’animal. Au cours de ce conditionnement, les animaux apprennent que le son prédit le choc; la présentation ultérieure du son de façon isolée induit un ensemble de réponses conditionnées incluant notamment une réponse d’immobilisation. |
Structures neuronales impliquées dans l’apprentissage et l’expression du conditionnement de peur De nombreuses données indiquent que l’amygdale, une structure du lobe temporal médian, est fortement impliquée dans l’apprentissage et l’expression des réponses conditionnées de peur [
1–
3]. Dans le modèle classique du conditionnement de peur (Figure 1), les informations relatives au son et au choc en provenance du thalamus sensoriel sont traitées au niveau du noyau basolatéral de l’amygdale, puis relayées au niveau du noyau central. Ce dernier projette sur un ensemble de structures impliquées dans la genèse des réponses autonomiques et comportementales associées à la peur, comme la réponse comportementale d’immobilisation. Dans ce modèle, la mémoire de l’apprentissage de l’association entre le son et le choc est formée et stockée au niveau des neurones de l’amygdale basolatérale. Le noyau central joue, quant à lui, le rôle d’une structure accessoire dont la seule fonction est de permettre l’expression des réponses comportementales de peur. Des travaux récents ont cependant remis en question ce dogme en démontrant que l’inactivation du noyau central de l’amygdale, ou bien l’utilisation d’antagonistes des récepteurs de type NMDA (N-methyl-D-aspartic acid), entraînait un déficit d’acquisition et d’expression des réponses conditionnées de peur [
4,
5]. Bien que ces données suggèrent que l’amygdale centrale soit impliquée dans l’acquisition et l’expression des réponses conditionnées de peur, les circuits neuronaux sous-jacents restent encore largement inconnus.
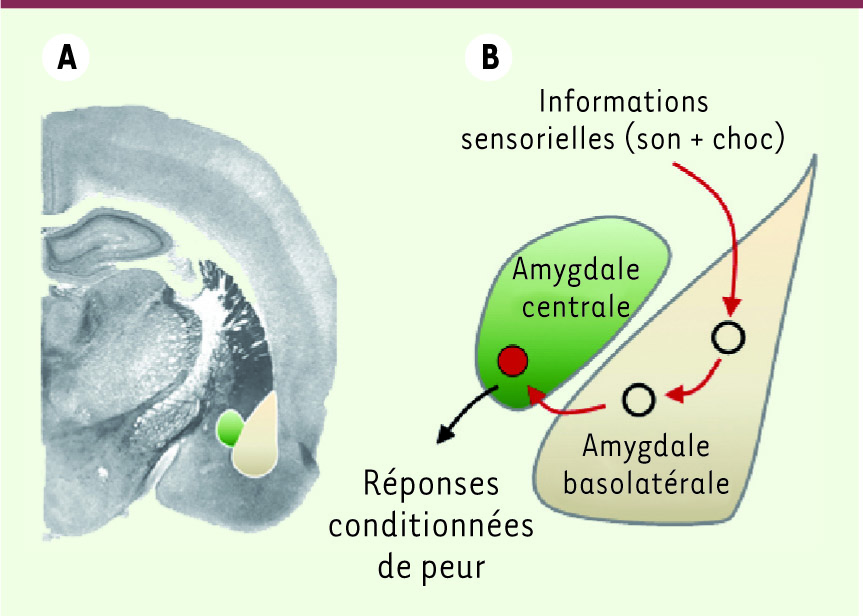
 | Figure 1.
Modèle classique des circuits neuronaux amygdaliens impliqués dans le conditionnement de peur. A. Coupe coronale de cerveau de rongeur mettant en évidence les noyaux basolatéral (en marron) et central (en vert) de l’amygdale localisés au niveau du lobe temporal médian. B. Au cours du conditionnement de peur, les informations sensorielles relatives au son et au choc sont traitées au niveau du noyau basolatéral de l’amygdale puis relayées au niveau du noyau central qui projette sur des structures neuronales impliquées dans la genèse des réponses conditionnées de peur. |
|
Rôle de l’amygdale centrale au cours du conditionnement de peur Le noyau central de l’amygdale se compose d’une partie latérale (le CEl) et d’une partie médiane (le CEm). Une des particularités des neurones du CEl et du CEm est qu’ils synthétisent le principal neurotransmetteur inhibiteur du système nerveux central : l’acide γ-aminobutyrique ou GABA. Une des propriétés des neurones GABAergiques est leur influence inhibitrice sur les autres cellules nerveuses et des données anatomiques et fonctionnelles récentes ont révélé l’existence d’une connexion inhibitrice entre le CEl et le CEm [
6–
8]. Le rôle fonctionnel de cette connexion inhibitrice au cours du conditionnement de peur n’a pas encore été identifié, mais la levée de l’influence inhibitrice du CEl sur le CEm pourrait permettre l’activation des neurones du CEm et l’expression des réponses comportementales de peur lors du conditionnement. Pour tester cette hypothèse, nous avons utilisé des techniques optogénétiques qui consistent, par le biais de méthodes génétiques, à rendre sensibles à la lumière des groupes spécifiques de neurones. Cette manipulation permet ainsi le contrôle de l’activité de ces neurones par des impulsions lumineuses. Cette stratégie nous a permis de rendre sensibles à la lumière les neurones du CEm et d’observer que leur activation était suffisante pour générer une réponse d’immobilisation de l’animal. D’autre part, une stratégie d’inactivation pharmacologique réversible ciblées permettant d’inhiber transitoirement l’activité d’un groupe de neurones nous a permis de mettre en évidence que l’inactivation du CEl était associée à une immobilisation des animaux. Ces données indiquent que le CEm est nécessaire à l’expression des réponses comportementales d’immobilisation et qu’il est sous le contrôle inhibiteur du CEl. Nous avons ensuite évalué le rôle du CEl et du CEm au cours du conditionnement de peur par l’utilisation des techniques d’inactivation pharmacologique. Nous avons constaté que l’inactivation du CEl pendant le conditionnement bloque l’apprentissage de l’association entre le son et le choc mais n’a aucun effet lorsqu’elle est réalisée à la suite du conditionnement. Au contraire, l’inactivation du CEm pendant le conditionnement n’a aucun effet sur l’apprentissage mais elle perturbe l’expression comportementale des réponses conditionnées de peur lorsqu’elle est réalisée à la suite du conditionnement. Ces données indiquent que le CEl et le CEm jouent un rôle différent au cours du conditionnement : alors que le CEl est nécessaire à l’acquisition du conditionnement de peur, le CEm permet son expression comportementale. |
Différentes populations neuronales de l’amygdale centrale contrôlent l’acquisition et l’expression du conditionnement de peur Pour identifier les populations neuronales du CEl et du CEm impliquées dans l’acquisition et l’expression des réponses conditionnées de peur, nous avons par la suite utilisé des techniques électrophysiologiques extracellulaires permettant d’enregistrer en temps réel l’activité de neurones chez un animal au cours du comportement. Les enregistrements effectués indiquent que le CEl contient deux populations de neurones fonctionnellement distinctes qui forment des circuits inhibiteurs très organisés qui permettent l’inhibition du CEm (Figure).
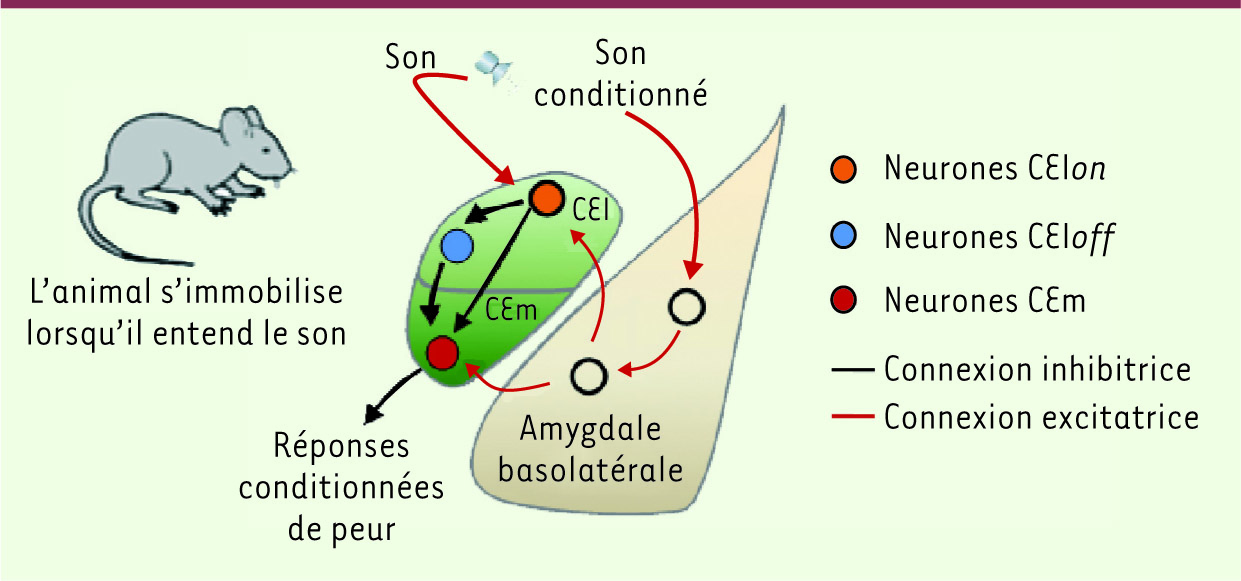
 | Figure 2.
Nouveau modèle des circuits neuronaux amygdaliens impliqués dans le conditionnement de peur. À la suite du conditionnement, la présentation du son conditionné induit l’activation des neurones inhibiteurs CElon du noyau central latéral (CEl). Ces neurones sont principalement connectés avec les neurones CEloff ce qui a pour conséquence une inhibition de leur activité neuronale lors de la présentation du son. Les neurones CEloff exercent en condition basale une influence inhibitrice tonique sur les neurones CEm du noyau central médian. Lors de la présentation du son, l’inhibition des neurones CEloff induit une levée d’inhibition des neurones CEm ce qui a pour conséquence l’expression des réponses conditionnées de peur. |
La première population neuronale est activée (neurones CElon) alors que la deuxième est inhibée (neurones CEloff) par la présentation du son conditionné. Ces modifications opposées de l’activité de ces deux populations neuronales suggèrent que les neurones CElon pourraient inhiber les neurones CEloff au cours du conditionnement, une hypothèse que nous avons validée par des analyses d’interactions fonctionnelles. Les analyses effectuées révèlent également que les neurones CEloff sont connectés avec les neurones du CEm et les inhibent de façon tonique en condition basale. Au cours du conditionnement, l’inhibition des neurones CEloff permet de lever cette inhibition tonique sur les neurones du CEm, ce qui induit leur activation et l’augmentation concomitante des réponses conditionnées de peur. De plus, des travaux réalisés en parallèle ont mis en évidence que les cellules CEloff produisent une protéine de signalisation unique, la protéine kinase C delta, ce qui permet de manipuler sélectivement ces neurones afin de contrôler le comportement de peur [
9]. L’ensemble de ces travaux a ainsi permis d’identifier l’architecture fonctionnelle des microcircuits de l’amygdale centrale et leur rôle dans l’acquisition et la régulation des réponses conditionnées de peur [
10] (Figure 2). |
L’identification des circuits neuronaux de l’amygdale centrale impliqués dans le comportement de peur permet d’envisager à terme le développement de nouvelles approches thérapeutiques pour le traitement de pathologies comme le syndrome de stress post-traumatique. Ce dernier se caractérise notamment par une persistance de réponses pathologiques de peur lors de la présentation d’un stimulus associé à un événement traumatique et par la généralisation de ces réponses pathologiques de peur à des stimulus qui ne sont pas associés à l’évènement traumatisant. À terme, la manipulation sélective des circuits neuronaux de l’amygdale centrale devrait permettre de contrôler plus spécifiquement les manifestations comportementales de peurs pathologiques. Conflits d’interets
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
|
1.
LeDoux
JE
. Emotion circuits in the brain . Annu Rev Neurosci.
2000; ; 23 : :155.-184. 2.
Davis
M
. The role of the amygdala in conditioned and unconditioned fear and anxiety . In :
Aggleton
JP
ed. The amygdala . Oxford: : Oxford University Press; , 2000 ; :213.-288. 3.
Maren
S
,
Quirk
GJ
. Neuronal signalling of fear memory . Nat Rev Neurosci.
2004; ; 5 : :844.-852. 4.
Goosens
KA
,
Maren
S
. Pretraining NMDA receptor blockade in the basolateral complex, but not the central nucleus, of the amygdala prevents savings of conditional fear . Behav Neurosci.
2003; ; 117 : :738.-750. 5.
Wilensky
AE
,
Schafe
GE
,
Kristensen
MP
,
LeDoux
JE
. Rethinking the fear circuit: the central nucleus of the amygdala is required for the acquisition, consolidation, and expression of Pavlovian fear conditioning . J Neurosci.
2006; ; 26 : :12387.-12396. 6.
Cassell
MD
,
Freedman
LJ
,
Shi
C
. The intrinsic organization of the central extended amygdala . Ann NY Acad Sci.
1999; ; 877 : :217.-241. 7.
Veinante
P
,
Freund-Mercier
MJ
. Branching patterns of central amygdaloid nucleus afferents in the rat: single axon reconstructions . Ann NY Acad Sci.
2003; ; 985 : :552.-553. 8.
Huber
D
,
Veinante
P
,
Stoop
R
. Vasopressin and oxytocin excite distinct neuronal populations in the central amygdala . Science.
2005; ; 308 : :245.-248. 9.
Haubensak
W
,
Kunwar
PS
,
Cai
H
, et al.
Genetic dissection of an amygdala microcircuit that gates conditioned fear . Nature.
2010; ; 468 : :270.-276. 10.
Ciocchi
S
,
Herry
C
,
Grenier
F
, et al.
Encoding of conditioned fear in central amygdala inhibitory circuits . Nature.
2010; ; 468 : :277.-282. |