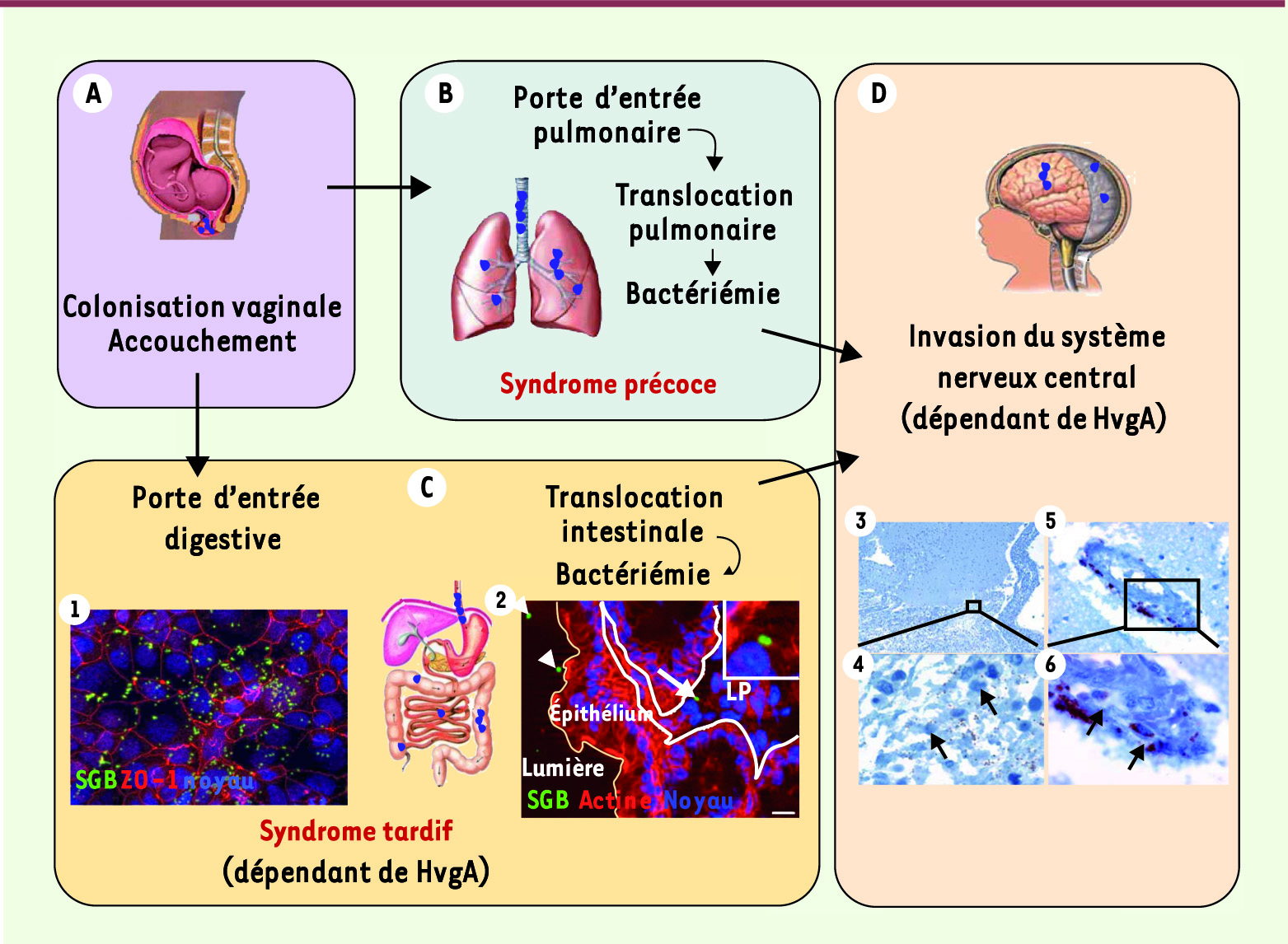
L’infection néonatale à streptocoque du groupe B se manifeste par deux syndromes distincts : un syndrome précoce survenant au cours de la première semaine de vie et un syndrome tardif se déclarant de 7 jours à 3 mois après la naissance [ 1]. Le syndrome précoce résulte d’une contamination du nouveau-né durant l’accouchement par ingestion et/ou inhalation des sécrétions vaginales maternelles colonisées par le streptocoque du groupe B (Figure 1). La contamination du nouveau-né peut alors aboutir à une translocation bactérienne à travers l’épithélium pulmonaire et à une infection systémique [1]. Le mode de transmission et la physiopathologie du syndrome tardif demeurent en revanche méconnus, bien qu’une transmission mère-enfant soit également suspectée. Une colonisation intestinale précoce suivie d’une translocation digestive permettant l’accès de la bactérie à la circulation sanguine constitue un scénario hautement probable [ 3, 4]. Les données épidémiologiques collectées par le Centre national de référence des streptocoques indiquent qu’une proportion importante de syndromes précoces et la majorité des syndromes tardifs sont associés à un sérotype capsulaire particulier de streptocoque du groupe B, le sérotype III [ 5]. Les souches de sérotype III comprennent un nombre limité de complexes clonaux définis par multi locus sequence typing (MLST) [ 6]. Parmi ceux-ci, le séquence-type (ST) ST-17 est fortement associé aux cas de méningites néonatales et a donc été désigné « hypervirulent » [6]. Ce qualificatif qui repose sur des données d’épidémiologie moléculaire n’avait jusqu’à présent jamais été validé ar des approches expérimentales. Le clone ST-17 est également très majoritairement responsable des cas de syndrome tardif. C’est sur la base de ces données épidémiologiques qui suggèrent que le clone ST-17 possède une virulence accrue dans le contexte néonatal que nous avons recherché des facteurs de virulence spécifiques au clone ST-17 pouvant expliquer son hyperpathogénicité chez les nouveau-nés et son tropisme pour le système nerveux central.
| Figure 1
Scénario physiopathologique de l’infection néonatale à streptocoque du groupe B. A. Le nouveau-né se contamine lors de l’accouchement par inhalation et ingestion des sécrétions vaginales et du liquide amniotique contaminés de la mère. B. Le syndrome précoce (au cours de la première semaine de vie) résulte d’une infection pulmonaire qui peut aboutir à une bactériémie et donc secondairement à une invasion du système nerveux central. C. Le syndrome tardif (de 7 à 89 jours) est probablement dû à une colonisation intestinale précoce qui dépend de l’adhésine HvgA, suivie d’une translocation digestive, et secondairement d’une bactériémie avec invasion possible du système nerveux central. Les deux encadrés (1 et 2) illustrent la localisation digestive des streptocoques du groupe B (clone ST-17) in vitro (1) sur des cellules intestinales Caco2 et in vivo (2) sur des coupes de côlon de souris infectées par voie orale avec du streptocoque du groupe B. LP : lamina propria. Pointes de flèches : bactéries intraluminales. Flèche : bactéries dans la lamina propria. D. L’invasion du système nerveux central par les bactéries circulantes (quel que soit le mode de contamination initial) est favorisée par l’adhésine HvgA. Les 4 images illustrent l’analyse immuno-histopathologique du système nerveux central d’un nouveau né décédé d’un syndrome tardif avec méningite. Les méninges (3, 4) et les micro-vaisseaux cérébraux (5, 6) sont envahis de streptocoques du groupe B révélés à l’aide d’un anticorps polyclonal spécifique de SGB (flèches). |